“问题串”教学设计策略与教学功能——以“氯气”和“二氧化硫”的教学为例
2015-10-09张丽华
张丽华
(江苏省海门中学 江苏 海门 226100)
“问题串”是指在一定学习范围或主题内,围绕一定教学目标,按照一定逻辑结构精心设计的一组问题。善教者,必善问,高效课堂的关键就在于教师如何围绕核心知识设计出一系列“问题串”,帮助学生在知识水平和能力提升方面越过一级级阶梯。笔者前一段时间面向全省开设了两节元素化合物的公开观摩课,分别是“氯气”和“二氧化硫”,其中“二氧化硫”一课已经在江苏省中小学教研室“教学新时空·名师课堂”播出,受到了听课老师和评课专家的一致好评。反思这两节课的教学设计,除了在元素化合物教学中,常规的关注学生实验探究外,“问题串”的设置,成功地将相关核心知识进行了拓展延伸,学生在课堂45分钟能轻松顺利接受了看似大量而繁琐的知识,让课堂真正做到了高效。本文旨在结合具体教学案例,探讨元素化合物知识教学中设计优质的问题串的教学策略,构建元素化合物“问题串”教学模式的高效课堂。下面就以这两课为例,谈谈笔者对“问题串”的理解与实施。
一、设置分割式问题串,化抽象为具体
“分割式”就是针对学习中比较抽象,整体性强的知识,如果作为一个问题提出,学生难以直接理解和把握。此时教师可以把这些问题分割成多个小问题,化整为零,最终达到自然解决问题的目的。
教学片断1:在“氯水的成分”教学时,“氯气溶解在水中,发生了怎样的变化?”这个问题比较笼统,整体性强。在讲解之前,我预设了几个问题:
问题1:请观察氯水的颜色,这说明了什么?
问题2:如果氯气与水仅仅是物理溶解,溶液中应该存在哪些微粒?
问题3:如果它们发生了化学变化,预测溶液中可能存在的微粒,并给出检验该微粒存在的实验方法?
问题4:怎样解释实验中出现的异常现象?
在4个问题中,1,2两问相对容易,学生很快能得出氯气与水发生了物理溶解,溶液中存在Cl2和H2O分子。但第3问又激起了学生的求知欲,根据已有知识,稍加思考,可以给出他们的猜测,即增加H+和Cl-,学生利用 AgNO3溶液可以检出 Cl-,但在使用 pH试纸或紫色石蕊试液对H+进行检验时,却出现了异常(pH试纸中间变白,边缘红色;石蕊试液先变红后褪色)。而问题4怎样解释该异常现象,是整个问题的难点和关键,通过交流讨论,学生容易给出的答案是Cl2分子在起漂白作用。教师可以顺势做演示实验:把一张干燥的红纸伸入装满氯气的集气瓶中(红纸并没有漂白),此时问题表面上看变得更加复杂,学生的好奇心却再次被老师调到高点,学生的思维也更加发散,接下来兴奋的学生们应该想到可能是生成了新的物质 (教师也可提示学生从氧化还原反应的角度分析),这样HClO这个重要的新物质自然就呈现在学生的面前。
通过“分割式”设置这个问题,不仅顺利地解决了“氯气溶解在水中,发生了怎样的变化”这个复杂的问题,同时还把氯气的漂白原理、氧化还原原理的应用等重要知识点糅合其中,自然贴切,润物无声。
二、设置递进式问题串,突破重难点
“递进式”就是对有一定难度和深度的问题,通过设置由易到难,逐层递进的小问题,环环相扣,引导学生层层剖析,最终豁然开朗。
教学片断2:在“SO2漂白性”教学时,经常有学生被“漂白”这种现象所迷惑,认为褪色就是“漂白”,究其原因,还是不了解漂白的本质原理。在教授SO2的有漂白性时,我提出了以下递进式问题串:
问题1:回顾氯水的漂白原理?
问题2:试从氧化还原角度分析SO2与Cl2有何区别?
问题3:请通过实验现象及阅读教材归纳SO2漂白原理?
问题4:SO2能使品红、酸性KMnO4溶液、含酚酞的氢氧化钠溶液褪色,都是漂白吗?怎样设计实验证明?
本环节中问题1的设置旨在引导学生回顾旧知,为对比理解SO2的漂白性做好铺垫;问题2意在通过S和Cl元素化合价的差异,分析两者在氧化性还原性方面的差别;通过问题1、2的分析及实验现象(SO2能使品红褪色,但加热条件下又可以复原),自然解决了问题3,即SO2与有机色素化合生成不稳定的无色物而起漂白作用。问题4是本环节的升华,知识的综合性强,是高考的重点和难点,也是学生最易混淆的点。但学生在前面原理分析清楚的情况下,通过设计以下对比实验能很清晰的分析出三者的褪色原理。

操作1 现象 操作2 现象 结论试管1:通SO2的品红溶液 化合反应试管2:通SO2的酸性KMnO4溶液红色复原加热 继续滴加酸性KMnO4的溶液 红色逐渐加深 氧化还原反应试管3:通SO2的酚酞NaOH溶液 继续滴加NaOH溶液 红色出现 中和反应
递进式问题串的设置,教师将学生已有的知识点为启发点,启发学生联想知识,以旧带新,由浅入深,学生会感到整个学习过程自己像个演员一样逐渐入戏,兴致盎然,最终达到顺利攻克疑难的目的。
三、设置矛盾式问题串,深化知识点
“矛盾式”就是通过创设矛盾式问题情境,引发学生现有认知结构和原有认知结构之间的冲突,促使学生积极思考和探索,培养学生思维的严谨性和批判性。
教学片断3:平时的作业和教学中,经常发现学生无法理解和区分SO2与Ba(OH)2溶液、BaCl2溶液反应的情况,对此,我设置了如下问题串:
问题1:CO2气体通入足量的澄清石灰水中发生了怎样的反应?现象如何?
问题2:请预测 SO2气体分别通入Ba(OH)2溶液和BaCl2溶液现象并通过实验验证?
问题3:怎样解释实验中出现的异常现象?
问题1为学生熟悉的初中化学内容,以此为来创设问题情境,有利于增强学生自信,激发他们参与的热情;但问题2的预测中,就有很多同学想当然的认为两者都有沉淀,但实验验证时出现了矛盾,BaCl2溶液未见明显的白色沉淀。此时,教师可以引导学生书写预测的化学方程式:SO2+H2O+BaCl2BaSO3+2HCl,对此方程式的不合理性学生容易看出。就在学生认为该问题已经解决时,教师指导学生再次观察试管,却发现试管中并非澄清透明,还是有少量浑浊产生,新的矛盾现象再次扣动学生心弦,同时也为SO2与O2的反应做好了铺垫。
矛盾式问题串设置,教师先创设矛盾式问题情景,并通过实验现象逐步展现矛盾冲突,环环相扣,可以激发学生强烈的求知欲望和寻找解决问题的强大动力,对相关的化学原理也会理解得更加透彻。
四、设置综合式问题串,构建知识网络
“综合式”就是对情境复杂、知识点繁琐易混淆的情况下,教师对此进行整合分类,以问题串的形式提出,从而避免教学形式的单一、枯燥。
教学片断 4:在“SO2”一课的课堂总结时,由于SO2的性质较多,如果使用简单罗列的传统归纳方法,难免会有单调的感觉。因此,我设置了以下一套装置,将SO2的性质内化于其中,并提出以下问题:
问题1:请依据所示装置,从物质分类的角度归纳出SO2的主要化学性质?
问题2:该装置中有何不妥之处?你还可以作怎样的改进?
问题3:该装置中哪些部分可以鉴别SO2和CO2气体?
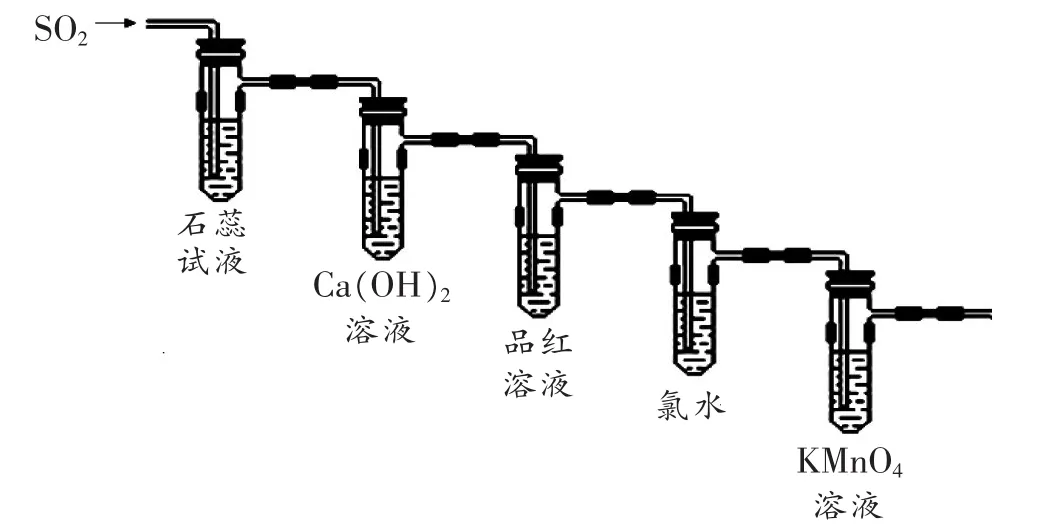
问题1、2的设置,一方面把归纳总结的主动权交给了学生,让他们对SO2的性质有了全面的把握,又能启发学生不断提出问题。另一方面,培养了学生从物质分类角度解读化学知识,培养学生的化学思辨能力。问题3旨在通过对比SO2和CO2,让学生从本质上真正掌握SO2的性质,健全了知识网络。
综合式问题串的设置具有省时高效的特点,它不仅能优化课堂结构,节约课堂时间,还能推动或加速学生思维能力的发展,在高考复习中也是个好方法。
教学反思:
这样的课堂是充满活力的课堂,学生不再呆板被动,他们总是带着问题思考,带着问题探究,使学生真正拥有了学习的主动权。当然,这样的课堂,对教师提出了较高的要求,教师不仅要备课充分,还能结合教学目标、学生现状及生活实际,设计出有价值的“问题串”;同时给出的问题一定要有明显的坡度,既能保证基础,又能升华提高。总之“问题串”就是这样把高中化学核心的问题进行细化和深化,通过一问一答的引导和深入,让学生自己找到了真正的答案,是一线教师在长期教学实践过程中不断摸索而形成的高效课堂的教学策略。
[1] 中华人民共和国教育部.普通高中化学课程标准 (实验)[S].北京:人民教育出版社,2003:2
[2] 王峰.基于问题串的教材“二次开发”研究[J].化学教学,2013,(3)
[3] 胡久华.沉淀溶解平衡教学中驱动性问题链的设计与实践[J].化学教育,2012,(9)
