邓恩桉不同成熟度组织中rboh基因表达分析
2015-10-09彭丽君温小芳黄真池
彭丽君,温小芳,黄真池
(1. 岭南师范学院生命科学与技术学院,广东湛江524048;2. 岭南师范学院应用生物技术研究所,广东 湛江524048;3. 岭南师范学院资源植物工程中心,广东 湛江524048)
邓恩桉(Eucalyptus dunnii Maiden)是桉树属-双蒴盖亚属(subgenus symphyomyrtus)-蓝桉组(section Maidenaria)-多枝桉系(series Vim inales)中的速生树种之一[1],其木材是良好的纸浆材来源。邓恩桉幼树相对其他树种比较耐寒[2],因此是培养耐寒桉树的优选品种。在我国较冷地区推广邓恩桉,不仅有巨大的经济价值,还能为绿化、增施防护林、增加木材产量等作出贡献。
rboh 基因的表达产物为NADPH 氧化酶,又称呼吸爆发氧化酶同源蛋白(respiratory burst oxidase homolog,rboh),是一类以细胞质中的NADPH 为电子供体,将氧催化生成活性氧(reactive oxygen species,ROS)的氧化酶[3]。植物在正常生理代谢过程中会产生活性氧,这些活性氧一方面可能会对植物自身造成氧化伤害[4],另一方面也可能作为信号分子参与细胞周期调控、程序性死亡、激素信号、生物和非生物胁迫反应及生长发育等生命活动的调节[5-7]。已有试验表明,rboh 基因在拟南芥[8]、烟草[9-10]、马铃薯[11]、水稻[12]及玉米[13]的抗病、抗水分等抗胁迫反应中发挥了重要功能。在桉树中,rboh 基因的表达活性与冷胁迫及抗寒机制有着密切联系[14]。研究检测了邓恩桉不同成熟度组织rboh 基因的表达量,探讨了其与邓恩桉生长分化的联系,以期为培育耐寒桉树提供参考。
1 材料与方法
1.1 供试材料
半年生邓恩桉树苗(Eucalyptus dunnii Maiden),由湖南森林植物园提供。
1.2 材料的培养与处理
剪取邓恩桉嫩茎,先用清水冲洗表面灰尘,再用75%酒精表面消毒45 s,然后用20%次氯酸钠消毒两次,每次7 m in,最后用无菌水淋洗干净。将嫩茎切成1 cm 左右的茎段,接种到添加了0.86 μmol/L N-苯基-N- 噻唑基脲(PBU) 和0.57 μmol/L 吲哚乙酸(IAA)的SPCa 培养基中。先暗处培养2 周,再转移至16 h 光照/8 h 黑暗、50 μmol/m2·s 光强、25±2℃培养箱中继续培养4 周。
1.3 PCR 分析
1.3.1 总RNA 的提取和反转录 用手术刀分别取20 mg 邓恩桉的成熟叶、不定芽和嫩茎于研钵中研磨。先用1 m l RNAiso-mater for Plant Tissue 处理,再按RNAiso Plua 试剂的操作手册提取总RNA,溶于30 μL RNAase-free H2O。在10 μL 反应体系中分别加入5×gDNA Eraser Buffer 2 μL、gDNA Eraser 1 μL 和总RNA 1 μg,用RNAase-free H2O 补齐至10 μL 后瞬间离心混匀,30℃反应5 min 以去除总RNA 中残存的基因组DNA。再在上述反应体系中依次加入5×PrimeScript Buffer 4 μL、PrimeScript RT Enzyme M ix I 1 μL、RT Prime M ix 1 μL 和RNAase-free H2O 4 μL,瞬间离心混匀,37℃反应15 m in,85℃5 S 使酶失活,所得产物为cDNA。上述所用试剂均为宝生生物工程(大连)有限公司产品。
1.3.2 目的基因选择及引物设计 根据ThePeroxiBase数据库中巨桉过氧化物酶基因的序列,用primer3 plus软件设计qPCR 引物。经qPCR 预试验筛选出3个扩增效率高、特异性好的rboh 基因作为目的基因。根据黄真池等[15]的研究,选择RTEF 基因作为内参基因。目的基因编号、引物序列及内参基因引物序列见表1。

表1 3种NADPH 氧化酶基因的编号和引物序列及内参基因的引物序列
1.3.3 qPCR 分析rboh 基因 qPCR 反应仪器为Chromo 4TMSystem(Bio-Rad)。以cDNA 溶液进行qPCR。25 μL 反应体系中,添加2 μL cDNA 溶液作模板,每个反应3 次重复。qPCR 程序为:变性94℃9 s,退火58℃9 s,延伸72℃15 s。40个循环后,分析PCR产物的特异性。用Opticon Monitor 3.1 软件分析各基因的扩增效率、Ct 值。设嫩茎的基因表达量为1,用相对定量的Pfaff1 方法计算各基因的相对表达值。
2 结果与分析
2.1 不定芽的诱导
嫩茎切段接种在SPCa 培养基中,15 d 后不定芽直接从芽原基处长出,呈浅绿色(图1)。50 d 后,不定芽变得较为粗壮,苗茎伸展,叶子大而舒展。

图1 邓恩桉萌发的不定芽
2.2 总RNA 的提取
桉树组织中多糖、酚类等物质含量丰富,严重干扰了RNA 的提取。经RNAiso-mate for Plant Tissue 预处理,再用RNAiso Plus 抽提,均可从邓恩桉不定芽、嫩茎和成熟叶中提取出高质量的RNA。经NanoDrop 2000c 紫外分光光度法检测,样品OD260/OD280为1.9~2.05。琼脂糖凝胶电泳结果显示,总RNA 条带清楚、完整,无明显降解,且无可见的DNA 污染(图2)。
2.3 rboh 基因和内参基因的扩增特异性分析
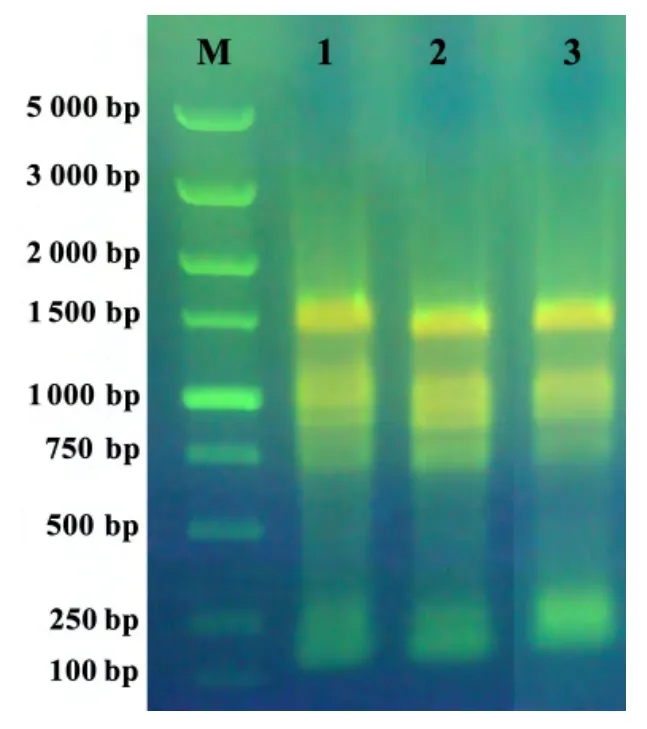
图2 3种邓恩桉组织总RNA 的琼脂糖凝胶电泳结果
由图3 可知,rboh 基因和内参基因的融链曲线均只有1个特征峰值,RTEF、rboh2、rboh3 和rboh4 基因的融链温度分别为82、86、85、82℃,说明qPCR 扩增特异性好。

图3 rboh 基因和RTEF 基因qPCR 融链温度
2.4 rboh 基因表达
设嫩茎的基因表达量为1,qPCR 检测得到了邓恩桉3种不同成熟度组织中rboh2、rboh3 和rboh4 的相对定量表达结果(图4)。这3个基因在成熟叶组织中的表达量最高,嫩茎次之,不定芽的表达量最低。其中成熟叶中的rboh2 基因的表达量约为不定芽中的5倍,成熟叶中rboh4 基因的表达量约为不定芽中的3倍。3个rboh 基因在不同成熟度组织中的转录水平由强到弱依次为成熟叶>嫩茎>不定芽。

图4 邓恩桉不定芽和成熟叶相对于嫩茎中的rboh 基因转录水平
3 结论与讨论
活性氧作为植物的代谢中间产物,不仅影响植物各器官(根、茎、叶、花、果实、种子)的生长发育[16],并且与其他信号分子如水杨酸[17-20]、NO[17,21]等共同调节植物的各种生理活动。实验证明,NADPH 氧化酶是植物细胞活性氧产生的主要酶类之一[22-27],即rboh 基因是调节植物各种生理活动的关键基因。影响rboh 基因表达的因素有很多,水分胁迫、重金属胁迫、盐胁迫、高低温胁迫等都能影响和调节rboh 基因的表达和ROS 的积累[28]。试验表明,在适宜的生长条件下,随着植物生长发育程度的不同,rboh 基因的表达量也会有所差异,即邓恩桉rboh 基因的表达受组织分化程度的影响。
桉树的抗寒机制相当复杂,不仅受过氧化物的影响,还受原生质膜透性、膜脂成分、保护酶以及可溶性物质等的影响[29]。rboh 基因在邓恩桉抗寒代谢中是如何起作用的,其是否对邓恩桉抗寒代谢起关键作用,这些问题有待于进一步开展遗传转化方面的研究。
[1]林 彦.邓恩桉组培快繁体系的建立及应用[D].北京:中国林业科学研究院,2004.
[2]林成立.邓恩桉扦插繁殖试验[J].福建林业科技,2005,32(2):80-84.
[3]林 凡.玉米(Zeamays L.)NADPH氧化酶基因克隆、表达特性及功能研究[D].南京:南京农业大学,2008.
[4]Apel K,Hirt H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction[J].Annual Review of Plant Biology,2004,55:373-399.
[5]Mittler R,Vanderauwera S,Gollery M,et al.Reactive oxygen gene network of plants[J].Trends in Plant Science,2004,9:490-498.
[6]Foyer C H,Noctor G.Redox sensing and signalling associated with reactive oxygen in chloroplasts,peroxisomes and mitochondria[J].PhysiolPlant,2003,119:355-364.
[7]Fujita M,Fujita Y,Noutoshi Y,et al.Crosstalk between abiotic and biotic stress responses:a current view from the points of convergence in the stress signaling networks[J].CurrentOpinion in Plant Biology,2006,9:436-442.
[8]Kwak JM,Mori I C,Pei Z M,et al.NADPH oxidase AtrbohD and AtrbohF genes function in ROS-dependent ABA signaling in Arabidopsis[J].The EMBO Journal,2003,22(11):2623-2633.
[9]Simon-Plas F,Elmayan T,Blein JP.The plasma membrane oxidase NtrbohD is responsible for AOS production in elicited tobacco cells[J].Plant Journal,2002,31(2):137-147.
[10]Yoshioka H,Numata N,Nakajima K,et al.Nicotiana benthamiana gp91phox homologs NbrbohA and NbrbohB participate in H2O2accumulation and resistance toPhytophthora infestans[J].Plant Cell,2003,15(3):706-718.
[11]KobayashiM,KawakitaK,MaeshimaM,etal.Subcellular localization of Strboh proteinsand NADPH-dependentO2-generatingactivity in potato tuber tissues[J].Journal of Experimental Botany,2006,57(6):1373-1379.
[12]Yoshie Y,Goto K,Takai R,et al.Function of the rice gp91phox hom-ologs OsrbohA and OsrbohE genes in ROS-dependent plant immune responses[J].PlantBiotechnol,2005,22(2):127-135.
[13]赵 宇,蒋明义,张阿英,等.水分胁迫诱导玉米Zmrboh基因表达及ABA在其中的作用[J].南京农业大学学报,2008,3(13):26-30.
[14]刘 建,项东云,周 坚.桉树抗寒生理及分子机理研究进展[J].西南林学院学报,2006,26(5):81-85.
[15]黄真池,欧阳乐军,张 龙,等.桉属植物内参基因的筛选及评估[J].西北农林科技大学学报,2013,41(10):67-72.
[16]林植芳,刘 楠.活性氧调控植物生长发育的研究进展[J].植物学报,2012,47(1):74-86.
[17]田 敏,饶龙兵,李纪元.植物细胞中的活性氧及其生理作用[J].植物生理学通讯,2005,41(2):235-240.
[18]Dat JF,Foyer CH,Scott IM.Changes in salilylic acid and antioxidants during Induced thermo to lerance inmustard seedlings[J].PlantPhysiol,1998,118:1455-1461.
[19]Dat JF,Lopez-Delgado H,Foyer C H,et al.Parallel changes in H2O2and catalase during thermo to lerance induced by salicylic acid or heat acclimationmustard seedlings[J].PlantPhysiol,1998,116:1351-1357.
[20]Van Camp W,Van Montagu M,Inze D.H2O2 and NO:redox signals in disease resistance[J].Trends in PlantScience,1998,3:330-334.
[21]BeligniM V,Lamattina L.Nitric oxidestimulatesseed ger-mination and de-etiolation,and inhibits hypocotyl elongation,three light-inducible responses in plants[J].Planta,2000,210:215-221.
[22]蔡以滢,陈 珈.植物防御反应中活性氧的产生和作用[J].生物学通报,1991,16(2):107-112.
[23]LAMBC,DixonRA.Theoxidativeburstin theplantdiseaseresistance[J].Annual Review of Plant physiology and Plant Molecular Biology,1997,48(1):251-275.
[24]Sagi M,Fluhr R.Superoxide production by plant homologue of the gp91phox NADPH oxidase.Modulation of activity by calcium and by tobaccomosaicvirusinfection[J].PlantPhysiol,2001,126(3):1281-1290.
[25]Zhao ZG,Chen G C,Zhang C L.Interaction between reactivee oxygen species and nitric oxide in drought-induced absciisic acid synthesis in root tips ofWheat seedings[J].Australian Journal or Plant Physiology,2001,28(10):1055-1061.
[26]Song C J,Steinebrunner I,Wang X Z,et al.Extracellular ATP induces the accumulation of superoxide via NADPH oxidases in Arabidop sis thaliana[J].PlantPhysiol,2006:105.
[27]宫海军,陈坤明,陈国仓,等.春小麦叶片质膜氧化还原系统及其对缓慢干旱胁迫的响应[J].西北植物学报,2003,23(2):229-234.
[28]Fry S C.Oxidation scission of plant cell wall polysaccharides by ascorbateinduced hydroxyl radicals[J].Biochem Journal,1998,332:507-515.
[29]赵娟娟,洪 伟.我国桉树抗寒性研究进展[J].福建林学院学报,2005,25(3):284-288.
