茭草和芦苇叶片光合与荧光特性对土壤持续干旱的响应
2015-10-06赵湘江
赵湘江,田 昆,杨 兰,刘 昊
(1.西南林业大学 环境科学与工程学院,云南 昆明 650224;2.国家高原湿地研究中心,云南 昆明 650224;3.重庆大学,重庆 400044;4.西南林业大学 林学院,云南 昆明 650224)
茭草和芦苇叶片光合与荧光特性对土壤持续干旱的响应
赵湘江1,田昆2,3,杨兰1,刘昊4
(1.西南林业大学 环境科学与工程学院,云南 昆明 650224;2.国家高原湿地研究中心,云南 昆明 650224;3.重庆大学,重庆 400044;4.西南林业大学 林学院,云南 昆明 650224)
对茭草Zizania latifolia和芦苇Phragmites australi进行自然持续干旱处理,测定植物叶片光合作用特征参数和叶绿素荧光参数及相应的土壤水分含量,探讨茭草、芦苇叶片对土壤持续干旱胁迫的光合生理响应。随着土壤水分逐渐减少,茭草叶片净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)均先增大后减小,芦苇叶片的Pn、Tr、Gs均逐渐减小;茭草和芦苇叶片的胞间二氧化碳浓度(Ci)、光化学最大量子效率(Fv/Fm)、非光化学猝灭系数(NPQ)、水分利用率(WUE)、有效荧光产量(Yield)、电子传递速率(ETR)、光化学猝灭系数(qP)变化趋势一致,其中Ci逐渐增大,Fv/Fm、NPQ、WUE先增大后减小,Yield、ETR、qP逐渐减小。分析表明,当茭草和芦苇遭遇较严重干旱时,叶片Pn下降主要是非气孔限制因素导致;当生长基质(沙土)的田间持水量为19%,速效氮、磷、钾分别为28.14、2.25、25.76 mg·kg-1,pH 7.2时,茭草的干旱胁迫阈值在土壤含水量(2.17 ± 0.18)%和(1.66 ± 0.23)%之间,芦苇的干旱胁迫阈值在土壤含水量(1.84 ± 0.17)%和(0.25 ± 0.07)%之间。
土壤持续干旱;茭草;芦苇;光合作用特征参数;叶绿素荧光参数
在人类活动和气候变化的影响下,全球性干旱问题日趋严重,水资源短缺加剧,湿地面积大幅减少,干旱对湿地植物的胁迫愈加突出,湿地植物对干旱逆境的响应与适应成为湿地生态学的研究热点之一[1—3]。光合作用是植物体内重要的代谢过程,对环境因子的响应高度敏感。干旱条件下,植物光合作用、蒸腾作用等生理过程以及气孔导度、胞间CO2浓度等指标均会发生相应变化,同时植物CO2同化速率降低,光合作用消耗的光能减少,导致天线色素吸收的光能大量过剩,过剩光能如不能及时有效地耗散就会损伤光合结构[4—7]。叶绿素荧光动力学技术在测定叶片光合作用过程中光系统对光能的吸收、传递、转换、耗散、分配等方面具有独特的作用,与“表观性”的气体交换指标相比,叶绿素荧光参数更具有反映“内在性”的特点,被称为测定叶片光合功能的快速、无损伤探针,环境因子对光合作用的影响可通过叶绿素荧光动力学反映出来[8—10]。因此,叶片光合作用特征参数和叶绿素荧光参数变化可反映干旱胁迫条件对植物产生的影响。
茭草Zizania latifolia、芦苇Phragmites australi是高原湿地常见优势挺水植物,在高原湿地植物研究中具有典型性和代表性。目前,有关湿地挺水植物的研究多集中于水文情势、水深、盐胁迫、干旱胁迫等对植物生长发育和形态结构产生的影响等方面[11—13]。关于土壤水分胁迫对湿地挺水植物光合生理的影响方面也有一定研究。芦苇的叶片水分含量、叶绿素含量、气体交换参数及叶绿素荧光参数受土壤含水量显著影响,且其光合系统II(PSII)对土壤干旱缺水反应较敏感[14—16];在土壤逐渐干旱条件下,短期内土壤水分含量下降有利于菖蒲Acorus calamus生长,干旱加剧,菖蒲生长则逐渐受到抑制,但叶片保持较高的热耗散,仍能维持正常的光合结构[17];而香蒲Typha orientalis在干旱胁迫下,生长明显受抑制,生理生化活性降低,叶片光合效率下降[18]。这些研究多在土壤水分含量静态控制条件下进行,而土壤持续干旱过程中水分含量处于动态递减,现有研究难以反映湿地植物对土壤水分瞬时、连续变化的动态响应。本研究在土壤逐渐干旱过程中,连续监测茭草、芦苇叶片的光合作用特征参数和叶绿素荧光参数,探讨茭草、芦苇在土壤连续干旱过程中的动态响应机制,为高原湿地生态系统植被恢复重建及科学补水提供参考依据。
1 材料与方法
1.1实验地概况
实验地(102°45′E,25°04′N)位于西南林业大学校园内,海拔1946 m。该地春季干燥少雨,日温变化大,月平均气温多在20 ℃以下;夏季雨量集中,降雨量占全年雨量的60%以上,平均气温22 ℃;秋冬季日照充足,天晴少雨,每月晴天平均在20 d左右,日照230 h左右,雨日4 d左右,全季降雨量仅占全年的3%~5%。全年平均气温15 ℃,年均日照2200 h,年降水量1035 mm,年温差为全国最小,日温差较大。
1.2实验设计
选取典型高原湿地滇池生态系统中分布广泛、有代表性的优势挺水植物茭草和芦苇为研究对象。2013年4月上旬,将生长健壮、长势一致、无病虫害的茭草和芦苇自滇池湖滨带移栽至实验池(2.0 m × 1.2 m × 0.8 m),基质为沙土(田间持水量为19%,速效氮、磷、钾分别为28.14、2.25、25.76 mg·kg-1,pH 7.2),厚度15 cm,株行距15 cm,常规栽培管理(12月刈割)1年。于2014年4月中旬新芽完全长出(茭草约80 cm,芦苇约120 cm)开始实验。
首先让实验床每个单元明水面消失(土壤水分处于饱和状态),之后自然连续干旱(雨天遮雨),分别于干旱处理第1、7、15、22、28 天(均为晴天)测定土壤水分含量及植物叶片光合作用特征参数和叶绿素荧光参数(每次测量各5次重复),至芦苇、茭草分别有90%和85%的叶片变色枯黄(分别干旱处理第22天和第28天)实验结束,实验时间自2014年4月17日至5月15日。实验期间实验池土壤水分含量变化如表1。

表1 实验池土壤含水率变化及叶片荧光光反应测定光强Table 1 The change of soil moisture content and Par in fluorescence measurement
1.3测定方法
1.3.1土壤水分含量测定将小铝盒在105 ℃恒温箱中烘烤2 h,移入干燥器内冷却至室温,称重,计m0;用土钻取适量土混匀后装入铝盒称重,计m1;将铝盒置于已预热至(105 ± 2) ℃的烘箱中烘烤至恒重,计m2。称量精确至0.001 g。
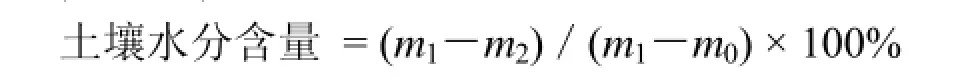
1.3.2光合作用特征参数和叶绿素荧光参数测定光合作用特征参数和叶绿素荧光参数用Li-6400光合仪的标准荧光叶室进行测定,干旱处理第1、7、15、22、28天上午1100(∶叶片处于光适应状态)利用田间自然环境[光强973.5 μmol·m-2·s-1,温度(28.94 ± 0.36) ℃,CO2浓度(390.63 ± 0.86) μmol·mol-1],打开活化光(设置与外界光强基本一致),将事先标记过的叶片依次置于荧光叶室内,测定光下最小荧光Fo'、光下最大荧光Fm'、稳态荧光Ft,同时测量出植物叶片的基本光合作用特征参数净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、叶片荧光光反应测定光强(Par)、胞间CO2浓度(Ci)等;分别于光反应测量前一天晚上2230(∶叶片已进行充分暗适应),对同一叶片测定其最小初始荧光Fo和最大荧光Fm。叶绿素荧光特征参数按以下公式计算。
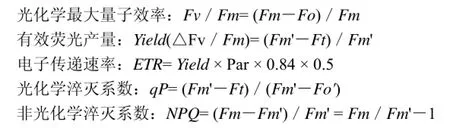
1.4数据处理
采用Excel2007及SPSS11.5进行数据分析和制图,采用单因素方差分析法,多重比较采用LSD法在P<0.05水平下对不同数据间的差异进行检验比较。
2 结果与分析
2.1 对光合作用特征参数的影响
随着土壤水分逐渐减少,茭草叶片的净光合速率(Pn)和气孔导度(Gs)先变化不明显后显著减小,而芦苇叶片的Pn、Gs呈现逐渐减小趋势;茭草和芦苇叶片的胞间CO2浓度(Ci)变化趋势一致,均逐渐增大(图1)。

图1 茭草和芦苇叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)变化Fig. 1 The changes of Pn, Gs and Ci of Zizania latifolia and Phragmites australis leaves
Pn是估测植株光合生产能力的主要依据之一。干旱初期和中期(第7、15、22天),茭草叶片Pn变化不明显,但在干旱处理第28天时显著下降(P<0.05);芦苇叶片Pn逐渐减小,在第15、22天明显下降(P<0.05)。
Gs表示气孔张开的程度,一般Gs大则气孔张开大,对水分传输的阻力小,植物能够顺利进行水、气交换;Gs小,表明气孔张开小,对水分传输的阻力大,抑制水分的流失[19]。茭草叶片Gs在干旱处理第22天前无明显变化(P>0.05),干旱处理第28天时Gs明显减小(P<0.05);芦苇叶片Gs逐渐减小,第15、22天时Gs显著小于干旱初期(P<0.05)。
随着干旱处理时间延长,茭草叶片胞间CO2浓度(Ci)逐渐增大,第15、22天时Ci已显著大于干旱处理初期(P<0.05),第28天时Ci极显著增大;芦苇在干旱处理第15天前,Ci值缓慢增大,而在第22天时显著大于干旱处理初期(P<0.05)。
2.2对蒸腾速率和水分利用效率的影响
蒸腾作用是植物对水分及矿质养分吸收和运输的主要动力,而蒸腾速率(Tr)是反映蒸腾作用强弱的重要指标,光合作用需要不断供应水分和通过水分运载的矿质养分,因此Tr的变化趋势通常与Pn一致[20]。如图2,茭草叶片Tr在干旱处理第15天前变化不明显,此后减小,芦苇叶片Tr逐渐减小。
植物水分利用率(WUE=Pn/Tr)高,表明固定单位质量 CO2所需水量少,植物节水能力强,耐旱,生产力高[21]。茭草在干旱处理前15 d叶片WUE无明显变化,在干旱处理第22天变大,干旱处理末期(第28天)显著减小;芦苇叶片WUE在干旱前期变化不大,至干旱处理后期(第28天)骤减(图2)。

图2 茭草和芦苇叶片蒸腾速率(Tr)与水分利用率(WUE)变化Fig.2 The changes of Tr and WUE of Zizania latifolia and Phragmites australis leaves
2.3对叶绿素荧光参数的影响
初始荧光(Fo)是光系统Ⅱ(PSⅡ)反应中心处于完全开放时的荧光产量,天线色素的热耗散增加常导致Fo降低,PSⅡ反应中心破坏或可逆失活则可引起Fo增加[22]。实验中,茭草和芦苇叶片的Fo变化趋势一致(图3),在干旱初期(第7天)均无明显变大,随着干旱加剧,Fo均增大。
光化学最大量子效率(Fv/Fm)反映了当所有的光合系统 II(PSII)反应中心均处于开放态时的量子产量[23]。茭草叶片Fv/Fm在干旱处理前15 d变化不明显,第15天到第22天缓慢减小,第22天时Fv/Fm值已明显小于干旱初期(P<0.05),第28天时显著减小;芦苇叶片Fv/Fm在干旱处理前7 天变化不明显,但是在第15和22 天时明显减小(P<0.05)(图3)。
有效荧光产量(Yield)表示在光照下PSⅡ的实际光化学效率,反映吸收的光子供给PSⅡ反应中心的效率[24]。茭草和芦苇叶片 Yield变化趋势一致,随着土壤逐渐干旱均逐渐减小(图 3)。茭草叶片 Yield在干旱处理前22天依次缓慢减小,而在第28天时显著减小(P<0.05);芦苇叶片Yield在干旱处理前期(第7天)缓慢减小,第15天时明显小于干旱初期,第22天时显著减小(P<0.05)。
PSⅡ的相对光合电子传递速率(ETR)是反映实际光强下的表观电子传递效率,用于度量光化学反应导致碳固定的电子传递情况[21]。茭草叶片ETR在前22 d处理依次缓慢减小,但第15天时ETR值已明显小于干旱处理初期,ETR值在第28天时显著减小;芦苇叶片ETR在干旱处理前15天缓慢减小,而在第22天时明显减小(P<0.05)(图3)。

图3 茭草和芦苇叶片叶绿素荧光参数变化Fig. 3 The changes of chlorophyll fluorescence parameters of Zizania latifolia and Phragmites australis leaves
光化学淬灭系数(qP)是 PSⅡ天线色素吸收的光能用于光化学电子传递的份额,较低qP反映PSII反应中心开放的比例和参与CO2固定的电子减少;非光化学淬灭系数(NPQ)反映天线色素吸收的光能不能用于电子传递而以热的形式耗散的光能[16,21]。如表2,茭草叶片qP逐渐减小,在干旱处理第22天时已明显小于干旱处理初期(P<0.05),而NPQ前22 d处理中变化不明显(P>0.05),在第28天时明显减小(P<0.05);芦苇叶片qP在干旱处理第15天和第22天时均明显减小(P<0.05),而NPQ在干旱处理第22天时显著减小。

表2 茭草和芦苇叶片qP与NPQ变化Table 2 The changes of qP and NPQ of Zizania latifolia and Phragmites australi leaves
3 讨论
研究表明,引起Pn降低的气孔和非气孔限制因素可以根据植物叶片Ci的变化来判断,当Pn下降伴随着Ci和Gs降低时,可认为Pn的下降主要是受气孔限制所致,如果Pn下降的同时Gs减小,但Ci升高或者不变,则主要是非气孔限制因素(叶肉细胞光合活性下降)所致[25—26]。本研究中,干旱初期,茭草叶片Pn和Tr变化不明显,同时Gs和Ci也比较平稳,说明短期干旱处理对茭草叶片的光合活性无明显影响;随着土壤干旱加剧,茭草叶片Pn、Tr和Gs逐渐减小,而Ci逐渐增大,且Pn和Tr减小的幅度和Ci增大的幅度成正比(Pn和Tr缓慢减小时Ci缓慢增大,Pn和Tr急剧减小时Ci急剧增大),说明干旱引起的茭草净光合速率下降是非气孔限制因素导致的。有研究表明,在干旱胁迫初期,芦苇叶片净光合速率以气孔限制为主,随着胁迫时间加长,其限制因素以非气孔因素为主[27],这与本研究结果有一定出入,可能与实验中干旱处理前期(第7天)土壤含水率下降幅度较大有关。
适度干旱能使植物水分利用效率提高[10,28]。茭草叶片在干旱初期WUE无明显变化,Pn、Tr、Gs及Ci也变化不大说明茭草在实验前期并没有受到干旱胁迫伤害。随着土壤进一步干旱,茭草和芦苇叶片WUE均增大后又急剧减小,说明此时土壤干旱对植物产生了严重影响,但在土壤干旱程度未达到阈值之前,茭草、芦苇通过提高WUE以适应干旱环境。茭草在第28天、芦苇在第22天时,叶片WUE急剧减小,同时各自的Pn、Tr、Gs也急剧减小,说明此时土壤干旱程度已超过茭草、芦苇干旱胁迫阈值。可知在本实验控制条件下,茭草的干旱胁迫阈值在土壤含水量(2.17 ± 0.18)%和(1.66 ± 0.23)%之间,芦苇的干旱胁迫阈值在土壤含水量(1.84 ± 0.17)%和(0.25 ± 0.07)%之间,表明湿地挺水植物的耐旱性存在差异。该结果进一步支持了邓春暖等[14]干旱持续15 d内对芦苇光合作用和生长不会造成明显影响的结论。因此,在发生持续干旱时,对根系发达的茭草一类挺水植物,补水宜在22 d之内进行;对芦苇一类植株高大的挺水植物则在15 d内进行补水为宜。
叶绿素荧光参数是评估PSⅡ状态良好与否的指标。在逆境条件下,当光能吸收量超过光化学反应的利用量,且过剩的光能得不到耗散时,就会引起光合机构的破坏,其原初损伤部位在PSⅡ上[29]。本研究中,在干旱处理前期,茭草和芦苇叶片的Fo表现出略微的下降,至第15天均表现出增加趋势,说明此时茭草和芦苇叶片PSⅡ反应中心均受到一定程度的损伤。随着干旱加剧,芦苇叶片Fo明显增加,而茭草叶片Fo增加不明显,说明干旱处理末期芦苇叶片PSⅡ反应中心受损害程度较茭草严重,这是由干旱处理中芦苇实验床土壤含水量下降幅度更大引起的(芦苇植株密度较小,实验床土壤大部分直接暴露于太阳光下,相比于分蘖较多、密度较大的茭草,土壤保水性较差)。Fv/Fm反映的是PSⅡ原初光能转化效率及PSⅡ潜在活性,当植物处在正常环境条件下时,该参数一般为0.75~0.85,但在逆境或受害时会明显降低[30—32]。本研究中,茭草叶片在干旱处理第22天时,Fv/Fm值(0.752)已明显小于干旱初期(0.820),到干旱处理末期(第28天)已下降至0.660;而芦苇叶片Fv/Fm值在干旱处理第15天时已明显下降,说明茭草和芦苇分别在干旱处理第22天和第15天光合作用原初反应过程受到破坏,这与上述植物WUE的结果一致。干旱处理末期茭草和芦苇叶片Fv/Fm值均极显著下降(P<0.01),此时PSⅡ受到严重破坏。
Yield和 ETR在一定程度上可体现植物光合作用效率,两者均随着土壤水分减少而减小,说明从干旱处理开始茭草和芦苇就受到逆境胁迫,只是此时干旱胁迫尚未超过胁迫阈值,茭草和芦苇仍能通过酶促反应来调节叶肉细胞活性,表现出一种适应机制,受影响的外观表征并不严重,干旱处理前期茭草、芦苇叶片的Yield和ETR值减小不明显。到干旱处理末期,茭草和芦苇叶片的PSⅡ遭破坏,PSⅡ反应中心光子需求量减少,表观电子传递效率下降,导致茭草和芦苇叶片的Yield、ETR急剧降低。随着土壤水分减少,PSⅡ反应中心开放程度变小,天线色素吸收光能不能有效用于光化学电子传递,参与CO2固定的电子减少,所以茭草和芦苇叶片qP逐渐减小。茭草叶片qP在干旱处理第22天时明显减小,但NPQ值在前22 d无明显变化,第28天时明显减小;芦苇叶片qP在干旱处理第15天时明显减小,而NPQ值在前15 d不减反略增,直到干旱处理末期(第22天)突然减小,说明茭草和芦苇在一定土壤干旱范围内能通过保持较高的热耗散机制来维持光合结构 PSⅡ相对正常;茭草和芦苇叶片 NPQ值分别在干旱处理第28天和第22天(干旱处理末期)突然显著减小,表明此时茭草和芦苇叶片的光合结构PSⅡ受到损坏,对热能的耗散能力也几乎丧失殆尽,王文林等[17]的研究也得出类似结果。
[1] 张辉. 气候变化和人类活动对黑河流域水资源的影响[D]. 兰州: 兰州大学硕士学位论文, 2010.
[2] 赵雅静,翁伯琦,王义祥,徐国忠. 植物对干旱胁迫的生理生态响应及其研究进展[J]. 福建稻麦科技, 2009,27(2): 45—50.
[3] 吴芹,张光灿,裴斌,方立东. 3个树种对不同程度土壤干旱的生理生化响应[J]. 生态学报, 2013,33(12): 3648—3656.
[4] Chaves M, Flexas J, Pinheiro C. Photosynthesis under drought and salt stress: Regulation mechanisms from whole plant to cell[J]. Annals of Botany, 2009,103: 551—560.
[5] 褚建民,孟平,张劲松,高峻. 土壤水分胁迫对欧李幼苗光合及叶绿素荧光特性的影响[J]. 林业科学研究, 2008,21(3):295—300.
[6] 王萌萌,陈忠林,贾楠,徐苏男,张利红. 水分胁迫前的干旱锻炼对小麦光合生理特性的影响[J]. 农业环境科学学报,2010,29(10): 1930—1935.
[7] 丛雪,齐华,孟凡超,刘明. 干旱胁迫对玉米叶绿素荧光参数及质膜透性的影响[J]. 华北农学报, 2010,25(5): 141—144.
[8] Massacci A, Nabiev S M, Pietrosanti L, Nematov S K, Chernikova T N, Thor K, Leipner J. Response of photosynthesis apparatus of cotton to the onset of drought stress under field conditions by gas change analysis and chlorophyll fluorescence imaging[J]. Plant Physiology and Biochemistry, 2008,46(2): 189—195.
[9] Efeoglu B, Ekmekci Y, Cicek N. Physiological responses of three maize cultivars to drought stress and recovery[J]. South African Journal of Botany, 2009,75(1): 34—42.
[10] 裴斌,张光灿,张淑勇,吴芹,徐志强,徐萍. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J]. 生态学报,2013,33(5): 1386—1396.
[11] White S D, Ganf G. A comparison of theorphology, gas space anatomy and potential for internal aeration in Phragmites autralis under variable and static water regimes[J]. Aquatic Botany, 2002,73: 115—127.
[12] Naumman L C, Young D R, Anderson J E. Linking leaf chlorophyll fluorescence properties tophysiological responses for detection of salt and drought stress in coastal plant species[J]. Physiologia Plantarura, 2007,131: 422—433.
[13] 周珺,魏虹,吕茜,李昌晓,王振,高伟,陈伟. 土壤水分对湿地松幼苗光合特征的影响[J]. 生态学杂志, 2012,31(1): 30—37.
[14] 邓春暖,章光新,潘响亮. 干旱胁迫对莫莫格湿地芦苇叶片光合生理生态的影响机理研究[J]. 湿地科学, 2012,10(2):136—141.
[15] 冯大兰,刘芸,钟章成,杨娟,谢君. 三峡库区消落带芦苇(Phragmites communis (reed))的光合生理响应和叶绿素荧光特性[J]. 生态学报, 2008,28(5): 2013—2021.
[16] 曹昀,王国祥,张聃. 干旱对芦苇幼苗生长和叶绿素荧光的影响[J]. 干旱区地理, 2008,31(6): 862—869.
[17] 王文林,万寅婧,刘波,王国祥,唐晓燕,陈昕,梁斌,庄巍. 土壤逐渐干旱对菖蒲生长及光合荧光特性的影响[J]. 生态学报,2013,33(13): 3933—3940.
[18] 吴晓东,王国祥,李振国,夏劲,魏宏农,许宽,周锋. 干旱胁迫对香蒲生长和叶绿素荧光参数的影响[J]. 生态与农村环境学报, 2012,28(1): 103—107.
[19] 云文丽,侯琼,王海梅,张超,闫伟兄. 河套灌区食用向日葵光合作用的光响应曲线分析[J]. 中国油料作物学报,2013,35(4): 405—410.
[20] 刘惠,赵平,蔡锡安,曾小平,孙谷畴. 坡地和沼泽地野牡丹(Melastoma candidum)叶片的解剖特征与气孔气体交换特性[J]. 热带亚热带植物学报, 2005,13(2): 109—116.
[21] 孙学凯,范志平,王红,白洁,张营,邓东周. 科尔沁沙地复叶槭等3个阔叶树种的光合特性及其水分利用效率[J]. 干旱区资源与环境, 2008,22(10): 188—194.
[22] 李强,王国祥,王文林,马婷,潘国权. 悬浮泥沙水体对穗花狐尾藻(Myriophyllum spicatum L.)光合荧光特性的影响[J].湖泊科学, 2007,19(2): 197—203.
[23] 周晓红,王国祥,冯冰冰. 光照对菹草(Potamogeton cripus)幼苗生长发育和光合荧光特性的影响[J]. 生态环境,2008,17(4): 1342—1347.
[24] 王文林,王国祥,李强,马婷,潘国权. 悬浮泥沙对亚洲苦草幼苗生长发育的影响[J]. 水生生物学报, 2007,31(4): 460—466.
[25] 运向军,卫智军,杨静,吴燕玲. 禁牧休牧短花针茅草原主要植物种光合特性研究[J]. 干旱区资源与环境, 2010,24(7):138—143.
[26] Chartzoulakis K, Patakas A, Kofidis G, Bosabalidis A, Nastou A. Water stress affects leaf anatomy, gas exchange, water relations and growth of two avocado cultivars[J]. Scientia Horticulturae, 2002,95: 39—50.
[27] 张永强,毛学森,孙宏勇,李文杰,于沪宁. 干旱胁迫对冬小麦叶绿素荧光的影响[J]. 中国生态农业学报, 2002,10(4): 13—15.
[28] Heitholt J. Water use efficiency and dry matter distribution in nitrogen and water-stressed winter wheat[J]. Agronomy Journal, 1989,81: 464—469.
[29] 惠红霞,许兴,李前荣. 外源甜菜碱对盐胁迫下枸杞光合功能的改善[J]. 西北植物学报, 2003,23(12): 2137—2142.
[30] Weng J H, Lai M F. Estimating heat tolerance among plant species by two chlorophyll fluorescence parameters[J]. Photosynthetica, 2005,43(3): 439—444.
[31] 宋婷,张谧,高吉喜,韩永伟. 快速叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J]. 生物学杂志, 2011,28(6): 81—86.
[32]Lazar D, Susila P, Naus J. Early detection of plant stress from changes in distributions of chlorophyll a fluorescence parameters measured with fluorescence imaging[J]. Journal of Fluorescence, 2006,16(2): 173—176.
Photosynthetic and Fluorescence Characteristics Responses of Zizania latifolia and Phragmites australis Leaves to Soil Continuous Drought
ZHAO Xiang-jiang1, TIAN Kun2,3, YANG Lan1, LIU Hao4
(1.College of Environmental Science and Engineering, Southwest Forestry University, Kunming 650224, Yunnan China;2.National Plateau Wetlands Research Center, Kunming 650224, Yunnan China; 3.Chongqing University, Chongqing 400044,China; 4. College of Forestry, Southwest Forestry University, Kunming 650224, Yunnan China)
In the process of soil natural continuous drought, the photosynthetic characteristics,chlorophyll fluorescence parameters and corresponding soil moisture content of Zizania latifolia and Phragmites australis leaves were investigated to explore the photosynthetic physiological response of Z. latifolia and P. australis leaves to soil continuous drought stress. Pn, Tr, Gs of Z. latifolia leaves were first increasing and then decreasing, and those of P. australis leaves were gradually decreasing. Ci, Fv/Fm, NPQ, WUE, Yield, ETR and qP of Z. latifolia and P. australis leaves were the same change trend, Ci was gradually increasing, Fv/Fm, NPQ and WUE were first increasing and then decreasing, Yield, ETR and qP were gradually decreasing, with the soil moisture content gradually decreasing. It was showed that non-stomatal limitation was responsible for Pn reduction of Z. latifolia and P. australis leaves, confronting with severe drought stress. Drought stress threshold of Z. latifolia was between (2.17 ± 0.18)% and (1.66 ± 0.23)% of soil water content, that of P. australis was between (1.84 ± 0.17)% and (0.25 ± 0.07)% of soil water content, with 19% field capacity of growthsubstrate, available nitrogen, phosphorus and potassium of 28.14, 2.25 and 25.76 mg·kg-1respectively,and pH 7.2.
soil continuous drought; Zizania latifolia; Phragmites australi; photosynthetic characteristics parameters; chlorophyll fluorescence parameters
10.3969/j.issn.1009-7791.2015.03.001
Q945.11
A
1009-7791(2015)03-0181-07
2015-04-27
国家自然科学基金项目(40971285,31370497);云南省科技创新人才计划项目(2012HC007);云南省生态学优势特色重点学科(群)建设项目
赵湘江,硕士研究生,从事湿地生态学研究。E-mail: 852240037@qq.com
注:田昆为通讯作者。E-mail: tlkunp@126.com
