封闭负压引流技术对海水浸泡爆炸伤创面TNF-α表达和细菌指数的影响
2015-09-28马永奇梁献平石冰张晨
马永奇,梁献平,石冰,张晨
(1.解放军第三0九医院整形外科北京100091;2.北京伊美尔医疗美容医院北京100026;3.大连大学附属新华医院整形外科辽宁大连116021)
封闭负压引流技术对海水浸泡爆炸伤创面TNF-α表达和细菌指数的影响
马永奇1,梁献平2,石冰1,张晨3
(1.解放军第三0九医院整形外科北京100091;2.北京伊美尔医疗美容医院北京100026;3.大连大学附属新华医院整形外科辽宁大连116021)
目的:通过动态对比观察封闭负压引流技术(vacuum sealing drainage,VSD)对猪皮肤软组织海水浸泡爆炸创伤面TNF-α表达和细菌指数的影响,寻找最适治疗压力范围。方法:以5头小型猪为实验动物,于每头猪的双侧臀部和肩胛部制造4个损伤程度相当的海水浸泡爆炸创面,清创后随机分为对照组和实验组(VSD-120mmHg负压组、VSD-180mmHg负压组、VSD-240mmHg负压组),每组5个创面。对照组每天常规换药,实验组隔1天换1次VSD敷料,共治疗9d,并动态观察至所有创面愈合(即第58d),分别于治疗前、治疗后1d、3d、5d、7d、9d,取各组创面肉芽组织检测TNF-α水平和细菌指数。结果:①治疗后的前3d,实验组与对照组间细菌指数差异不明显,3d后,实验组与对照组相比细菌指数明显降低(P<0.01),但相邻不同压力组间差异不明显(P>0.05);②实验组各组创面经治疗后细菌均由海水细菌向猪皮肤寄生菌过渡、由G-菌向G+菌过渡,而对照组细菌变化较实验组相对缓慢;③各组创面在治疗过程中肉芽组织的TNF-α水平均表现为先升高后逐渐下降。与对照组相比,实验组上升、下降速度较快,峰值出现早且高,于第5天到峰值,之后快速下降(P<0.01),以VSD-120mmHg组变化最快,其次是VSD-180mmHg组,但相邻压力组间差异不显著(P>0.05)。结论:在治疗海水浸泡爆炸创面时,VSD技术可通过减少创面细菌指数、改变细菌构成、调节TNF-α表达等减轻创面炎症,促进创面愈合。
封闭负压引流;肿瘤坏死因子-α;海水浸泡;爆炸伤;细菌指数
对皮肤软组织缺损较大、创缘不整、污染严重或伴有感染的创面,不能立即手术关闭,早期换药显得尤为重要。VSD技术作为一种特殊的创面处理方式,在治疗各类复杂创面时,较常规疗法具有明显的优势,该技术被成功应用于爆炸创面[1-4],且疗效显著,但其在海水浸泡爆炸创面的应用尚未见报道。本实验模拟海战中爆炸所致的皮肤软组织缺损合并海水浸泡,建立猪皮肤软组织海水浸泡爆炸伤模型,探讨VSD技术和常规疗法对此类创面肉芽中TNF-α和细菌的影响,并观察各组间是否存在差异。
1 材料和方法
1.1材料
冬季渤海海水平均指标直接计数法细菌丰度9.02×108cell/L、生物变化量范围18.04mg/m3(以C计)、分离培养法计数细菌丰度6.56×105CFU/L、水温-1℃(实验时放置室温使水温升至10℃)、盐度31.0,表层海水密度26.0、PH8.0,水体中细菌主要类群为:γ-变形菌(36.5%)、厚壁菌门(12.3%)、蓝菌门(12%)等[5-7]。碱性蛋白胨水(杭州天和微生物试剂有限公司);营养肉汤(本院实验室);VITEK2 Compact全自动微生物分析仪、血琼脂平板、麦康凯平板、SS平板、中国蓝平板、TCBS琼脂平板、GN和GP鉴定卡(法国Bio-Merieux公司);快速革兰氏染色液(珠海贝索生物技术有限公司);Porcine TNF-αElisa kit(美国Abcam)。
1.2方法与分组
选取5头4~6个月龄实验小型猪(中国1号),雌雄不限,体重23~25kg,平均体重24kg,实验前适应性驯养1周,术前禁食水12h,肌注氯胺酮(0.05mg/kg)和盐酸赛拉嗪注射液(0.2ml/kg)复合麻醉,麻醉前15min给予阿托品减少呼吸道分泌物。麻醉后洗净皮肤,于双侧肩胛部、臀部肌肉发达处备皮,用雷管(660929F48841-56)在猪的肩胛部和臀部依次制造4个损伤程度相当的海水浸泡爆炸伤创面[8],清创后随机分为对照组和实验组(VSD-120mmHg负压组、VSD-180mmHg负压组、VSD-240mmHg负压组),每组5个创面,对照组每天常规换药,实验组创面清创后根据创面大小和形状修剪VSD敷料,应用半透性贴膜封闭创面,引流管链接负压吸引器,根据实验要求设置负压值,VSD组隔1天换1次敷料,所有创面均治疗9d,并动态观察至所有创面愈合(即第58d),于治疗前、治疗后1d、3d、5d、7d、9d对各组创面肉芽组织进行细菌指数和TNF-α浓度水平检测,并对比观察。每次取材均在常规消毒前,取材后各创面用碘伏常规消毒,尽量去除创面中的坏死组织,直至创面有新鲜的渗血,再用碘伏、生理盐水冲洗创面。
1.3创面肉芽组织TNF-α酶联免疫检测
应用双抗体夹心法测定其水平。于治疗前、治疗后1d、3d、5d、7d、9d分别在创面不同位置取0.5cm×0.5cm×0.3cm大小肉芽组织,电子天平称重约100mg,4℃预冷的PBS液(pH=7.4)冲洗组织2遍后立即放入液氮中速冻,解冻时先在冰上冰浴30min,融化后标本保持在2~8℃的环境中,加入适量的4℃预冷的PBS液(pH=7.4),利用手工匀浆器将标本充分匀浆,离心20min(3 000转/min),取上清液,用猪TNF-α酶联免疫试剂盒检测上清液中TNF-α水平。1.4海水基础细菌培养
取水样3ml加入1ml增菌培养基,37.0℃恒温箱中孵育24h,取表面培养物接种于分离培养基中,再放入37.0℃恒温箱中孵育24h,观察菌落特征,将优势菌落接种至分离平板,行VITEK2 Compact全自动微生物分析仪鉴定。
1.5创面细菌指数与革兰氏染色
实验组和对照组于治疗前、治疗后1d、3d、5d、7d、9d分别在创面表面不同点切去约0.5cm× 0.5cm×0.3cm的组织,电子天平称重后剪碎,加入99倍的生理盐水,用匀浆器匀浆,匀浆液按10倍比例稀释(10×、100×、1 000×……),取100µl稀释液分别接种到90mm的血琼脂平板上,放入37℃孵育箱24h,计数血平板上的菌落数,并观察菌落特征,将菌落做革兰氏染色。每克组织内的细菌数=1g/组织克数×菌落数×稀释倍数,再换算成对数指数。
1.6创面细菌分离培养与鉴定
实验组和对照组于治疗前、治疗后1d、3d、5d、7d、9d用无菌咽拭子在创面表面取2次分泌物,分置于碱性蛋白胨水和营养肉汤中,37℃恒温箱中增菌24h。取碱性蛋白胨水表面培养物接种于TCBS琼脂平板上;取营养肉汤表面分泌物接种于分离平板上,37℃增菌24h,观察菌落特征,并分别接种到分离平板上,行VITEK2 Compact全自动微生物分析仪鉴定。
1.7统计方法
数据统计采用SPSS 11.5统计软件进行分析,测定结果均以(x±s)表示,采取多因变量方差分析方法,若P<0.05为差异显著,若P<0.01为差异非常显著,有统计学意义。


图1 各组治疗前后对比
2 结果
2.1创面观察
治疗前,各组创面基底苍白,创周可见红晕,红晕内皮肤肿胀苍白,坏死范围界线不清,坚韧无弹性。治疗后,实验组创面较清洁,表面渗出较少,颜色较红润,肉芽增生较活跃,创缘收缩较明显,上皮爬行较快,以VSD-120mmHg组创面愈合最快,愈合时间最短;而对照组创面较污浊,表面渗出较多,颜色晦暗,肉芽增生、创缘收缩、上皮爬行均不明显,早期创面有扩大加深趋势,少数创面出现化脓,创面愈合较差,愈合时间最长(图1)。
2.2各组创面肉芽组织中不同时间TNF-α水平变化
治疗后期间,各组创面肉芽组织中TNF-α水平变化呈单峰状。与对照组相比,实验组TNF-α水平上升、下降速度较快,峰值不仅出现早而且较高,于治疗第5d达到峰值,以VSD-120mmHg组TNF-α水平变化最快,其次是VSD-180mmHg组;而对照组峰值出现晚且低,于治疗第7d达峰值,之后缓慢下降。经多因变量方差分析:治疗5d后,实验组与对照组间有明显统计学意义(P<0.01),VSD-120mmHg组与VSD-240mmHg组间有统计学意义(P<0.05),但相邻不同压力组间无统计学意义(P>0.05),见表1、图2。

图2 各组创面不同时间TNF-α水平动态变化
2.3海水基础细菌分离培养
海水基础细菌分离培养结果如下:普通变形杆菌、大肠埃希菌、荧光假单胞菌、产酸克雷伯菌、副溶血弧菌、布氏枸橼酸杆菌、粘质沙雷菌、海藻希瓦菌、美人鱼发光杆菌、杀鲑气单胞菌等,绝大部分属于γ-变形菌。
2.4各组创面细菌指数动态变化
治疗后,实验组创面细菌指数均呈快速减小趋势,以VSD-120mmHg组创面细菌指数减小最快,在治疗第5天细菌指数已小于5,其次是VSD-180mmHg组;而对照组创面在治疗前3d细菌指数呈上升趋势,细菌指数由7.4升至8.9,3d后才开始缓慢减小,至第9d时创面细菌指数仍高达6.4。经多因变量方差分析:治疗3d后,实验组与对照组间有统计学意义(P<0.01),VSD-120mmHg组与VSD-240mmHg组间有统计学意义(P<0.05),相邻压力组间无统计学意义(P>0.05),见表2、图3。
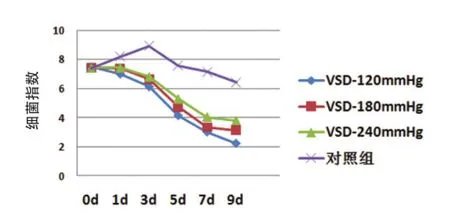
图3 各组不同时间细菌指数折线图
表1 各组创面不同时间TNF-α水平动态变化(ng/L,±s)

表1 各组创面不同时间TNF-α水平动态变化(ng/L,±s)
注:治疗5d后,实验组与对照组间有统计学意义(P<0.01),实验组间比较:VSD-120mmHg组与VSD-240mmHg组间有统计学意义(P=0.032),相邻压力组间无统计学意义(即VSD-120mmHg组与VSD-180mmHg组间比较,P=0.131;VSD-180mmHg组与VSD-240mmHg组间比较,P=0.461)
组别VSD-120mmHg组VSD-180mmHg组VSD-240mmHg组对照组0d 192.76±5.46 201.19±3.70 200.92±3.77 201.76±3.21 1d 235.86±6.48 221.49±3.19 218.25±3.77 208.92±3.13 3d 257.47±12.6 241.69±3.10 230.05±3.26 215.51±2.89 5d*344.15±2.14 323.63±7.25 305.39±8.90 250.58±2.72 7d 263.36±5.91 273.40±2.30 280.45±7.08 290.24±4.54 9d 245.05±9.66 250.43±9.21 269.94±8.54 286.82±3.45
表2 各组创面不同时间细菌指数动态变化(±s)
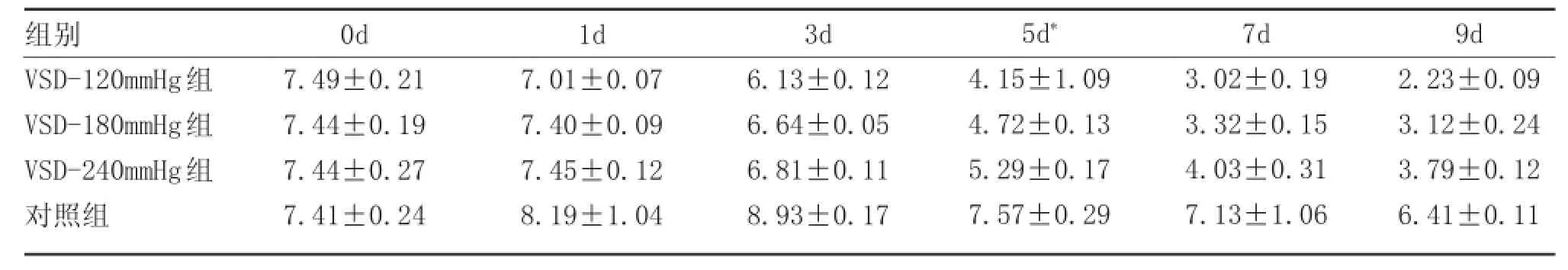
表2 各组创面不同时间细菌指数动态变化(±s)
注:治疗前3天,实验组与对照组间细菌指数差异不明显;治疗3d后,实验组与对照组间有统计学意义(P<0.01),VSD-120mmHg组与VSD-240mmHg组间有统计学意义(P=0.047),但相邻压力组间无统计学意义(P>0.05)
组别VSD-120mmHg组VSD-180mmHg组VSD-240mmHg组对照组0d 7.49±0.21 7.44±0.19 7.44±0.27 7.41±0.24 1d 7.01±0.07 7.40±0.09 7.45±0.12 8.19±1.04 3d 6.13±0.12 6.64±0.05 6.81±0.11 8.93±0.17 5d*4.15±1.09 4.72±0.13 5.29±0.17 7.57±0.29 7d 3.02±0.19 3.32±0.15 4.03±0.31 7.13±1.06 9d 2.23±0.09 3.12±0.24 3.79±0.12 6.41±0.11
2.5各组创面细菌分离培养与鉴定
治疗前各创面细菌培养均以普通变形杆菌为主,经过1~2d的潜伏期,创面细菌出现多样性,以海水基础菌为主,按照创面菌落形成单位多寡依次为普通变形杆菌、大肠埃希菌、荧光假单胞菌、产酸克雷伯菌、副溶血弧菌、布氏枸橼酸杆菌等,并出现猪皮肤寄生菌(猪葡萄球菌、缓慢葡萄球菌)逐渐增多趋势,3d后实验组创面海水基础菌种类明显减少,猪皮肤寄生菌明显增多,于5d后实验组创面细菌培养均为猪皮肤寄生菌,而对照组创面细菌变化趋势与实验组大体一致,但变化趋势较对照组相对缓慢,于治疗7d创面细菌培养以猪皮肤寄生菌为主。
2.6各组创面细菌革兰氏染色
治疗前各创面均以G-菌为主,治疗后各组创面细菌革兰氏染色出现相似的变化趋势:即由G-菌向G+菌过渡,但对照组较实验组变化相对缓慢。实验组于治疗第5天创面细菌革兰氏染色以G+为主,而对照组于治疗第7天创面细菌以G+为主。
3 讨论
创伤修复过程本身是一个有序的局部组织炎症反应[9],炎症反应在创伤修复中起重要作用,是机体最基本的防御性反应,包括无菌性炎症和感染性炎症,但过度的炎症反应或炎症持续存在可加重组织损伤,使创面愈合延迟或不愈合。TNF-α是炎症反应出现最早、最重要的细胞因子,不仅可反应创面无菌性炎症,也可反应创面感染性炎症,而创面细菌指数及细菌构成是反应创面感染性炎症的重要指标,本课题就VSD技术对海水浸泡爆炸创面愈合中TNF-α水平、细菌学等方面的影响进行了研究。
早期的炎症反应是创伤修复过程中的关键一步,局部炎性细胞因子的表达对创面肉芽组织形成及创缘表皮化具有重要的作用,TNF-α是炎症反应出现最早、最重要的炎性细胞因子[9],其在调节创面愈合中具有水平依赖性,在一定水平内创面肉芽中TNF-α可直接或间接地促进创面成纤维细胞增殖、创缘上皮化、血管化和增强创面抵抗力,而持续高水平的TNF-α可抑制成纤维细胞的功能和胶原合成,影响创面愈合[9-16]。Jin-qing Li等人[2]报道VSD技术可有效调节爆炸创面中TNF-α含量,使TNF-α高峰提前并迅速下降,缩短炎症反应时间,促进创面愈合。从本次实验结果示:治疗前各组创面肉芽中的TNF-α水平均较低,治疗后实验组创面肉芽中的TNF-α水平快速升高,于第5天达高峰且峰值较高,并迅速下降,以VSD-120mmHg组变化最快;而对照组TNF-α水平上升缓慢,于第7天达高峰且峰值较低,并下降缓慢。经统计处理:治疗1d后,实验组与对照组间差异非常显著(P<0.01),但相邻不同压力组间比较无统计学意义,一方面考虑与压力跨度(60mmHg)过小有关,另一方考虑与本次实验对象偏少有关。普通创伤炎症高峰一般出现在第2~3天,而本次海水浸泡爆炸伤炎症高峰出现在第5~7天,由此可见:①海水浸泡爆炸伤加重创面炎症反应,使炎症反应时间延长;②VSD技术可有效减轻创面炎症反应,缩短创面炎症反应时间,促进创面愈合。
创面细菌是反映创面炎症的另一重要指标,主要反映细菌性炎症,近年来VSD技术被应用到各类感染创面中且疗效显著。VSD技术不仅可抑制创面细菌增殖,延迟创面感染时间,而且可有效减少创面细菌容量,改变细菌构成,进而促进创面愈合[1-4]。本次实验结果示:①治疗前各组创面细菌指数均在7.4左右,各组间无统计学意义;治疗3d后实验组与对照组间出现明显差异,实验组在治疗期间细菌指数均呈快速下降趋势,治疗5d后小于5,而对照组在治疗的前3d细菌指数呈上升趋势,3d后才开始缓慢下降,至第9天细菌平均指数仍高达6.4;②在创面细菌构成和革兰氏染色上各组变化趋势一致,即由G-菌向G+菌过渡、由海水基础菌向猪皮肤寄生菌过渡,但对照组较实验组变化相对缓慢。
综合分析TNF-α表达水平和细菌指数:7d前TNF-α折线图中各组曲线排列与细菌指数相应曲线排列正好相反,7d后两组曲线排列趋势转为一致。由此可能说明:①在早期炎症渗出阶段,VSD技术可提高创面肉芽中TNF-α水平,TNF-α的抗感染功能,减少创面细菌容量,抑制细菌增殖;②创面肉芽中TNF-α在创伤后急性炎性渗出阶段在一定范围内其抗感染功能随浓度升高而功能加强,若持续升高,其抗感染功能明显下降;③两折线图在治疗前7d,曲线排列趋势相反,可能说明海水的所致创面局部的理化损伤程度较生物因素所致的创面损伤程度严重,7d后各组创面炎症反应逐渐减轻,主要反映细菌所致的感染性炎症,炎症反应轻重主要与创面细菌容量和细菌构成有关;④VSD技术可有效改变猪皮肤软组织海水浸泡爆炸创面细菌构成,使创面细菌由G-菌向G+菌过渡、由海水基础菌向猪皮肤寄生菌过渡;⑤爆炸伤经海水浸泡,创面炎症反应加重,感染时限提前,但海水细菌大部分具有喜冷、耐碱、耐盐、耐压、厌氧或兼性厌氧等特点,且各组创面细菌构成变化趋势基本一致,海水细菌致创面感染,细菌是否可因局部温度、PH、含氧量高等特点而不利于细菌繁殖呢,需要在以后的课题中进一步验证;⑥在应用VSD技术治疗海水浸泡皮肤软组织爆炸伤时,-120mmHg的压力可能是比较理想的压力。
本实验未设置更多的压力作为对照,主要原因是:①实验动物为小型乳猪,体表皮肤有限,创面损伤大等,致动物不能耐受更多创面;②结合国内外文献报道VSD在治疗其它类型皮肤软组织损伤时,多设置-120mmHg或-180mmHg的压力,且疗效显著。
总之,VSD技术可调节创面TNF-α水平、减少细菌指数、减轻创面炎症,促进创面愈合,在本次实验设计中,VSD-120mmHg组创面愈合最好,对照组创面愈合较差,由此得出在治疗皮肤软组织海水浸泡爆炸伤时,VSD-120mmHg可能是比较理想的压力。
[1]薛云,刘兴炎,葛宝丰,等.封闭负压引流对软组织爆炸创面的影响[J].中国矫形外科杂志,2011,19(6):495-498.
[2]Li JQ,Topaz M,Tan H,et al.Treatment of Infected Soft Tissue Blast Injury in Swine by Regulated Negative Pressure Wound Therapy[J].Ann Surg,2013,257(2):335-344.
[3]Wang S,Liu XY,Ge BF,et al.Repair of explosive wound in pigthighsofttissue:Vacuumassistedclosureversus conventional[J].J Clin Rehabilitat Tissue Engineer Res,2010,14(50):9337-9340.
[4]熊发明,刘兴炎,李荣刚,等.封闭负压引流对早期处理爆炸创面的细菌和微循环的影响[J].中国矫形外科杂志,2010,18(2):147-149.
[5]孙松,李超伦,宁修仁,等.中国区域海洋学—生物海洋学[M].北京:海洋出版社,2012:12-15.
[6]乔方利,甘子钧,王东晓,等.中国区域海洋学—物理海洋学[M].北京:海洋出版社,2012:61-75.
[7]洪华生,王江涛,王宝栋,等.中国区域海洋学—化学海洋学[M].北京:海洋出版社,2012,30-45.
[8]梁献平,石冰,马永奇,等.猪皮肤软组织海水浸泡爆炸伤创面动物模型的建立[J].中国美容整形外科杂志,2014,25(8):510-512.
[9]Sommer K1,Sander AL,Albig M,et al.Delayed Wound Repair in Sepsis Is Associated with Reduced Local Pro-Inflammatory Cyto,kine Expression[J].PLoS One,2013,8(9):e73992.
[10]Frank J,Born K,Barker J,et al.In Vivo Effect of Tumor NecrosisFactor Alphaon Wound Angiogenesisand Epithelialization[J].Eur J Trauma,2003,29:208-219.
[11]Kanno E,Kawakami K,Ritsu M,et al.Wound healing in skinpromotedbyinoculationwithPseudomonas aeruginosa PAO1:The critical role of tumor necrosis factoralphasecretedfrominfiltratingneutrophils[J].Wound Repair Regen,2011,19:608-621.
[12]Weinstein DA,Kirsner RS.Refractory ulcers:the role of tumor necrosis factor-alpha[J].J Am Acad Dermatol,2010,63:146-154.
[13]Gill SE,Parks WC.Metalloproteinases and their inhibitors:regulators of wound healing[J].Int J Biochem Cell Biol,2008,40:1334-1347.
[14]D'AmiciS,CeccarelliS,VescarelliE,etal.TNF-α Modulates Fibroblast Growth Factor Receptor 2 Gene Expression through the pRB/E2F1 Pathway:Identification of a Non-Canonical E2F Binding Motif[J].PLoS One,2013,16;8(4):e61491.
[15]YuHM,WuX,FangHY,etal.EGCGattenuatesthe inhibitory effect of high TNF-α level on the process of wound healing in dermal fibroblasts[J].Chin J Pathophysiol,2012,28(1):155-158.
[16]Fan YY,Ye GH,Lin KZ,et al.Activation of a7nAChR promotes wound healing in diabetic mice by suppressing TNF-α expression[J].Chin J Pathophysiol,2013,29(6):1053-1055.
Effect of Vacuum sealing drainage on tumor necrosis factor alpha expression and bacteriological index in swine seawater-immersed blast-injury wounds
MA Yong-qi1,LIANG Xian-ping2,SHI Bing1,ZHANG Chen3
(1.Department of Plastics,No 309thHospital of PLA,Beijing 100091,China;2.Evercare Beijing Medical& Beauty Hospitals,Beijing 100026,China;3.Department of Plastic Surgery,Xinhua Hospital Affiliated to Dalian University,Dalian 116021,Liaoning,China)
Objective To dynamically observe the effect of tumor necrosis factor alpha and bacteriological index at different negative pressures of Vacuum sealing drainage(VSD)on seawaterimmersed blast-injury wounds so as to grope the optimal therapeutic negative pressure range. MethodsThe seawater-immersed blast-injury wounds were established on 5 experimental miniature swine at two sides of shoulders and hips.Each swine has 4 wounds and divided into 4 groups randomly:control group,VSD-120mmHg group,VSD-180mmHg group and VSD-240 mmHg group.All the wounds were removal of necrotic tissue and foreign bodies before treatment.The experimental groups were treated with VSD,and the control group was treated by regular method.The treatment on each wound continued for 9 days,and the observation continued until the 58thday.Tumor necrosis factor alpha expression and bacteriological index of wounds granulation tissue wererespectively observed at 0,1,3,5,7,9 day and comparison were made among them.Results①The bacteriological index of the experimental groups were decreased after treatment,but the control group's was increased in the first 3 days of treatment.The bacteriological index of the experimental groups was significantly lower than that of the control group after 3 days'treatment(P<0.01).②The bacterial composition took an obvious tendency of transition from seawater bacterium to skin fungus and from G-bacterium to G+bacterium.Compared with the experimental groups,the control group was slower in the rate of transition.③In all groups,the TNF-α expression on wounds granulation tissue increased after trauma.Compared with the control group,the rate of increase and decrease were faster,and the summit peek value came earlier and higher significantly(P<0.01).The comparison among the adjacent pressure groups showed no statistical significance(P>0.05).Conclusions Compared with conventional therapy,VSD shows clear benefits during the treatment of seawater-immersed blastinjury wounds.The wounds inflammation was reduced by decreasing bacteriological index,changing bacterial composition,adjusting TNF-α expression and so on in experimental groups,and-120mmHg pressure may be relatively ideal pressure.
Vacuum sealing drainage(VSD);Tumor necrosis factor alpha(TNF-α);seawater immersion;blast-injury;bacterial index
R622
A
1008-6455(2015)24-0030-06
2015-10-18
2015-12-15
编辑/张惠娟
石冰,男,解放军第三O九医院整形外科,邮编:100091
马永奇,男,河北邯郸人,大连大学硕士研究生
