浅谈BFS生产工艺的选择与设计
2015-09-27张洪飞
张洪飞
浅谈BFS生产工艺的选择与设计
张洪飞
(湖南千山制药机械股份有限公司,湖南长沙410100)
以BFS工艺的相关法规要求入手,从非最终灭菌产品与最终灭菌产品2个方面阐述了BFS生产线的工艺布局设计,并简议了用BFS技术生产的工艺选择。
BFS;选择;设计;非最终灭菌产品;最终灭菌产品
0 引言
吹瓶(Blow)、灌装(Fill)、封口(Seal)三合一无菌灌装工艺,简称BFS工艺或三合一无菌灌装工艺。在新版GMP附录1无菌药品中将其定义为“吹灌封技术”(以下简称BFS技术)。
BFS技术实质是一种无菌灌装技术,在这一工艺过程中,塑料粒子通过高温高压的挤出过程达到无菌状态,然后容器的制作、产品的灌装、容器的封口这3种工艺过程均在机载风淋室保护下的无菌工位完成。其基本不受外界因素的干扰,具有非常可靠的无菌保障能力。
BFS无菌灌装技术,以其50多年的应用历史充分证明了它的安全性和可靠性。吹灌封技术是目前国际上公认的无菌保障能力强、生产效率高、生产成本低、节能环保的无菌灌装技术。全球大约有2 000条BFS生产线应用于制药、化妆品、食品包装、医疗器械、特殊无菌产品包装等领域的无菌产品的生产。由于BFS技术使用塑料包材,具有多种多样的包装形式,产品适合多种用途,并具有无菌生产、无菌使用等特殊功能,因此目前BFS无菌灌装工艺成为了无菌药品生产的首选工艺,在发达国家已有50%以上的大小容量注射剂是应用BFS技术生产的。同时,BFS技术也为新的无菌产品的开发提供了一个新的工艺路线和技术平台。新版GMP实施以来,BFS无菌灌装技术的应用在我国制药行业也已形成高潮。
1 BFS工艺的相关法规要求
《中华人民共和国药品管理法》第9条:药品生产企业必须按照国务院药品监督管理部门依据本法制定的《药品生产质量管理规范》组织生产。药品监督管理部门按照规定对药品生产企业是否符合《规范》的要求进行认证;对认证合格的企业单位,颁发认证证书。
新版GMP附录1:
第2章“原则”第4条:无菌药品按生产工艺可分为2类:采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
第5章“吹灌封技术”第17条:用于生产非最终灭菌产品的吹灌封设备自身应装有A级空气风淋装置,人员着装应当符合A/B级洁净区的式样,该设备至少应当安装在C级洁净区环境中。在静态条件下,此环境的悬浮粒子和微生物均应当达到标准;在动态条件下,此环境的微生物应当达到标准。
用于生产最终灭菌产品的吹灌封设备至少应当安装在D级洁净区环境中。
最终灭菌工艺是指将完成最终密封的产品进行适当灭菌的工艺,无菌生产工艺是指在无菌环境条件下,通过无菌操作来生产无菌药品的方法。按照规范应用BFS无菌灌装技术,可以生产非最终灭菌和最终灭菌2种无菌产品;BFS生产线的工艺布局也可根据生产工艺要求按最终灭菌和非最终灭菌2种方案设计,但工艺布局必须符合新版GMP的要求。国产BFS设备在设计时充分考虑了设备对工艺的兼容性,完全可以适应最终灭菌和非最终灭菌2种工艺需要。在设备选购时用户应根据生产工艺、产品特性等提出相应的URS,保证设备符合工艺要求。
2 BFS生产线的工艺布局设计
新版GMP附录1第5章“吹灌封技术”第18条:因吹灌封技术的特殊性,应当特别注意设备的设计和确认、在线清洁和在线灭菌的验证及结果的重现性、设备所处的洁净区环境、操作人员的培训和着装以及设备关键区域内的操作,包括灌装开始前设备的无菌装配。
新版GMP同时明确指出,吹灌封是一项先进的无菌灌装技术,不是简单地BFS机器的应用。在无菌工艺中“细节决定成败,质量源于设计”,BFS技术的应用必须充分考虑工艺的特殊性,并以生产线和工艺布局的设计作为实施BFS技术的基础。
因各企业的具体情况不同,以及对BFS技术理解上的差异和生产工艺的不同,在BFS生产线设计和工艺布局上也出现了各具特色的多样性。从法规要求和国内外成功案例分析情况来看,BFS无菌灌装工艺的生产线和工艺布局不能完全照搬小容量“洗、灌、封”工艺和“大容量塑瓶”生产线的工艺模式,而是要符合BFS技术的相关法规,并将BFS设备的应用同提高生产工艺的技术含量、提高生产过程中的风险控制能力、提升产品质量、节能减排等因素统筹进行考虑,不应将先进的BFS技术变为简单的“换包材”。
2.1用BFS技术生产非最终灭菌产品的基本工艺路线
非最终灭菌产品的基本工艺路线:无菌称量—生产线CIP/SIP—产品无菌配制—BFS无菌灌装—贴标/印字—产品检漏包装。
2.1.1无菌称量
按新版GMP第52条要求:“制剂的原辅料称量通常应当在专门设计的称量室内进行”。传统的称量间通常采用送、回风+除尘罩的方式,原辅料称量时产生的粉尘,会通过气流的运动在对操作人员和物料造成污染和交叉污染的同时,对空调系统也造成无法消除的污染。
无菌称量通常是指在一定条件下的负压称量间(仓)(图1)内进行原辅料的称量。
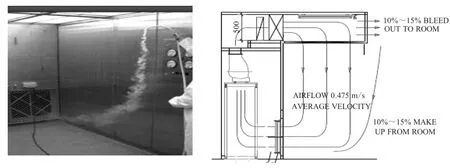
图1 负压称量间(仓)
称量间的A级层流单向流对人员和原辅料会起到保护作用。称量间自带的过滤系统,可以保证原辅料的称量过程不会对整个空调系统造成污染。称量间内外10%~15%的压差,可保证称量过程不会对相邻的房间和区域造成污染和交叉污染。此外,负压称量间还可以通过设备工艺的组合,实现原辅料称量到混合罐的密闭输送及消毒液过滤后的分装等保护性作业。
2.1.2无菌配料系统
在无菌工艺中,无菌保证措施通常是通过层流、密闭和正压来实现的。传统的配料系统由于设计和硬件上的缺陷,过分依赖操作人员的“技能”,很难保证配料过程不出差错、不受污染。
为BFS无菌灌装生产线配套的无菌配料系统(图2)一般由混合罐、无菌储罐、除菌过滤系统、在线称重和监测系统等组成。配料系统应具有良好的密封性、耐高温、耐高压、无残留、可实现CIP/SIP、全系统正压运行等功能。工艺过程可实现在线监控,并可以同无菌称量设施、BFS无菌灌装设备共同组成一个完整的无菌工艺生产线,实现BFS产品的非最终灭菌。实现产品精确配制的必需配置,该系统不但可以保证产品在配制过程中的计量精确,防止调整过程造成污染,还可以对整个生产过程中的物料进行在线监测,防止产品在配料过程中出现含量超标或不足,杜绝意外进料和跑料事故的发生,实现生产过程物料平衡的在线控制;系统中的过滤器SIP压差控制系统,不但可以保证过滤器的SIP效果,还可以防止过滤器在SIP过程中受损,延长过滤器的使用寿命,有效地预防无菌工艺过程中的风险;系统CIP/SIP后可正压保存较长时间,正压运行可以有效地预防污染事件的发生,也是同BFS设备“时间/压力”灌装法的完美匹配。

图2 BFS无菌灌装生产线配套的无菌配料系统
2.1.3“黑白分区”
BFS设备是具有无菌保障能力的灌装设备,按无菌工艺要求设备应该“黑白分区”安装。在“人员着装应当符合A/B级洁净区的式样”的前提下,灌装部分可以安装在不低于C级的洁净环境中。按新版GMP要求,灌装间实施无菌管理,设备上部应加装A级层流装置,层流装置应在室内取风,并同室内背景区、A级风淋室的压差联动;灌装区不应设清洗设施和地漏,工器具应在移出灌装区清洗后,无菌配料系统用洁净的压缩气体作动力,实现了CIP/SIP无死角、输液管线无残留、系统始终处于正压的保护下的要求;下置式磁力搅拌装置,不但适合高温高压的工作环境,还可以使配料系统不受“最小配制量”的限制,尤其是在培养基模拟灌装试验时更能显现出其优越的适应性;在线称重系统是经灭菌后回到灌装区。BFS机器的动力辅机、电器控制、上料部分安装在一般生产区,同灌装间密封隔离并保持20 Pa以上的压差,产品传输通道一端在A级层流区,另一端在产品后处理区(普通生产区)通道内有≥30 Pa压差的气流保护,产品由2支不跨区域的机械手传送到产品后处理区。产品在后处理区,用旋转式真空检漏机进行检漏(塑料容器任何部位都有泄漏的可能),然后进行产品的灯检、贴标/印字和外包装。
2.1.4特点
BFS生产线的工艺布局按无菌工艺设计,虽然在净化施工、设备配置、CIP/SIP、无菌工艺验证、人员培训等方面要求较高。然而,因BFS技术生产的产品不需最终灭菌,不但可以减少厂房建筑面积、简化净化区域、减少配套设备和生产操作人员,还可以大幅度地降低能耗、减少污染、降低生产成本,最大限度地发挥BFS无菌灌装技术的优势。同时,采用无菌工艺生产的非最终灭菌产品,不经高温高压处理,不会产生“新物质”,产品质量稳定,产品和塑料容器也会有较好的相容性。
2.2用BFS技术生产最终灭菌产品的工艺路线
最终灭菌产品的基本工艺路线:负压称量—产品配制/除菌过滤—BFS无菌灌装—产品灭菌—产品检漏—贴标/印字—包装。
2.2.1工艺适用性
相对非最终灭菌产品而言,在BFS生产线上采用灭菌工艺生产最终灭菌产品,在生产环境控制、设备配置、人员培训、工艺验证等方面的法规要求相对比较宽松。因BFS设备无菌保障能力强,人员不需按A/B级更衣,灌装部分最低可以安装在D级环境中,灌装区上方可以不加装A级层流保护(欧盟GMP要求加装A级层流保护),工艺过程可不进行培养基模拟灌装验证,灌装间的悬浮粒子和微生物限度控制要求也比较宽松。其主要适用于大容量注射剂和产品、包材均耐热的无菌产品的生产。
用BFS技术生产大容量注射剂,可获得较高的产品质量。由于PE/PP都有良好的水汽阻隔性,同非PVC软袋相比产品有很大的优越性:非PVC软袋由6~10个部件组成,为多层复合膜,原材料品种多于10种,生产的工位较多,产品不可避免地混入“不溶性微粒”,容器内空气容积较小,将加入的药品混合均匀比较困难。而用BFS技术生产的容器则由同一种原料在同一无菌工位制成,产品安全性较高,吹/灌/封连续完成,很少产生“不溶性微粒”,容器内合理的空气容积适合所有的混和程序,壁厚大于300μm,产品可获得较长的保质期。
2.2.2“黑白分区”
新版GMP第2章“原则”第2条:无菌药品的生产需满足其质量和预定用途的要求,应当最大限度降低微生物、各种微粒和热原的污染。生产人员的技能、所接受的培训及其工作态度是达到上述目标的关键因素,无菌药品的生产必须严格按照精心设计并经验证的方法及规程进行,产品的无菌或其他质量特性绝不能只依赖于任何形式的最终处理或成品检验(包括无菌检查)。
最终灭菌工艺在生产线和工艺布局上也要满足无菌药品生产工艺的需求,为了降低悬浮粒子和微生物的污染程度,BFS设备也应该“黑白分区”安装。根据生产工艺流程,BFS灌装机前段的设备配置基本同无菌工艺一样,在产品的后处理阶段需增加灭菌设备和相应的配套设备/工程。目前,国内BFS产品基本是采用115℃水浴灭菌(塑包材很难耐受121℃),较高的工艺温度会导致容器变形,使药品和塑包材的相容性出现问题。灭菌用水、柜内的灭菌温度及升温和降温过程中的压力平衡要制定安全可靠的工艺参数,进行合理有效地控制。
2.2.3特点
最终灭菌工艺生产过程能耗大、排污多,生产成本相对较高。也有观点认为,换包材要比变工艺相对简单,最终灭菌工艺要比无菌工艺易于控制,产品最终灭菌要比非最终灭菌安全。
3 用BFS生产的工艺选择
因BFS技术及产品的特殊性,在选择生产工艺时,一定要结合企业的实际情况和产品的特点来权衡利弊。
(1)最终灭菌工艺和非最终灭菌工艺所选用的包材原料不同,最终灭菌工艺要求药品和包材都要有较好的耐热性,包材大多首选耐热的PP材料,药品要耐受F0值>8的灭菌温度和时间。按欧盟《溶液剂型产品灭菌方法选择的决策树》和《灭菌/无菌工艺验证指导原则(第2稿)》的规范,耐热的产品不是无菌工艺即非最终灭菌产品的首选。有的塑料所以能耐受较高的灭菌温度是因为在树脂中添加了抗氧化剂,《化学药品注射剂与塑料包装材料相容性研究技术指导原则》(征求意见稿)和《EMEA直接接触塑料包装材料指导原则》中对各种添加剂种类和数量做出了严格的限制,明确规定“添加抗氧化剂不能超过3种,总量不得超过0.3%”,添加剂是药品和包材相容性试验的主要障碍。然而,不耐热的化学药品、生化药品、疫苗、不加防腐剂的滴眼液等则是BFS无菌灌装技术的首选产品。目前,国内外BFS工艺选用的包装材料大多是专为BFS工艺开发的,不添加任何添加剂,并在多国药典或监管部门备案的PE/PP。可以说,若产品不耐热,树脂中不含添加剂,又有多国备案的背景,其较易通过无菌工艺审核和相容性试验。药包材和生产工艺的变更也易通过监管部门的审批。因此,若实施BFS技术,企业要在经营范围中增加药包材生产的项目、制定企业标准的包材质量标准和相应的检测方法。
(2)虽然无菌工艺技术含量较高、工艺过程中的风险较多,但通过采用先进的BFS技术/装备和严谨规范的工艺验证,这些风险都是完全可控的。BFS生产线的智能化生产程序要比人工操作可靠得多。USP1116对BFS无菌灌装工艺的可靠性做出了这样的评价:“这些系统的存在已有大约30年的历史,并且显示出使污染率达到低于0.1%的能力,当综合分析组合培养基灌装数据时,Blow/Fill/Seal系统的污染率能够达到0.001%”。
4 结语
综上所述,在进行BFS生产线设计和工艺选择时,要将提高企业装备水平、生产技术进步、生产过程风险控制、产品质量提升、节能减排等因素进行统筹考虑,通过BFS技术的应用,为人类健康事业提供优质产品的同时,获取更大的企业效益和社会效益。
2014-12-12
张洪飞(1955—),男,吉林人,高级经济师,研究方向:制药机械。
