溶液燃烧−氢还原法制备超细铁粉的水分解反应动力学研究
2015-09-25罗德礼黄志勇徐清英熊仁金宋江锋
姚 勇,罗德礼,黄志勇,徐清英,熊仁金,张 志,宋江锋
(中国工程物理研究院 材料研究所,绵阳 621907)
氚是一种重要的战略资源,具有放射性。氚工艺实验室通常采用催化氧化−分子筛吸附的方法进行手套箱或房间气氛的除氚处理,分子筛再生过程中会产生不同活度的氚化水(tritiated water,HTO)[1]。氚化水的生物毒性是氚化氢(tritiated hydrogen,HT)的104倍以上[2],从环境安全和氚回收利用两方面考虑,都需要采取有效方法将氚化水转化为分子态的氚。热金属法利用金属或合金与HTO发生氧化还原反应,在生成金属氧化物的同时得到HT[3]。该方法不需要引入复杂的机械体系,并具有体积小、初始投入成本低和安全可靠等优点[4],目前在国外氚处理实验室,如LANL、SRS、TLK等氚化水回收处理中都有应用[5]。
热金属法通常采用锆合金[6]、铀[7]等作为反应器填料,由于它们与水反应不可逆,产生固体废物,后续处理较复杂。铁是一种可逆的水分解材料,其氧化–还原反应方程式如下:

在氧化阶段,氚化水转化为分子态氚,当铁粉完全氧化后,可以用氢还原重新得到金属铁;因而填充材料可以重复使用,不会产生固体含氚废物[8],这对于人员及环境安全具有重要意义。
为了使铁粉能在氚化水分解中获得实际应用,需要尽可能提高其与水蒸汽反应的动力学性能。相关研究主要包括以下3方面:1)降低粉体粒度,如采用共沉淀法、水热合成法、柠檬酸盐法等[9−10]制得氧化铁,再由氢气还原获得纳米级铁粉,由于其比表面积大,因而具有较好的水分解动力学性能。2)提升铁粉的循环性能(重复氧化还原性能),向纳米铁中掺杂Mo、Cr、Zr等组分,其对应的氧化物可阻止铁粉颗粒的烧结失活[11]。其中ZrO2是一种广泛应用的催化剂载体材料,由于比表面积大,高温化学稳定性好而备受关注。如URASAKI等[12]向铁粉中添加0.23%(摩尔分数)的Zr元素,在一定程度上抑制铁粉烧结;RYU等[13]向铁粉中添加3%(摩尔分数)的Zr元素,可以抑制大部分颗粒的烧结长大。3)提升催化反应性能,主要方式是添加贵金属元素,如Ru、Rh、Pd、Ir等。OTSUKA等[14]通过添加3%的多种元素对比实验表明, Rh对Fe粉的水分解动力学性能提升最显著。目前关于Zr、Rh掺杂铁体系的研究较少,需要开展进一步实验以确定最佳的添加量。
溶液燃烧合成法(solution combustion method,SCS)是一种新兴的湿化学合成方法。该方法以硝酸盐(氧化剂)与柠檬酸、甘氨酸等有机溶剂(还原剂)为原料,反应过程在溶液中进行,能够保证化学计量比的精确性和产物成分的均匀性,所得粉体晶粒尺寸多为300 nm以下[15];相对于共沉淀、水热合成等方法,SCS工艺简单、快捷,不需要特殊设备。本文作者采用溶液燃烧−氢还原法制备超细铁粉,并掺杂不同比例的锆、铑元素,考察铁粉的水分解反应动力学性能,以获得一种适用于氚化水分解的铁基材料。
1 实验
1.1 实验原料
硝酸铁 Fe(NO3)3…9H2O、硝酸锆 Zr(NO3)4…5H2O、硝酸铑Rh(NO3)3…2H2O、甘氨酸NH2CH2COOH等所有试剂均为分析纯,购自成都格雷西亚化学试剂公司。为了进行对比实验,采购2种商业铁粉:还原铁粉试剂购自上海鸿翔实业公司,粒径约100 μm;羰基铁粉由成都核八五七新材料公司生产,粒径约为1 μm。
1.2 超细铁粉的合成与表征
首先根据推进剂化学中的热化学理论[16]确定硝酸盐与甘氨酸的用量,即由甘氨酸的总还原价与硝酸盐的总氧化价相等原则来计算。假定燃烧产物为N2、CO2和H2O,C、H的化合价分别为+4和+1,是还原剂;O为−2价,是氧化剂,N为0价的中性元素。
准确称量硝酸盐和甘氨酸,投入到坩埚内,滴加少量去离子水,搅拌均匀,得到透明溶液;将坩埚放入恒温400℃的箱式电阻炉中,溶液发生燃烧反应得到氧化物前驱体。将前驱体转入石英管,通入10%H2/Ar混合气体,在500℃下进行30 min还原处理,然后切换为高纯氩气吹扫,降温至常温后取出,得到超细铁粉,装入密封样品瓶备用。制备锆元素和铑元素掺杂改性的铁粉时,锆和铑的掺杂量用对应金属原子分数计量,制备过程与纯铁粉相同。
采用XPERT-PRO型转靶X射线衍射仪分析铁粉的物相,用JADE5对物相进行解析;在JEM-5900LV扫描电镜下观察粉末的形貌及粒度;采用F20场发射透射电镜观察与分析粉体的微观形貌及元素组成。
1.3 水分解动力学实验
铁粉的水分解动力学实验采用恒温热重法进行,ZCT-A型热重/差热分析仪的精度为1 μg。首先将质量约20 mg的铁粉平铺于热重仪的浅底铂金坩埚平面上,在高纯Ar气保护下升温至设定温度,恒温10 min;然后切换为1%H2O/Ar混合气体,气体进入热重仪舱室后,铁粉与水蒸汽发生反应,质量增加。以Fe粉初始质量和完全转化为Fe3O4的质量计算额定转化率,再根据不同时刻样品质量可得出转化率X随时间t的变化关系(X-t)曲线。正式实验前采用薄层样品平铺及加大气速的方法消除外扩散影响。
铁粉的循环性能测试采用原位连续氧化−还原的热重方法。氧化采用1%H2O/Ar混合气体,Fe氧化为Fe3O4;还原采用10%H2/Ar混合气体,温度固定为500℃,Fe3O4还原为Fe。氧化反应和还原反应交替进行,由重复氧化的X-t曲线评价Fe粉的循环稳定性。
2 结果与讨论
2.1 铁粉的水分解动力学
2.1.1 纯铁粉

图1几种纯铁粉的SEM形貌Fig.1 SEM images of iron powders
图1所示为本研究制备的纯铁粉与2种商用铁粉的SEM形貌,可见本研究采用溶液燃烧–氢还原法制备的铁粉为珊瑚状,颗粒直径约100 nm,长度为200~300 nm;羰基铁粉为杆状,直径约1 μm;还原铁粉试剂的粒径约100 μm,颗粒中包含10~50 μm不等的一次颗粒。图2所示为这3种铁粉的XRD谱,可见均为单相铁粉,但衍射峰强度略有差异,溶液燃烧−还原法制备的铁粉具有相对低的峰强度,表明该粉体具有纳米特性,与SEM分析的结果一致。

图2 几种纯铁粉的XRD谱Fig.2 XRD patterns of iron powders
图3所示为3种铁粉在723 K和773 K温度下的水分解动力学实验结果,可见采用溶液燃烧−氢还原法制备的纳米铁粉的水分解反应速率明显高于外购的2种微米级铁粉,溶液燃烧−氢还原铁粉在723 K温度下完全反应的时间约20 min,773 K温度下仅需约10 min;而2种微米级铁粉在相同反应时间内的反应率均不到10%。这可能是粉末粒径差异引起的:溶液燃烧−氢还原铁粉为100 nm左右的超细颗粒,一方面颗粒表面积更大,表面反应活性点位的数量更多;另一方面水分子向颗粒内部的扩散距离更短,内扩散速率更大,因此其反应速率大幅度提升[17]。由此可见在500℃及以下温度条件下,微米级的铁粉水分解效率太低,不具有实用性;采用溶液燃烧−氢还原法制备的超细纳米级铁粉才有用于氚化水分解的可能性。
在温度773 K条件下对溶液燃烧−氢还原铁粉进行连续5次重复氧化−还原反应,每次的水分解反应动力学曲线如图4(a)所示,反应5次后的粉体形貌如图4(b)所示。图4(a)表明,随重复氧化−还原的次数增加,铁粉的动力学性能不断下降;在10 min的反应时间内,第1次可完全反应,而第5次反应率已不足70%。由图4(b)可见,经过重复氧化–还原后铁粉颗粒明显长大,存在严重的烧结现象,失去了纳米材料的特征,这种现象与WANG等[18]的研究结果一致。
铁粉的循环性能下降可用Tammann温度来说明。Tammann温度指的是物质开始呈现显著扩散的温度,金属的Tammann温度约为其熔点的0.3倍[19],铁的Tammann温度为460℃,因此在重复氧化还原反应过程中铁微晶处于准液体状态,铁原子容易在颗粒间迁移并长大。因此为了提高溶液燃烧−氢还原铁粉的水分解动力学性能,必须进行改性处理。
2.1.2 锆掺杂改性铁粉
图5所示为锆元素掺杂量(原子分数)分别为5%、10%和15%的改性铁粉的XRD谱。从图5可看出,这3种铁粉均没有明显的ZrO2衍射峰,只是随锆含量增加,对应的峰位处出现较小的ZrO2峰包,这表明ZrO2未发生明显的结晶行为,可能是以微晶或非晶的形式存在。

图4 溶液燃烧−氢还原法合成铁粉的反应特性Fig.4 The character of iron powders synthesized by solvent combustion-hydrogen reduction

图5 不同锆掺杂量的铁粉XRD谱Fig.5 XRD patterns of the iron powders with different Zr addition amount
将纯铁粉和3种不同锆掺杂量的改性铁粉在723 K温度下进行水分解动力学实验,结果如图6(a)所示,其重复水分解动力学实验结果如图6(b)、(c)、(d)所示。
由图6(a)可知,纯铁粉与锆掺杂改性铁粉的动力学曲线趋势一致,添加5%和10%锆的铁粉与纯铁粉的反应速率基本相同;锆添加量为15%时粉末的反应速度略有下降,这可能是因为随锆含量升高,ZrO2在铁颗粒表面的覆盖度增大,降低了水蒸汽向颗粒表面的扩散速度,从而降低了反应速率。从图6(b)可见添加5%Zr的铁粉,第2、3次循环反应的速度较第1次显著下降,第4次比第3次无明显下降,表明该体系在反应初期仍存在一定程度烧结。图6(c)、(d)表明,添加10%Zr和15%Zr的铁粉循环性能较好,连续4次未见反应速率下降,表明这2种粉体具有优良的循环稳定性。图7所示为Zr含量分别为5%、10%、和15%的改性铁粉循环反应4次后的形貌,可看出铁粉颗粒尺度仍为纳米级,含5%Zr的铁粉中颗粒有局部烧结迹象,含10%Zr和15%Zr的铁粉没有明显烧结,颗粒形貌明显优于未改性的纯铁粉(见图4(b))。综合考虑循环稳定性和反应动力学性能,Zr的最佳添加量为10%。
2.1.3 锆/铑共掺杂改性铁粉
图8所示为Zr添加量为10%、Rh添加量分别为0.5%、1%、2%和4%的锆/铑共掺杂改性铁粉在723 K温度下的水分解反应动力学曲线。可见添加铑后铁粉的水分解动力学性能显著提升,10%Zr-Fe粉末完全反应约需20 min,而10%Zr-0.5%Rh-Fe的完全反应时间仅为10 min,10%Zr-1%Rh-Fe完全反应时间为8 min,进一步增加铑含量对铁粉的动力学性能改善不明显。这表明在10%Zr-Fe粉中添加1%Rh足以获得优异的动力学性能,Rh的添加量低于现有文献[13−14]的数据(3%),这有利于降低材料的制备成本。

图6 不同锆掺杂量的铁粉水分解动力学曲线Fig.6 Water decomposition kinetics curves of iron powders with different Zr addition amount

图7 锆改性铁粉循环反应4次后的形貌Fig.7 SEM images of iron powders with different Zr addition amount after fourth redox
图9所示为10%Zr-1%Rh-Fe粉末在温度773 K温度下进行连续20次氧化还原反应的实验结果,图中A表示铁粉与水反应的氧化阶段,B为氢还原阶段,A-B过程交替进行。可以看出,随循环次数增加,反应的线型无显著变化,样品在氧化−还原反应过程中都能达到额定的最大质量和最小质量,这说明10%Zr-1%Rh-Fe粉末具有优良的循环稳定性。
2.2 机理分析

图8 铑掺杂对10%Zr-Fe粉末水分解动力学的影响Fig.8 Effect of Rh addiction on water decomposition kinetics of 10%Zr-Fe powders
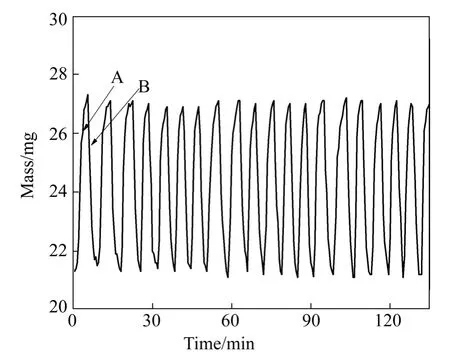
图9 10%Zr-1%Rh-Fe粉末的循环性能Fig.9 The cyclic performance of 10%Zr-1%Rh-Fe powders
为了阐述锆、铑对铁粉的改性作用机制,采用透射电镜对循环反应20次后的10%Zr-1%Rh-Fe粉末进行分析,颗粒形貌如图10(a)所示,Fe、Zr、Rh元素的面扫描结果如图10(b)所示。由图10(a)可见铁颗粒周围分布着大量的蜷曲纳米线,呈网状缠绕在一起。由图9(b)可见Fe元素只分布在颗粒区域,而Zr元素在颗粒区域及纳米线区域都呈均匀分布状态,据此可以判断纳米线的主要成分为ZrO2,由于ZrO2不会与Fe形成复合氧化物,可认为ZrO2纳米线分布在铁颗粒外表面周围的区域。从图9(b)还可看出,Rh元素的分布与Zr类似,在颗粒区域及纳米线区域也呈均匀分布。
根据上述结果,可以对铑、锆的改性作用机制作如下推测:溶液燃烧合成过程中生成Fe2O3和ZrO2纳米线混合体系,在随后的氢还原过程中,在表面能作用下铁原子发生迁移,聚集成纳米级铁颗粒。但ZrO2纳米线形态无明显变化,仍呈空间网状分布,包裹在Fe颗粒的外表面,导致Fe颗粒之间彼此不能接触,阻断了Fe原子的迁移路径, 因此Fe颗粒在氧化−还原循环过程中无法继续长大,仍保持纳米特性,因而具有良好的循环稳定性。

图10 10%Zr-1%Rh-Fe粉末经过20次氧化−还原循环后的形态Fig.10 State of Zr10%-Rh1%-Fe particles after 20th redox
铑是一种优良的催化剂,在甲烷重整、水汽转换等方面都有广泛应用。HALABI等[20]的研究结果表明铑具有催化作用,可以使吸附在其表面上的水分子离解为氧原子和氢分子,反应式如下(l表示铑表面的活性中心):

由于还原性较低,Rh在氢还原阶段转化为零价,ZrO2纳米线表面的Rh转变为单质态,颗粒表面的Rh与Fe形成固溶合金,固溶于Fe中的Rh在水分解反应过程中分布在Fe与Fe3O4的界面上[21]。在水分解反应过程中ZrO2表面及Fe3O4/Fe界面上Rh颗粒都吸附水分子,并促使其分解为氢分子和氧原子。产生的氢分子从铑表面解离并扩散至气相,而氧原子则可能发生溢流效应[22],通过表面扩散迁移至铁颗粒表面,与铁原子反应生成Fe3O4。由于铑的这种对水分子的催化裂解行为,提高了铁粉的水解反应动力学性能。
3 结论
1)以硝酸铁和甘氨酸为原料,采用溶液燃烧−氢还原法合成的铁粉为纳米级;其水分解反应动力学性能明显优于微米级铁粉,但在重复氧化反应过程中会产生明显烧结,导致动力学性能下降。
2)铁粉中添加锆元素后,抗烧结能力显著提升,优化添加量(原子分数)为10%,10%Zr-Fe在500℃下连续反应4次,水分解动力学性能无明显降低。
3)10%Zr-Fe体系中添加Rh元素后,水分解反应动力学性能显著提升,Rh的优化添加量为1%。10%Zr-1%Rh-Fe粉末具有优良的水分解动力学性能和循环稳定性,500℃下连续反应20次后性能无明显降低。
[1] KIM K R,LEE Ms,PAEKs,et al.Adsorption tests of water vapor on synthetic zeolites for an atmospheric detritation dryer[J].Radiation Physics and Chemistry,2007,76(8/9):1493−1496.
[2] WILLMS Rs,KOBAYASHI K,IWAI Y,et al.Behavior of tritium in the TSTA test cell combined with operation of the experimentaltritium cleanup (ETC) system [J].Fusion Engineering and Design,2002,61/62:575−583.
[3] KAWANO T.Water vapor decomposition reaction on ZrNi alloy[J].Fusion Engineering and Design,2006,81(1/7):791−796.
[4] 蒋国强,罗德礼,陆光达,等.氚和氚的工程技术[M].北京:国防工业出版社,2007:300−302.JIANG Guo-qiang,LUO De-li,LU Guang-da,et al.Tritium and its engineering technology[M].Beijing:National Defence Industry Press,2007:300−302
[5] GHEZZI F,SHIMAYDA W T,BONIZZONI G.An Experimental investigation of the efficiency of HTO reduction by Zr-Fe-Mn getter alloy[J].Fusion Technology,1997,31(1):75−78.
[6] VENKATARAMANIN,GHEZZI F,BONIZZONI G,et al.Isotope water handling and hydrogen isotope recovery for fusion application using the Zr(V0.5Fe0.5)2alloy[J].Fusion Technology,1996,29(1):91−95.
[7] TAMM U,HUTTER E,NEFFE G,et al.Uranium getters for tritium cleanup at the Tritium Laboratory Karlsruhe(TLK)[J].Fusion Technology,1992,21(2):983−987.
[8] EDWARDS R A,MODICA G.Reduction of tritiated water on a regenerable iron reactant:Pilotplantdesign [J].Fusion Technology,1995,28(3):586−590.
[9] YAMAGUCHI D,TANG L,WONG L,et al.Hydrogen production through methane-steam cyclic redox processes with iron-based metal oxides[J].International Journal of Hydrogen Energy,2011,36(11):6646−6656.
[10]LORENTE E,HERGUIDO J,PENA J A.Steam-iron process:Influence of steam on the kinetics of iron oxide reduction[J].InternationalJournalofHydrogen Energy,2011,36(21):13425−13434.
[11]OTSUKA K,KABURAGI T,YAMADA C,et al.Chemical storage of hydrogen by modified iron oxides[J].Journal of Power Sources,2003,122(2):111−121.
[12]URASAKI K,TANIMOTON,HAYASHI T,et al.Hydrogen production via steam-iron reaction using iron oxide modified with very small amounts of palladium and zirconia[J].Applied CatalysisA,2005,288(1/2):143−148.
[13]RYU J C,LEE D H,KANG Ks,et al.Effect of additives on redox behavior of iron oxide for chemical hydrogen storage[J].Journal of Industrial Engineering Chemistry,2008,14(2):252−260
[14]OTSUKA K,KABURAGI T,YAMADA C,et al.Chemical storage of hydrogen by modified iron oxides[J].Journal of Power Sources,2003,122(2):111−121.
[15] 李 岳,米晓云,季洪雷,等.低温燃烧合成无机化合物的研究进展[J].长春理工大学学报,2007,30(2):90−93.LI Yue,MI Xiao-yun,JI Hong-lei,et al.Researching progress on low-temperature combustion synthesis of inorganic compound[J].Journal of Changchun University of Science and Technology,2007,30(2):90−93.
[16]JAINs R,ADIGA K C,VERNEKER R P.A new approach to the thermochemical calculations of condensed fuel-oxidizer mixtures[J].Combustion and Flame,1981,40(1):71−79.
[17]CHARVIN P,ABANADESs,FLAMANT G,et al.Two-step water splitting thermolchemical cycle based on iron oxide redox pair for solar hydrogen production[J].Energy,2007,32(7):1124−1133.
[18]WANG Hui,LIU Xiao-jie,WEN Fei.Hydrogen production by the redox of iron oxide prepared by hydrothermal synthesis[J].InternationalJournalof Hydrogen Energy,2012,37(1):977−983.
[19] 叶瑞伦,方永汉,陆佩文.无机材料物理化学[M].北京:中国建筑工业出版社,1986:328−329.YE Rui-lun,FANG Yong-han,LU Pei-wen.Physical Chemistry of Inorganic Materials[M].Beijing:China Building Industry Press,1986:328−329.
[20]HALABI M H,DECROON M H,DERSCHAAF J,et al.Intrinsic kinetics of low temperature catalytic methane-stem reforming and water-gas shift over Rh/CeαZr1−αO2catalyst[J].Applied CatalysisA:General,2010,389(1/2):80−91
[21]TAKENAKAs,KABURAGI T,YAMADA C,et al.Storage and supply of hydrogen by means of the redox of the iron oxides modified with Mo and Rh species[J].Journal of Catalysis,2004,228(1):66−74.
[22] 陈诵英,孙予罕,丁云杰,等.吸附与催化[M].郑州:河南科学技术出版社,2001:307−346.CHEN Yong-ying,SUN Yu-han,DING Yun-jie,et al.Adsorption and Catalysis[M].Zhengzhou:Henan Science and Technology Press,2001:307−346
