不同产地人参蛋白差异研究△
2015-09-25卢聪鲍勇刚赵树民贾韦国刘新民
卢聪,鲍勇刚,赵树民,贾韦国,刘新民*
(1.中国医学科学院 药用植物研究所,北京 100193;2.北京博肽健诺威生物技术有限公司,北京 100085;3.加拿大UBC大学,加拿大)
·基础研究·
不同产地人参蛋白差异研究△
卢聪1,鲍勇刚2,赵树民2,贾韦国3,刘新民1*
(1.中国医学科学院 药用植物研究所,北京 100193;2.北京博肽健诺威生物技术有限公司,北京 100085;3.加拿大UBC大学,加拿大)
目的:进行不同产地人参差异蛋白的研究。方法:首先确定人参蛋白的提取方法以及膜杂交实验条件,进而使用多肽阵列与不同产地的人参蛋白进行杂交。结果:不同产地人参蛋白有明显差异,其中高纬度地区(逊克、木兰)人参蛋白与低纬度地区(长白、集安、抚松)人参蛋白间差异较大,同一纬度地区人参蛋白差异较小。结论:多肽阵列技术能够进行不同生长条件下人参差异蛋白的研究,不同产地的人参蛋白具有明显的差异。此外,获得人参蛋白特征性表达图谱,可用于人参的鉴定。
人参;蛋白;多肽阵列;差异
人参是国内外公认的药用保健珍品,为五加科植物人参PanaxginsengC.A.Mey.的干燥根和根茎,被誉为“百草之王”。我国具有悠久的人参栽培及使用历史,《神农本草经》记载:“人参补五脏、安精神、定魂魄、止惊悸、除邪气、明目开心益智,久服轻身延年。”明代李时珍《本草纲目》对人参做出更详细记载:“人参能补五脏血脉,益气生血,故为强壮药,能振奋精神”。现代大量研究表明,人参及其制品具有抗衰老[1-2]、抗肿瘤[3-4]、改善记忆力[5]、增强免疫力[6-7]等作用,同时对治疗心血管疾病[8]、糖尿病[9]、脑部疾病[10]等均有很好的疗效。
人参根中成分复杂,迄今已知其中含有人参皂苷、多糖、挥发油、脂肪酸、甾醇、维生素、蛋白质、多肽等多种有效成分[11-12]。但目前人们的研究主要集中于人参皂苷及挥发性成分上,对蛋白质及多肽的研究相对较少[13],本文利用多肽阵列技术,对不同产地人参蛋白差异进行研究,结果表明不同产地的人参蛋白具有明显的差异。
1 材料
人参选取五年生栽培参,分别产自黑龙江逊克县、黑龙江木兰县、吉林长白县、吉林抚松县、吉林集安县,新鲜采摘,-80 ℃保存。所有化学试剂均使用进口分析纯。
植物蛋白提取试剂盒(国产,上海生工生物工程有限公司);植物蛋白提取试剂盒(国产,普利莱公司);BCA蛋白定量试剂盒、植物蛋白提取试剂盒、蛋白标记试剂盒(Pierce公司)。
2 方法
2.1 采集运输保存
人参种植地现场采集,液氮保存,干冰运输,实验室-80 ℃冰箱保存。
2.2 人参蛋白提取
按提取试剂盒(上海生工生物工程有限公司植物蛋白提取试剂盒、普利莱公司植物蛋白提取试剂盒、Pierce植物蛋白提取试剂盒)说明书操作。
2.3 人参蛋白定量
按Pierce公司BCA蛋白定量试剂盒说明书操作。
2.4 人参蛋白生物素标记
按Pierce蛋白标记试剂盒说明书进行标记,具体步骤如下:
1)根据试剂盒公式计算标记需要的生物素用量;
2)使用170 μL的PBS(pH7.2)溶液溶解Biotin,获得浓度为20 mmol的标记用Biotin溶液;
3)根据计算结果,加入100 μL的Biotin溶液至1 mg的纯化蛋白溶液中(0.5~2 mL),室温反应1 h或冰浴反应2 h;
4)PBS平衡脱盐柱后,加入标记蛋白反应液,离心2 min;
5)收集过柱溶液即生物素化蛋白溶液,BCA法定量,剩余蛋白溶液4 ℃保存;
6)使用试剂盒HABA方法检测生物素标记效果。
2.5 人参蛋白生物素标记效率检测
实验步骤与常规WB实验相同,生物素化蛋白SDS-PAGE,蛋白条带转膜,洗膜,HRP-Streptavidin(使用比例1∶20 000)与膜共孵育,洗膜,显色照相。
2.6 随机多肽阵列膜合成
配制0.25 mol·L-1Fmoc-氨基酸溶液;封闭液Ⅰ(2% acetic anhydride 于DMF);封闭液Ⅱ(2% acetic anhydride+2% DIPEA于DMF);Fmoc-移除液(20%piperidine于DMF)。
活化的膜放置于全自动合成仪上;根据程序自动转移Fmoc-氨基酸溶液到活化膜上的特定位置,与膜进行反应2×20 min;膜按序浸入封闭液Ⅰ中和封闭液Ⅱ中,进行侧链封闭;用DMF清洗膜4次;膜放入去保护溶液中2次,用于移除氨基端的Fmoc保护基团;去保护之后,用DMF清洗3次,而后再用乙醇干燥。重复以上步骤,直至多肽阵列全部合成完毕。全部合成后,用溶液去除侧链保护基团,再用二氯甲烷(CH2Cl2)清洗4次,而后用乙醇-20 ℃干燥,保存,用于下一步杂交反应实验。
2.7 阵列膜与标记蛋白杂交检测
阵列膜激活及用封闭液封闭;生物素化待检蛋白溶液(15 μg·mL,5 mL)与阵列膜4 ℃孵育过夜;TBST洗膜,洗去未结合的生物素化待检蛋白及其他杂质;用封闭液稀释的HRP-Streptavidin(稀释比例1∶10 000)与阵列膜孵育;洗去未结合的标记链霉亲和素及其他杂质;常用化学发光检测试剂显色;数字成像设备照相,软件分析显色点灰度值,通过数据分析辨别阳性显色点。
3 结果
3.1 人参蛋白提取方法的确定
为提取最佳的人参蛋白进行后续抗体芯片杂交研究,评估不同的植物蛋白提取试剂盒提取人参蛋白的效率及效果,使用3种不同的植物蛋白提取试剂盒提取同一产地的人参蛋白。Pierce提取试剂盒提取步骤少,对实验环境要求低且提取效率最高,达到2%以上,见表1。蛋白电泳检测三种不同提取试剂盒提取人参蛋白的质量,结果如图1所示,3种不同提取试剂盒提取的人参蛋白质量差异较明显,Pierce提取试剂盒提取蛋白更完整清晰,质量更高。最终选择Pierce提取试剂盒提取人参蛋白。
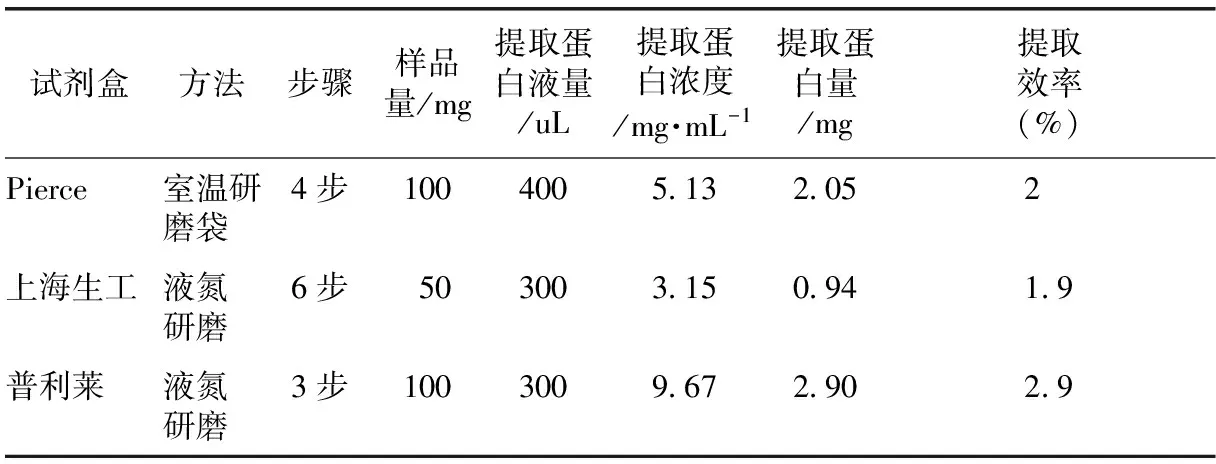
表1 不同人参提取试剂盒提取效率比较
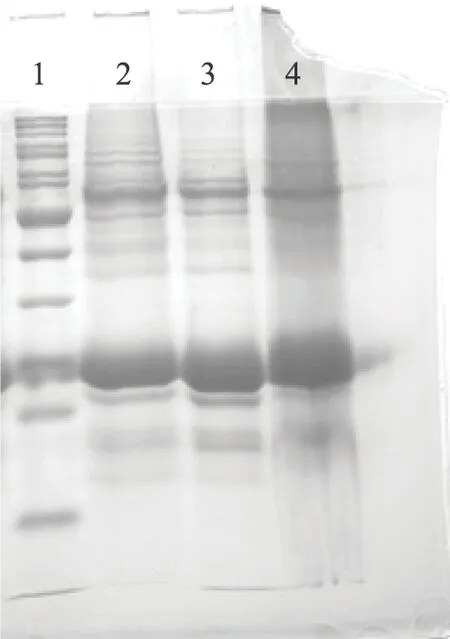
1.蛋白Marker;2.Pierce试剂盒提取蛋;3.上海生工试剂盒提取蛋白;4.普利莱试剂盒提取蛋白。注:蛋白样品量50 μg。 图1 不同试剂盒提取蛋白质量比较
3.2 人参蛋白标记效率检测
使用Pierce生物素标记试剂盒进行人参蛋白标记后,为确保标记效率,使用WB方法检测标记蛋白标记效率。如图2所示,转膜后的生物素化蛋白用HRP-Streptavidin共孵育,化学发光试剂曝光压片,结果整个蛋白条带都有显色,表明生物素标记效率较高。

A.SDS-PAGE电泳图(蛋白上样量为20 μg);B.WB检测(蛋白电泳蛋白量为2 μg,HRP-Streptavidin的工作比例为1∶100 000)。注:1-1逊克的人参蛋白;2-1木兰的人参蛋白;3-1长白的人参蛋白;4-1抚松的人参蛋白;5-1集安的人参蛋白。图2 不同产地人参蛋白生物素标记效率检测
3.3 人参蛋白杂交条件
为确保合适的人参蛋白杂交效果,使用同一产地的生物素化人参蛋白与多肽阵列膜进行杂交条件研究。经过实验确定生物素化人参蛋白的杂交条件:生物素化蛋白浓度15 μg·mL-1,HRP-Streptavidin工作液稀释比例为1∶10 000,见图3。
3.4 人参蛋白表达差别比较
基于上述的研究结果,使用不同产地人参蛋白与合成的随机多肽阵列膜进行杂交反应。在相同的反应条件下,不同产地人参蛋白的显色点有明显的差异,如图4所示。使用图像分析软件统计分析这些差异点,从表2中可以看出,木兰县产人参的特征表达蛋白点数最高,其次是逊克,抚松、集安县特征表达蛋白点数最少。
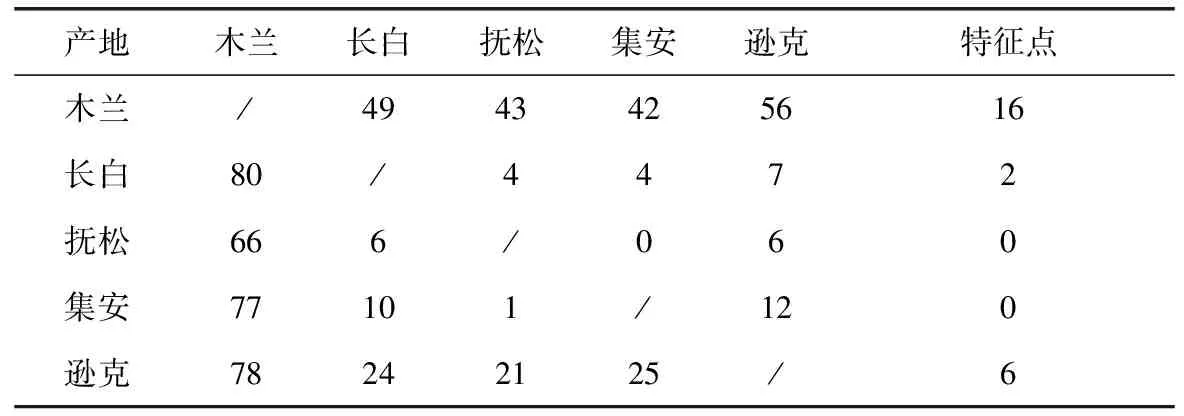
表2 不同产地人参蛋白表达差异点
3.5 人参蛋白表达谱发现
分析上述5个不同产地的人参蛋白与随机多肽阵列杂交图谱,选择所有图谱中共有的阳性显色点组成蛋白表达点图谱,可用于人参的鉴定。如图5A中,红色圈出的显色点组成的点阵,为本项目中5个产地人参蛋白的特征性表达谱。同样的方法,分析长白、集安、抚松三地的蛋白杂交图,共同的显色点组成的点阵,即为上述三地人参蛋白的特征性蛋白表达谱,可用鉴定此三地的人参。

A.标记蛋白杂交浓度25 μg·mL-1,HRP-链酶亲和素使用浓度1∶5 000;B.标记蛋白杂交浓度20 μg·mL-1,HRP-链酶亲和素使用浓度1∶8 000;C.标记蛋白杂交浓度15 μg·mL-1,HRP-链酶亲和素使用浓度1∶10 000;D.标记蛋白杂交浓度10 μg·mL-1,HRP-链酶亲和素使用浓度1∶10 000;E.标记蛋白杂交浓度6 μg·mL-1,HRP-链酶亲和素使用浓度1∶10 000。图3 生物素化人参蛋白与多肽阵列杂交条件

A.木兰县;B.逊克县;C.长白县;D.抚松县;E.集安县。图4 不同产地人参杂交图

A.人参蛋白差异表达谱;B.长白、集安、抚松三地差异蛋白表达谱。图5 人参差异蛋白表达谱
3.6 差异蛋白鉴定
选择上述差异点,鉴定后合成大点捕获差异蛋白,进行质谱鉴定,鉴定结果如图6所示。样品检测1 000~1 000 000Da没有看到质谱峰,分析原因可能是样品含糖太高、带电能力太弱,无法带电飞行。

A1.样品1分子量1 000~6 000Da;A2.样品1分子量5 000~1 000 000Da;B1.样品2分子量1 000~6 000Da;B2.样品2分子量5 000~1 000 000Da。图6 差异蛋白质谱鉴定图
3 讨论
人参是我国传统的中药材,在我国具有广泛、悠久的研究历史。但之前的研究多集中于人参的活性成分,很少涉及人参蛋白。近年来进行的人参蛋白鉴定研究也主要集中于人参中活性多肽的开发鉴定,对人参蛋白的研究多集中在皂苷代谢酶类及生理活性酶类。本实验是国内外首次使用多肽阵列技术鉴定人参差异表达蛋白,与其他的组学方法相比,这一技术突出的优势在于受蛋白表达丰度的影响小,实验步骤简单、易操作,结果也表明这一技术能够发现不同产地人参中差异表达的蛋白质。
目前常用的人参蛋白提取方法多为缓冲液浸提法,其优点是蛋白提取得率高,缺点是处理过程复杂、时间较长、蛋白易降解。在本实验中,使用分子生物学提取方法进行人参蛋白的提取,该方法相较于传统的浸提法具有操作简便、处理时间较短等特点。实验结果表明,使用分子生物学方法提取的人参蛋白能够满足后续膜杂交实验的需要。
人参中糖蛋白含量比较高,对后续鉴定会产生许多不利的影响。本实验在发现人参差异表达蛋白的基础上,力图使用质谱技术进行差异表达蛋白的鉴定。但从结果来看,差异蛋白很有可能还是以糖蛋白为主,这为我们的质谱鉴定带来了极大的困扰。因此,可考虑在下一步研究过程中,对人参蛋白除糖后使用质谱技术进行差异表达蛋白的鉴定。
总之,在本实验中,利用多肽阵列技术发现不同产地人参中存在差异表达蛋白质,说明不同产地人参在蛋白表达上存在明显的差别,这为我们进一步深入研究提供参考。同时也表明多肽阵列技术可以用于差异化蛋白表达的发现及研究,这一技术的引进,也必将对我国相关领域科研水平的提高发挥重要作用。
[1] Liu M,Zhang J.Effects of ginsenoside Rb1and Rg1on synaptosomal free calcium level,ATPase and calmodulin in rat hippocampus[J].Chin Med J(Engl),1995,108(7):544-547.
[2] 王红丽,吴铁,吴志华,等.人参皂苷抗皮肤衰老作用实验研究[J].广东药学院学报,2003,19(1):25-27.
[3] 高峰.人参与人参皂苷Rh2-恶性肿瘤治疗的新观点[J].人参研究,2001,13(4):17-18.
[4] 魏强,李静,刘艺,等.MAPK信号转导通路在人参多糖诱导白血病K562细胞凋亡中的作用[J].中草药,2013,44(2):193-198.
[5] 胡圣望,胡勇,胡王平.人参皂甙Rg1对慢性应激大鼠空间学习记忆能力的影响[J].四川中医,2004,22(3):14-16.
[6] Cho W C.Recent Progress in Medicinal Plants[M].Drug Plants II.Houston:Studium Press,2010,28.
[7] 吴浩,林洪生,裴迎霞,等.人参皂甙Rg3对荷瘤及环磷酰胺化疗小鼠粘膜免疫力影响[J].中国肿瘤,2006,15(6):369-371.
[8] 田建明,李浩,叶金梅,等.人参皂苷Rg2对大鼠化学性心肌缺血的影响[J].中国中药杂志,2003,28(12):1191-1192.
[9] 张秋梅,张喆,于德民,等.人参糖肽治疗Ⅱ型糖尿病的临床观察[J].中国现代医学杂志,2003,13(6):59.
[10] Kim D H,Bae E A,Han M J,et al.Novel use of the extract of processed ginseng and saponin isolated there from:US,20050232908 [P].2005-10-20.
[11] 窦德强,靳玲,陈英杰.人参的化学成分及药理活性的研究进展与展望[J].沈阳药科大学学报,1999,16(2):151-156.
[12] 黎阳,张铁军,刘素香,等.人参化学成分和药理研究进展[J].中草药,2009,40(1):164-附2.
[13] 王逸,鲍勇刚,贾韦国,等.人参蛋白研究[J].中草药,2013,44(19):2782-2786.
[14] 李红艳,赵雨,杨士慧,等.人参不同部位超氧化物歧化酶活力比较[J].时珍国医国药,2010,21(3):513-514.
[15] 李红艳,赵雨,刘宏,等.山参、园参、西洋参和红参的超氧化物歧化酶活性比较[J].中国医院药学杂志,2010,30(14):1177-1179.
[16] 邢楠楠,赵雨,杨菲,等.人参生长季根中几种氧化还原酶的活力变化研究 [J].辽宁中医杂志,2012,39(8):1586-1588.
[17] 李芸彤,赵雨,陈雨,等.人参根中5种酶在不同时期的活力比较[J].中国新药杂志,2012,21(12):1384-1388.
[18] 邢楠楠,赵雨,杨菲,等.人参不同生长时期根中5种水解酶的活力变化研究[J].中华中医药杂志,2013,28(2):379-382.
[19] 李红艳,赵雨,张鑫,等.不同产地、不同生长年限人参SOD的比较[J].中国医院药学杂志,2010,30(12):994-996.
[20] 邢楠楠,赵雨,刘宏,等.不同产地、不同年限人参中淀粉酶、酯酶、酸性磷酸酯酶的活力比较[J].中国现代应用药学,2011,28(1):44-47.
[21] Nagappan A,Karunanithi N,Sentrayaperumal S,et al.Comparative root protein profiles of Korean ginseng(Panaxginseng)and Indian ginseng(Withaniasomnifera)[J].Am J Chin Med,2012,40(1):203-218.
[22] 侯元,孙萍,焦连庆,等.人参蛋白的等电聚焦电泳分析[J].人参研究,1992(4):34-36.
[23] 张巍,李红艳,马晶,等.人参水溶性蛋白的纯化工艺研究[J].吉林农业大学学报,2008,30(1):36-39.
[24] 姜先刚,赵雨,张巍,等.人参水溶性蛋白SDS-聚丙烯酰胺凝胶电泳指纹图谱研究[J].药物分析杂志,2008,28(6):873-876.
[25] 白雪媛,赵雨,张惠,等.不同产地人参中水溶性蛋白质含量的差异性研究[J].中药与天然药物,2012,29(11):980-983.
[26] 霍艺丹,陈文学,郭晓雨,等.不同海拔对人参粗蛋白含量的影响[J].中国现代中药,2011,13(5):16-17.
DifferentialproteomicanalysisofPanaxginsengfromdifferenthabitats
LU Cong1,BAOYonggang2,ZHAOShumin2,JIAWeiguo3,LIUXinmin1*
(1.TheChineseAcademyofMedicalSciences,TheInstituteofMedicinalPlantDevelopment,Beijing100193,China;2.BeijingGenovaxBiotechCorporation,Beijing100085,China;3.UniversityofBritishColumbia,Canada)
Objective:To research differences between Ginseng protein fromPanaxginsengof different origins.Methods:The extraction methods of ginseng protein and the experiment conditions of membrane hybridization were established,and peptide arrays method was applied to hybrid with ginseng protein.Results:There were significant differences in Ginseng protein fromP.ginsengof different origins,in which the difference was significant between high latitude regions(XK、ML)and low latitude regions(CB、JA、XS),and the difference was not obvious between the same latitude regions(XK and ML or CB、JA、XS).Conclusion:The polypeptide array technology can be used to research the ginseng protein ofP.ginsengof different origins and different growth conditions.Ginseng protein from different regions showed obvious difference.In addition,ginseng protein expression characteristic map can be used for the identification ofP.ginseng.
ginseng;protein;polypeptide arrays;differences
2014-10-14)
国际科技合作与交流专项——人参益智药效与基因/蛋白表达谱关联规律合作研究(2011DFA32730);全军医学科技“十二五”科研项目——中长期航天飞行所致应激损伤评价与防护关键技术研究(BWS11J052)
*
刘新民,教授,博士研究生导师,研究方向:中药神经药理学;Tel:(010)-57833245,E-mail:liuxinmin@hotmail.com
10.13313/j.issn.1673-4890.2015.1.002
