苏铁叶黄酮类化合物的检测与提取工艺研究△
2015-09-25史红艳朱海萍杨培君
史红艳,朱海萍,杨培君
(陕西理工学院 生物科学与工程学院,陕西 汉中 723001)
·基础研究·
苏铁叶黄酮类化合物的检测与提取工艺研究△
史红艳,朱海萍,杨培君*
(陕西理工学院 生物科学与工程学院,陕西 汉中 723001)
目的:以苏铁叶为研究材料,开展黄酮类化合物的检测,同时对其提取工艺进行优化。方法:以UV法检测的苏铁叶总黄酮得率为评价指标,在单因素试验的基础上,采用L9(34)正交试验,优化提取工艺条件。结果:定性检测显示,苏铁叶中含黄酮、二氢黄酮等黄酮类化合物组分。研究结果表明,最佳工艺参数:提取温度为80 ℃,乙醇浓度为70%,料液比为1∶25,提取时间为1.5 h。在此条件下总黄酮的平均得率为1.67%。结论:该工艺合理,重复性好,能有效提高苏铁叶总黄酮得率。
苏铁叶;总黄酮;检测;工艺优化
苏铁叶为苏铁科苏铁属植物苏铁CycasrevolutaThunb.的叶,又名铁树叶[1]、凤尾蕉叶[2]。甘、淡,平,小毒。入肝、胃经,有理气、活血功能[2]。相关研究报道[4-6],苏铁叶中药复方制剂经煎煮后对小鼠肿瘤生长有抑制作用[3],可治疗胃癌、肺癌、肝癌等。据调查,陕南民间有铁树叶治结肠炎等疾病的用法。
相关研究报道[7-11],黄酮类化合物具有多种生理活性,如抗氧化、抗炎抑菌、抗病毒、抗糖尿病、抗抑郁、延缓衰老、增强心血管功能、保护神经系统、改善记忆力以及增强免疫力等。对苏铁研究报道较少,潘韬文报道了苏铁种皮[12];刘世彪报道了苏铁种子的化学成分及毒性[13];熊江等[14]从贵州苏铁叶中分离出8种化合物;杨秋利[15]对苏铁中的微量元素进行了测定;此外,有关苏铁分类学[16]、解剖学[17]、分子生物学[18-19]方面以及提取物病理学研究[4,20]也有报道,但苏铁叶中黄酮类化合物的系统研究尚未见报道。本研究以苏铁叶为供试材料,通过乙醇水溶液热回流提取法,开展苏铁叶总黄酮化合物的检测及提取工艺条件的优化,以期为苏铁叶黄酮类化合物的研究与利用提供参考依据。
1 材料与方法
1.1 材料
苏铁叶于2012年9月采集于陕西汉中市栽培植株,烘干后粉碎,过粒径为0.45 mm的筛,备用。
1.2 试剂与仪器
亚销酸钠(NaNO2)、氯化铝(AlCl3)、氢氧化钠(NaOH)、95%乙醇、无水乙醇、乙醚等均为分析纯;芦丁标准品(中国食品药品检定研究院,批号:100080-200707)。
紫外可见分光光度计(UV-2550,日本岛津);电子天平(梅特勒AL204,精密度0.000 1 g);旋转蒸发仪(RV10,德国IKA公司);优普超纯水机(UPH-Ⅱ,成都超纯科技有限公司);索氏提取仪。
1.3 方法
1.3.1 总黄酮的提取 考虑溶剂的极性、毒性及后续处理的难度,故选取一定浓度的乙醇作为提取溶剂,提取流程为苏铁叶粉末→乙醚去脂→乙醇热回流→抽滤→定容→黄酮类化合物溶液。
1.3.2 总黄酮的定性测定 分别用盐酸-镁粉、盐酸-锌粉、硼氢化钠(NaBH4)、AlCl3等8种显色剂做显色反应,对苏铁叶黄酮类化合物进行定性检测。
1.3.3 UV法检测设计与总黄酮的定量测定 取一定量的芦丁标准品和样品溶液,经NaNO2-AlCl3显色后,用UV-2550紫外可见分光光度计于400~600 nm波长扫描,以确定扫描波长。
精密称取120 ℃干燥至恒重的芦丁对照品6.0 mg,用60%乙醇水溶液溶解并定容于50 mL容量瓶,摇匀,即得芦丁标准溶液。精密吸取芦丁标准溶液0.0、1.0、2.0、3.0、4.0、5.0 mL,分别置于10 mL容量瓶中,加入浓度为0.5 mol·L-1的NaNO2溶液0.3 mL,摇匀,放置6 min;然后加入浓度为0.3 mol·L-1的AlCl3溶液0.3 mL,摇匀,放置6 min;再加入浓度为1.0 mol·L-1NaOH溶液4.0 mL,用60%乙醇稀释至10.0 mL,配成系列标准溶液,放置15 min后,在确定的波长处测定吸光度,以吸光度对质量浓度作标准曲线。
吸取2.0 mL样品提取液于10 mL容量瓶中,按上述芦丁标准曲线绘制方法配制溶液,以试剂空白为参比液,测其吸光度记为A,代入标准曲线得提取液浓度C(μg·mL-1)。按以下公式计算苏铁叶中总黄酮得率X(%):

C为样品溶液中黄酮类化合物的浓度(μg·mL-1);V为供试样品的体积(mL);w为称取样品重量(μg);b为供试液稀释倍数。
1.3.4 单因素试验 准确称取脱脂后的苏铁叶粉末3份,每份1.0 g,置于三角瓶中,根据各提取因素,采用不同的单因素3水平试验进行热回流提取。抽滤后得乙醇提取液,滤渣重复提取2次,趁热抽滤,合并滤液,并定容至100 mL。按标准曲线建立的方法测定吸光度,并计算总黄酮类化合物的得率。
1.3.5 正交试验设计 考虑各因素之间的相互影响,试验以苏铁叶中总黄酮得率为衡量指标。分别选取提取温度、料液比、乙醇浓度和提取时间4因素及其对应的3个较优水平,进行L9(34)正交试验,确定提取总黄酮的最佳工艺条件,正交试验设计见表1。

表1 因素水平表
1.3.6 方法验证 重复性试验:准确称取苏铁叶粉末6份各1.0 g,按确定的工艺制备样品溶液。以标准曲线的建立方法测定吸光度,计算苏铁叶黄酮类化合物含量。
回收率试验:准确吸取3份已知质量浓度的供试样品溶液1.0 mL于试管中,分别加入0.5、1.5、2.5 mL的芦丁标准液(质量浓度为0.11 mg·mL-1),按标准曲线的建立方法测定3组加标样品的吸光度值,每组加标样品平行测定3次,计算平均值。回收率公式:回收率(%)=(加标试样测定黄酮量-已知试样黄酮量)/加标量×100%
稳定性试验:移取样品溶液2.0 mL,以标准曲线建立方法测定吸光度,每隔10 min测一次,测程70 min。
精密度试验:移取最佳条件下提取的苏铁叶样品液2.0 mL于10 mL容量瓶中,按标准曲线的建立方法测定吸光度值,平行测定6次。
2 结果与分析
2.1 显色反应结果
黄酮类化合物的定性检测结果表明,苏铁叶中黄酮、黄酮醇、二氢黄酮、查尔酮等呈阳性反应,见表2。

表2 黄酮类化合物显色反应结果
2.2 波长扫描结果
经波长扫描,芦丁标准溶液和黄酮样品溶液在505 nm处均有吸收峰,且峰形相似,故芦丁可作为对照品用于检测苏铁叶黄酮类化合物。
2.3 标准曲线的绘制
配制系列浓度的芦丁标准溶液,在波长505 nm处测定吸光度,并以质量浓度为横坐标,吸光度为纵坐标绘制标准曲线。芦丁对照品溶液,在0~60 μg·mL-1与吸光度线性关系良好,线性回归方程为Y=11.543X+0.0677,r=0.999 6,见图1。
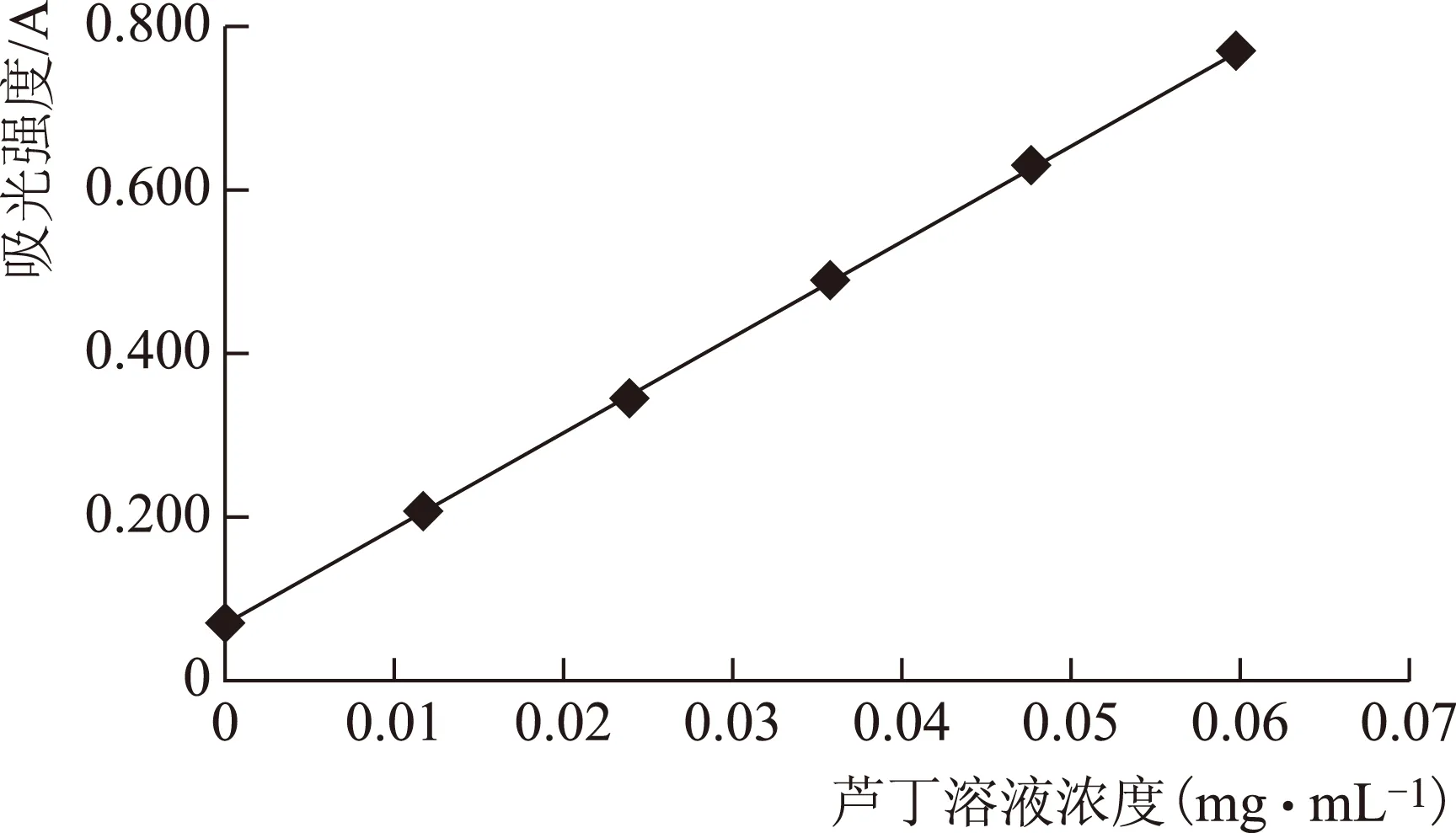
图1 芦丁对照品标准曲线
2.4 提取次数的选择
准确称取1.0 g苏铁叶干粉,在温度为80 ℃,乙醇浓度为60%,料液比为1∶20,提取时间2 h条件下,分别提取黄酮1、 2、3、4次。提取3次时总黄酮的得率相对最大,故选3次为最佳提取次数,见图2。

图2 提取次数对黄酮类化合物得率的影响
2.5 单因素试验结果
2.5.1 提取时间对苏铁叶中总黄酮得率的影响 准确称取1.0 g苏铁叶干粉,固定其他3因素,比较提取时间对总黄酮得率的影响,重复提取3次,合并滤液。提取时间在2 h内,总黄酮得率随时间增加而增加;2~2.5 h其得率基本不变,之后得率反而下降。综合考虑,选取2 h为最佳提取时间,见图3。

图3 提取时间对黄酮类化合物得率的影响
2.5.2 料液比对苏铁叶中总黄酮得率的影响 准确称取1.0 g苏铁叶干粉,固定其他条件,分别提取2 h,比较不同料液比对总黄酮得率的影响。随料液比降低,苏铁叶总黄酮得率逐渐增加;但当料液比为1∶20时,总黄酮得率达到最大值;继续降低料液比,其得率反而下降。故选取1∶20为最佳料液比,见图4。

图4 料液比对黄酮类化合物得率的影响
2.5.3 提取温度对苏铁叶中总黄酮得率的影响 准确称取1.0 g苏铁叶干粉,在前2个最优单因素条件下,固定其他条件,比较不同温度对总黄酮得率的影响。随提取温度的升高,黄酮类化合物的得率增加;当达80 ℃以上,得率增加不明显;继续升高温度得率降低。故选取80 ℃为最佳提取温度,见图5。

图5 温度对黄酮类化合物得率的影响
2.5.4 乙醇浓度对苏铁叶中总黄酮得率的影响 准确称取1.0 g苏铁叶干粉,选择以上3个最优单因素,比较不同浓度乙醇对总黄酮得率的影响。当乙醇浓度达70%时,总黄酮得率获最大值;再增大乙醇浓度,总黄酮得率反而降低。故选70%为最佳乙醇浓度,见图6。

图6 乙醇浓度对黄酮类化合物得率的影响
2.6 正交试验结果
在单因素试验的基础上,选择L9(34)正交表,对提取温度、乙醇浓度、提取时间和料液比4因素进行正交试验,确定最佳提取条件,试验结果见表3、方差分析见表4。
4因素中提取温度对总黄酮得率影响最大,各因子对总黄酮得率的影响主次顺序依次为提取温度(A)>提取时间(C)>料液比(D)>乙醇浓度(B)。分析正交试验结果,确定工艺条件为A3B2C1D3。结合单因素试验结果,综合考虑成本和以上因素,最终确定苏铁叶总黄酮的最佳工艺优化条件为A2B2C1D3。即:提取温度为80 ℃,乙醇浓度为70%,提取时间为1.5 h,料液比为1∶25。
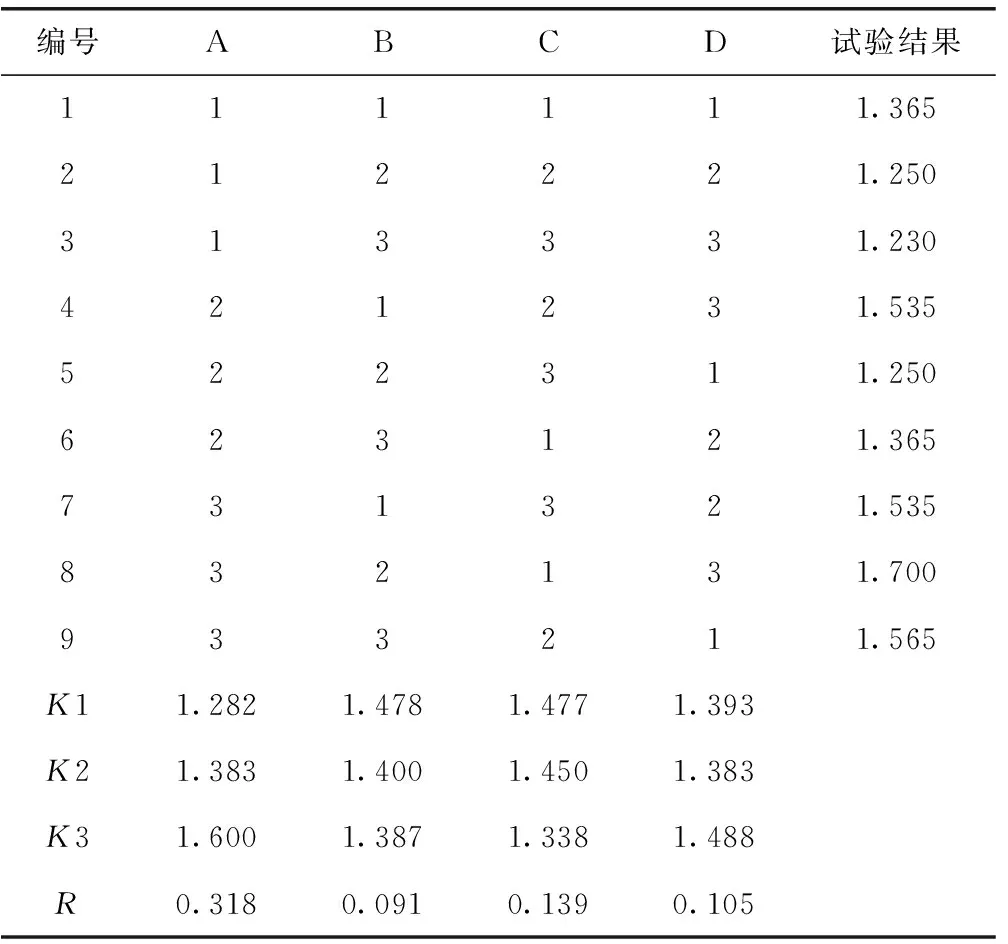
表3 正交试验结果
注:A1.提取温度为70 ℃;A2.提取温度为80 ℃;A3.提取温度为90 ℃;B1.乙醇浓度为60%;B2.乙醇浓度为70%;B3.乙醇浓度为80%;C1.提取时间为1.5 h;C2.提取时间为2.0 h;C3.提取时间为2.5 h;D1.料液比为1∶15;D2.料液比为1∶20;D3.料液比为1∶25。

表4 方差分析结果
2.7 样品的UV法检测结果
在优化的条件下,样品的总黄酮平均得率为1.67%,RSD=2.66%,见表5。

表5 样品的UV法试验结果(n=3)
2.8 方法验证试验结果
重复性试验结果,RSD=2.30%(n=6),表明其重复性良好。回收率试验结果表明,方法的准确度高,见表6。
稳定性试验结果表明,苏铁叶黄酮类化合物显色后,30 min内吸光度无明显变化;30 min以后,吸光度逐渐降低;建议在30 min内完成试验测定。
精密度试验结果:样品溶液6次测定的平均吸光度值为0.457,RSD值为0.309%,表明仪器的精密度良好。

表6 加样回收率试验结果(n=9)
3 讨论
通过显色反应定性确定苏铁叶中含有黄酮、二氢黄酮等黄酮类化合物,但其组分鉴定还有待进一步研究。在单因素试验的基础上,采用L9(34)正交试验对苏铁叶黄酮类化合物的提取工艺条件进行优化。结果表明,随各单因素的依次优化,最优条件逐步增多,黄酮的得率也随之逐渐增大。优化的苏铁叶总黄酮提取工艺条件:温度为80 ℃,料液比为1∶25,提取时间为1.5 h,乙醇浓度为70%,此条件下苏铁叶的总黄酮得率为1.67%。各因素对苏铁叶总黄酮得率的影响主次顺序依次为提取温度(A)>提取时间(C)>料液比(D)>乙醇浓度(B)。在优化工艺条件下,苏铁叶总黄酮得率较高,重复性好。采用本方法对苏铁叶提取液中总黄酮含量进行定量分析,其工艺及条件可行性和可操作性强,结果可靠。
不同植物材料总黄酮提取工艺有一定的差异,张吉祥等[21]采用微波辅助法提取枣核中的总黄酮,报道各因素对枣核黄酮提取的影响程度大小依次为料液比>提取温度>提取时间>乙醇体积分数>微波功率;赵雪梅等[22]采用二次旋转组合设计的方法,探讨常山胡柚皮中黄酮类化合物的最佳提取工艺参数,指出影响黄酮提取率的参数主次顺序为提取时间>料液比>提取温度=乙醇浓度。比较结果表明,采用不同方法,在不同条件下提取黄酮类化合物,显著性影响因素不同,而其他因素影响差别较小。因此,本试验所得的优化工艺条件合理,可为苏铁叶总黄酮的进一步研究和资源开发利用提供参考依据。
张婧萱等[23]报道,淮山药中总黄酮含量为1.12%;黄红英等[24]测定青蒿中黄酮类化合物的含量为2.885%;旷春桃等[25]研究大叶冬青叶中总黄酮提取工艺,并采用氯化铝法测定黄酮的含量,其总黄酮得率为0.68%;薛淑萍等[26]在优化工艺条件下,测定桑叶中黄酮类化合物含量为0.18%。比较结果表明,苏铁叶中黄酮类化合物含量除低于青蒿外,高于淮山药、大叶冬青叶、桑叶中的含量。因此,苏铁叶作为一种含黄酮类化合物的中草药资源植物,具一定的开发利用潜力。
[1] 中国科学院西北植物研究所.秦岭植物志:第一卷(第一册)[M].北京:科学出版社,1976:2.
[2] 江苏新医学院.中药大辞典[M].上海:上海科学技术出版社,1979:491-492.
[3] 梁建军,李德福.纯中药复方制剂对小鼠肿瘤生长抑制作用的研究[J].中国现代药物应用,2009,3(20):37-38.
[4] 孔繁翠,顾昊,王鹤尧,等.铁树提取物对人肺腺癌细胞凋亡的诱导及相关机制的初步研究[J].中国新药杂志,2008,17(8):667-672.
[5] 潘保永,崔碧玲.黄酮类化合物对癌细胞周期的影响及诱导癌细胞凋亡的作用[J].卫生职业教育,2005,23(11):82-83.
[6] 唐栩,许东晖,梅雪婷,等.26种黄酮类天然活性成分的药理研究进展[J].中药材,2003,26(1):46-54.
[7] 延玺,刘会青,邹永青,等.黄酮类化合物生理活性及合成研究进展[J].有机化学,2008,28(9):1534-1544.
[8] 龚金炎,吴晓琴,毛建卫,等.黄酮类化合物抗抑郁作用的研究进展[J].中草药,2011,42(1):195-200.
[9] Geleijnse J M.,Hollman P CH.Flavonoids and cardiovascular health:Which compounds,what mechanisms[J].Am.J.Clin.Nutr.,2008,88(1):12-14.
[10] 曹纬国,刘志勤,邵云,等.黄酮类化合物药理作用的研究进展[J].西北植物学报,2003,23(12):2241-2247.
[11] 禹志领,张广钦,赵红旗,等.葛根总黄酮对小鼠记忆行为的影响[J].中国药科大学学报,1997,28(6):350-353.
[12] 潘韬文.苏铁的化学成分和龙胆苦苷的结构修饰研究[D].云南:云南中医学院,2012.
[13] 刘世彪,彭小列,吕江明,等.苏铁种子的营养成分及急性毒性实验[J].营养学报,2010,32(5):100-102.
[14] 熊江,谭宁华,古昆.贵州苏铁的化学成分[J].有机化学,2005,25(增刊):461.
[15] 杨秋利.火焰原子吸收光谱法测定铁树中微量元素[J].光谱实验室,2007,24(5):918-920.
[16] 马永,李楠,苏俊霞,等.中国苏铁属植物的分类学研究现状与展望[J].山西师范大学学报自然科学版,2005,19(2):73-77.
[17] 谢建光,刘念.苏铁属叉叶苏铁亚组国产种类的羽片比较解剖学研究[J].广西植物学,2012,32(5):587-592.
[18] 李璐,付乾堂,余迪求.一种从苏铁叶片中有效提取RNA的方法[J].云南植物研究,2008,30(5):593-596.
[19] 肖龙骞,朱华.苏铁nrDNA ITS区的序列多态性:不完全致同进化的证据[J].生物多样性,2009,17(5):476-481.
[20] 孙玲玲,毕福勇,凌烈峰,等.铁树叶提取液对白血病细胞株K562、HL-60增殖抑制作用的实验研究[J].九江医学,2001,16(4):192-193.
[21] 张吉祥,欧来良.枣核总黄酮的微波辅助提取工艺优化[J].食品科学,2012,33(16):45-49.
[22] 赵雪梅,叶兴乾,席玙芳.胡柚皮中黄酮类化合物提取工艺优化研究[J].中国食品学报,2004,4(2):19-24.
[23] 张婧萱,廖保宁,黄锁义.淮山药中总黄酮的提取及对羟自由基的清除作用[J].微量元素与健康研究,2007,24(1):44-45,54.
[24] 黄红英,邓斌,张晓军,等.青蒿中黄酮类化合物的提取及其抗氧化性研究[J].安徽农业科学,2009,37(7):3037-3039.
[25] 旷春桃,李湘洲,汪玉霞,等.大叶冬青叶中总黄酮测定方法和提取工艺研究[J].食品科学,2009,30(6):49-51.
[26] 薛淑萍,张立伟.桑叶中黄酮类化合物的提取工艺的优化[J].中国生化药物杂志,2010,31(6):405-407.
Extraction and Determination of Flavonoids from Leaves ofCycasrevoluta
SHI Hongyan,ZHU Haiping,YANG Peijun*
(School of Biological Science and Engineering,Shaanxi University of Technology,Hanzhong Shaanxi 723001,China)
Objective:To study the extraction and determination of flavonoids from leaves ofCycasrevoluta.Methods:The total flavonoids was determined by UV.The yield of total flavonoids was used as index,the extraction condition was optimized by single factor test and orthogonal design L9(34).Results:The results showed that the leaves ofC.revolutacontained varied flavonoids,including flavones,dihydrogen flavones etc.The optimal extraction conditions were as the following:temperature of 80 ℃,ethanol concentration of 70%,solid-liquid ratio of 1∶25 and time 1.5 h.With this method,the extraction ratio of total flavonoids was 1.67%.Conclusion:The established method is reasonable,reproducible,and can effectively improve the yield of total flavonoids fromC.revolutaleaves.
Cycasrevolutaleaves;flavonoids;determination;technological optimization
10.13313/j.issn.1673-4890.2015.2.009
2014-06-11)
国家中医药公共卫生专项(201207002);汉中市科技计划发展项目(2012-46-1)
*
杨培君,教授,研究方向:资源植物研究;E-mail:yang@snut.edu.cn
