78例乳腺导管内癌临床分析
2015-09-20林晓萌史建伟王健李中河北大学河北保定07000河北大学附属医院肿瘤外科河北保定07000
林晓萌,史建伟,王健,李中(. 河北大学,河北 保定 07000;. 河北大学附属医院肿瘤外科,河北 保定 07000)
78例乳腺导管内癌临床分析
林晓萌1,史建伟2,王健1,李中2
(1. 河北大学,河北 保定 071000;2. 河北大学附属医院肿瘤外科,河北 保定 071000)
目的 探讨不同肿块大小的乳腺导管内癌(ductal carcinoma in situ,DCIS)的临床、病理特点。方法 回顾性分析河北大学附属医院2011年2月至2013年9月收治的78例DCIS病例特点,以肿块大小1.0 cm及3.0 cm为分界点,进行对比分析。结果 肿块≤1.0 cm及肿块1.0~3.0 cm临床特征差异无统计学意义(P>0.05),而肿块>3.0 cm与前2者相比差异有统计学意义(P<0.05),多表现为微浸润,多灶性比例高以及前哨淋巴结阳性比例高。DCIS与浸润性导管癌(infiltrating ductal carcinoma,IDC)进行病理学指标的差异性分析,ER、PR、Ki67阳性表达相对低、HER-2阳性表达相对高(P<0.05),差异有统计学意义,而IDC与肿块>3.0 cm的DCIS进行分析,各指标差异无统计学意义(P>0.05)。结论 肿块>3.0 cm的DCIS是一种特殊类型的癌,更具有侵袭性,生物学特点更接近于IDC,治疗推荐按IDC方式处理。
乳腺导管内癌;乳腺癌;诊断
本文引用: 林晓萌,史建伟, 王健, 等. 78例乳腺导管内癌临床分析[J]. 医学研究与教育, 2015, 32(1): 26-30.
乳腺导管内癌(ductaI carcinoma in situ,DCIS)定义为乳腺导管上皮细胞的恶性增生且局限于导管内的基底膜内,不侵犯间质[1]。DCIS的生长方式呈多样化,不同生长阶段的DCIS具有不同的生物学特征,有的长期保持为原位癌,而有的则不断发展最后演变为浸润性癌。DCIS诊断率不高,主要是缺乏典型的临床特点,DCIS大多肿块较小或没有明显的肿块,影像学表现不典型,临床症状隐匿。也有一部分表现肿瘤体积较大,影像学表现为典型的钙化,临床查体或辅助检查有淋巴结转移的征象,具有典型浸润性导管癌(infiltrating ductal carcinoma,IDC)的临床表现。就河北大学附属医院自2011年至
2013年随机选取的78例DCIS患者及80例IDC患者的临床及病理资料进行回顾性分析,旨在探讨不同肿块大小的DCIS的临床病理特点,对此类疾病的诊疗及发展预测具有一定的指导意义。
1 临床资料
1.1一般资料
DCIS 患者78例,IDC患者80例,均为2011年2月至2013年9月经石蜡病理确诊,并行免疫组化检查。DCIS占同期乳腺癌的10.65%,年龄28~72岁,中位年龄48岁。术前均行钼靶检查,术中冰冻病理证实为DCIS,行前哨淋巴结活检,如证实前哨淋巴结阳性,行腋窝淋巴结清扫。
1.2判断标准
病例中肿块大小采用临床触诊方式取肿物最大径计算。以1.0 cm及3.0 cm为分界点进行统计[2-3]。ER/PR阳性定义为≥1%的肿瘤细胞核染色;ER/PR阴性定义为<1%的肿瘤细胞核染色[4]。而HER-2评定则以Hercep Test评分系统,按照HER-2免疫组化判断的新标准确定(-)和(+),当HER-2为(++)时,进一步行FISH检测来判定。Ki67的判定标准:<14%为低表达定义为(-),>14%为高表达定义为(+)[5]。
1.3统计学处理
应用SPSS13.0统计软件进行分析,资料采用χ2检验或Fishen精确概率法进行检验,多个组间率的比较采用χ2分割法,设检验水平α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1临床特点
DCIS共计78例,肿块≤1.0 cm,40例;1.0~3.0 cm,23例;>3.0 cm,15例。其中乳头溢液者15例,乳头溢液伴有肿块者8例,钼靶检查发现细小钙化者26例,多灶性患者19例,经术中冰冻及石蜡病理共同证实前哨淋巴结活检阳性共4例,伴微浸润患者共13例。通过对比分析(表1),不同肿块大小各组指标对比差异有统计学意义(P<0.05),进一步行χ2分割法证实,肿块≤1.0 cm及1.0~3.0 cm各项指标差异无统计学意义(P>0.05),而2者与>3.0 cm肿块组相比差异有统计学意义(P<0.05),肿块>3.0 cm多表现为微浸润,多灶性比例高以及前哨淋巴结阳性比例高。
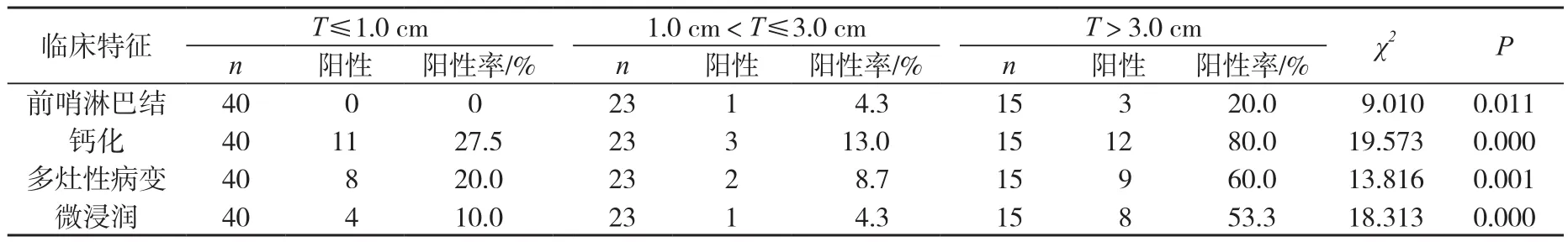
表1 78例患者不同肿块大小的DCIS差异性分析
2.2病理结果
病理学指标中,IDC组ER、PR、Ki67表达率分别为48.8%(39/80)、46.3%(37/80)、52.5%(42/80),高于DCIS组23.1%(18/78)、15.4%(12/78)、25.6%(20/78),差异有统计学意义(P<0.05);而HER-2阳性表达率51.3%(41/80)显著低于DCIS组77%(60/78)(P<0.05),差异有统计学意义(表2)。另外,肿块>3.0 cm的DCIS HER-2、ER、PR、Ki67的阳性表达率为53.3%(8/15)、40%(6/15)、33.3%(5/15)、53.3%(8/15),与IDC相比差异无统计学意义(P>0.05)(表3)。

表2 DCIS与IDC病理结果分析

表3 DCIS(T>3.0 cm)与IDC的病理结果分析
3 讨论
肿块大小目前被认为是乳腺DCIS预后的决定因素之一。Lagios等[4]报道与无肿块的DCIS相比,肿块>1.0 cm的DCIS往往具有高侵袭性特点。Goldhirseh等[5]研究显示,肿块>3.0 cm的DCIS是预后重要的独立危险因子之一。对该类患者诊疗过程中应行前哨淋巴结活检,手术方式建议行改良根治术。本研究以肿块大小1.0 cm和3.0 cm为分界点,进行临床特点的差异性分析,其中肿块≤3.0 cm和>3.0 cm在钙化的典型表现、是否存在微浸润、前哨淋巴结转移及多灶性上具有明显差异。
钙化是DCIS最常见的影像学表现,有资料[6]显示75%的DCIS的影像学表现有钙化灶,10%呈现软组织异常,主要表现为腺体的结构扭曲,有时无明显临床症状的患者仅从钙化的数量和形态可初步诊断为DCIS,DCIS的钼靶多表现为点状或簇状钙化,可局限于某一部位,也可沿导管分布,本临床资料中33.3%(26/78)的DCIS X线摄影片上显示有钙化,低于既往报道,是因为有一部分致密型乳腺与肿块或病灶重影后无明显钙化显示,只表现为密度增高影;也有一部分乳头溢液的患者影像学无明显钙化表现。而肿块>3 cm的患者表现典型钙化率较高,阳性率80%(12/15),与文献报道相近,可能与迅速分解的肿瘤的细胞留下的残余物有关,肿块越大,钙化越明显。
微浸润是指癌细胞突破基底膜,浸润灶不超0.1 cm。Maffuz等[7]一项研究显示,21例肿块直径≥2.5 cm的DCIS,其中有33%(7/21)伴有微浸润;肿块直径为2.5~3.5 cm时,发生微浸润的概率是1/10,3.6~4.5 cm时为2/5,4.6~6.0 cm时为2/3,可以推断,肿瘤越大,发生微浸润的概率越高。本研究显示DCIS伴有微浸润占16.7%(13/78),肿块>3.0 cm占61.5%,与文献报道一致,但≤3.0 cm 2组的DCIS 之间差异无统计学意义,由此可见,大于3.0 cm的肿块发生微浸润的概率明显增高。因伴有微浸润的导管内癌具有不同的病理改变,预后较差,术中冰冻有时难以界定等特点,所以,肿块>3.0 cm时,如果术中冰冻为DCIS,要考虑是否存在伴有微浸润的可能。
理论上,DCIS仅局限于导管的基底膜以内,并不会发生淋巴结转移,但临床中有腋窝淋巴结转移的情况。Sakr的研究显示[8],前哨淋巴结活检可以有效评价DCIS患者腋窝淋巴结转移情况,但总体前哨淋巴结阳性率较低;本研究78例DCIS行前哨淋巴结活检,仅有4例为阳性,占总体5.1%,其中3例为>3.0 cm肿瘤,2例为伴有微浸润患者,术后病理证实其腋窝淋巴结转移阳性。提示阳性率主要取决于肿块大小及是否伴有浸润。当肿块>3.0 cm或有微浸润存在时,前哨淋巴结的阳性率明显增高。术中要警惕前哨淋巴结假阴性的情况,建议直接行腋窝淋巴结清扫。
多灶性是指同一象限内病灶呈多个不连续分布。Yerushalmi等[9]对25 320例乳腺癌患者进行统计分析得出,多灶性的患者占6%(1 554/25 320),DCIS中多灶性患者为11%(460/4 014)。可见,多灶性在DCIS中更为普遍,本研究中,肿块>3 cm的DCIS多灶性病变占60%(9/15),≤1.0 cm阳性率20%(8/40),1.0~3.0 cm阳性率8.7%(2/23),提示肿块>3.0 cm者,多灶性的阳性率高。明显高于肿块较小者,差异有统计学意义。已有研究显示,多灶性或多中心性的乳腺癌,腋窝淋巴结转移率和保乳手术后的局部复发率显著提高[10-11]。对于临床表现肿块>3.0 cm患者多中心病灶比例较高,保乳手术很难达到局部的彻底清除,容易残留病灶而导致局部复发。
ER、PR是判断乳腺癌预后的重要指标,ER、PR阳性提示乳腺癌恶性程度低,对内分泌治疗更敏感,预后较好。理论上来讲,DClS的ER、PR表达阳性率应高于IDC,有文献报道乳腺DCIS中ER及PR表达与IDC相近[12],但杨超等[13]研究结果显示,DClS的 ER阳性率低于IDC患者。具体原因目前尚无定论。在本研究中,DCIS的ER阳性表达率为23.1%(18/78),PR 为15.3% (12/78 )显著低于IDC组,与文献报道相似。但肿块>3.0 cm DCIS与IDC相比,ER、PR水平差异无统计学意义(P>0.05)。提示肿块>3.0 cm DCIS的激素受体表达水平更接近于IDC。在DCIS发展至IDC的过程中,ER、PR表达是否为一个渐变过程,有待进一步研究。
HER-2是一种原癌基因,是neu 基因在人类的同源基因。已被证实与乳腺癌发生发展密切相关,HER-2过度表达提示恶性程度高,复发率高,具有更强的侵袭转移能力,预后差[14]。一般来讲,IDC相对DCIS侵袭性高,预后差,DCIS中HER-2阳性表达应低于IDC[12]。但有文献报道,DCIS中HER-2的过表达率明显高于IDC[15]。本研究结果显示,乳腺DCIS患者的HER-2表达水平(76.9%,60/78)明显高于IDC(51.2%,41/80)。这种相反的差异性表现可能是HER-2阴性的IDC不是由DCIS发展而来,而是由其它途径从不典型增生发展而来,或许是HER-2阴性的DCIS发展为IDC的几率远较HER-2阳性高[16]。而进一步研究显示,肿块>3.0 cm的DCIS与IDC的HER-2表达水平分别为53.3%(8/15),51.3%(41/80),差异无统计学意义。由此推测,DCIS不断进展期间,HER-2表达变化比较复杂,可能呈一个先增高后降低的过程,具体规律目前尚不明确,其发展机制需要进一步研究。
细胞增殖抗原标记物(Ki67)是反映细胞增殖状态的一种蛋白质,它与乳腺癌浸润增殖过程密切相关。Santisteban等[17]研究显示,乳腺癌恶性程度与Ki67表达密切相关,Ki67越高,恶性程度越高。本研究结果显示,IDC Ki67高表达占(42/80)52.5%,肿块>3.0 cm的DCIS,Ki67高表达占(8/15)53.3%,无统计学意义,而DCIS中Ki67高表达占25.6%(20/78),IDC明显高于DCIS(P<0.05),差异有统计学意义。提示肿块>3.0 cm的DCIS预后更差。
一般认为,DCIS的恶性程度低,所以保乳手术机会大,而且腋窝前哨淋巴结阳性率较低,可不行腋窝淋巴结清扫。但通过本研究可以得出,肿块>3.0 cm的DCIS具有不同于DCIS的临床及病理特点,它的侵袭性更高,预后相对较差,因生物学特性更接近于IDC,在工作中,当DCIS的肿块>3.0 cm时,要谨慎对待,治疗原则推荐参照IDC方式处理。
[1] ZUJEWSKI J A, HARLAN L C, MORRELL D M, et al. Ductal carcinoma in situ: trends in treatment over time in the US[J]. Breast Cancer Res Treat, 2011, 127(1): 251-257.
[2] LAGIOS M D, MARGOLIN F R, WESTDAHL P R, et al. Mammagraphically detected duct carcinoma in situ: frequency of local recurrence following tylectomy and prognostic effect of nuclear grade on local recurrence[J]. Cancer, 1989, 63(1): 618-627.
[3] SAKR R, ANTOINE M, BARRANGER E, et al. Value of sentinel lymphnode biopsy in breast ductal carcinoma in situ upstaged to invasive carcinoma[J]. Breast J, 2008, 14(3): 325-328.
[4] 李世超, 齐晓伟. 美国临床肿瘤学会和美国病理学家学会乳腺癌雌激素/孕激素受体免疫组化检测指南[J]. 中华乳腺病杂志: 电子版, 2011, 5(3): 385-387.
[5] GOLDHIRSEH A, WOOD W C, COATES A S, et al. Strategies for subtypes dealing with the diversity of breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011[J]. Ann Oncol, 2011, 22(8): 1736-1747.
[6] 李树玲. 乳腺肿瘤学[M]. 北京: 科学技术文献出版社, 2000: 561.
[7] MAFFUZ A, BARROSE-BRAVO S, NAJERA I, et al. Tumor size as predictor of micminvasion, invasion, and axillary metastasis in ductal carcinoma in situ[J]. Exp Clin Cancer Res, 2006, 25(2): 223-227.
[8] SAKR R, BARRANGER E, ANTOINE M, et al. Ductal carcinoma in situ: value of sentinel lymph node biopsy[J]. Surg Oncol, 2006, 94(5): 426-430.
[9] YERUSHALMI R, KENNECKE H, WOODS R, et al. Does multicentric multifocal breast cancer differ from unifocal breast cancer? An analysis of survival and contralateral breast cancer incidence[J]. Breast cancer Res Treat, 2009, 117(2): 365-370.
[10] COOMBS M, BOYAGES J. Multffocal and multieentrle breast cancer: does each focus matter[J]. J Clin Oncol, 2005, 23(30): 7497-7502.
[11] CHEN A M, MERLE-BEMSTAM F, HUNT K K, et al. Breast conservation after nooacljuvant chemotherapy [J]. Cancer, 2005, 103(4): 689-695.
[12] 李美蓉, 范松青, 张利群, 等. 乳腺癌激素受体和癌基因的表达及临床意义[J]. 中国医师杂志, 2006, 8(1): 34-37.
[13] 杨超, 刘志英, 肖刚, 等. 乳腺导管内癌与浸润性导管癌激素受体表达比较[J]. 山东医药, 2008, 48(25): 114.
[14] HAN K, NOFECH-MOZES S, NAROD S, et al. Expression of HER-2neu in ductal carcinoma in situ is associated with local recurrence[J]. Clin Oncol: R Coll Radi0l, 2012, 24(3): 183-189.
[15] 钱秀珍, 钱永坤. 乳腺导管原位癌与浸润性导管癌激素受体及 HER-2 表达的比较[J/CD]. 中华乳腺病杂志, 2013, 7(2): 97-101.
[16] 新杰, 周文斌, 周冬仙, 等. C-erbB-2, ER 及 PR 表达在乳腺导管内癌与浸润性导管癌的对照研究[J]. 中国普通外科杂志, 2008, 17(12): 1226-1228.
[17] SANTISTEBAN M, REYNOLDS C, BARR FRITCHER E G, et al. Ki67: a timevarying biomarker of risk of breast cancer in atypical hyperplasia[J]. Breast Callcer Res Treat, 2010, 121(2): 431-437.
(责任编辑:高艳华)
Ductal carcinoma in situ of the breast (Report of 78 cases)
LIN Xiaomeng1, SHI Jianwei2, WANG Jian1, LI Zhong2
(1. Hebei University, Baoding 071000, China; 2. Department of Oncology, Affiliated Hospital of Hebei University, Baoding 071000, China)
Objective To explore the clinical and pathological characteristics of ductal carcinoma in situ (DCIS) with tumor size examination. Methods We retrospectively analyzed 78 DCIS cases in Affiliated Hospital of Hebei University from Feb. 2011 to Sep. 2013. A comparative analysis was conducted with the cut-off points of 1.0 cm and 3.0 cm tumor size. Results When tumor size≤1.0 cm and tumor size between 1.0-3.0 cm, the clinical characteristics had no significant difference, when tumor size>3.0 cm, the characteristics were significantly different from the above two (P<0.05) shown as micro infiltration, high multifocal proportion, and high sentinel lymph node positive rate. The variance analysis of pathological indicators of DCIS and IDC showed that the positive expression of ER, PR, Ki67 was relatively low, while the positive expression of HER-2 was relatively high (P<0.05), this difference was significant. When tumor size >3 cm, all the indicators had no significant difference. Conclusion When tumor size>3.0 cm, the DCIS is more aggressive and its biology characteristics are similarly to IDC. The IDC treatment is recommended.
DCIS; breast cancer; diagnosis
10.3969/j.issn.1674-490X.2015.01.006
R737.9
A
1674-490X(2015)01-0026-05
2014-12-23
林晓萌(1981—),男,河北保定人,主治医师,在读硕士。 E-mail: lxmdf@163.com
李中(1965—),男,河北徐水人,教授,硕士生导师,主要从事乳腺、胃肠及甲状腺方面的外科研究。E-mail: lizhong1965@sina.com
