二氮嗪后处理对离体大鼠心功能及线粒体心磷脂的影响*
2015-09-18段忠心刘兴奎喻田遵义医学院麻醉系贵州遵义563003南华大学附属第二医院麻醉科湖南衡阳400
段忠心,刘兴奎,喻田(遵义医学院麻醉系,贵州遵义563003;南华大学附属第二医院麻醉科,湖南衡阳400)
二氮嗪后处理对离体大鼠心功能及线粒体心磷脂的影响*
段忠心1,2,刘兴奎1△,喻田1
(1遵义医学院麻醉系,贵州遵义563003;2南华大学附属第二医院麻醉科,湖南衡阳421001)
目的:建立离体大鼠心肌缺血/再灌注损伤模型,观察二氮嗪(diazoxide,D)后处理对缺血/再灌注损伤离体大鼠心功能及线粒体心磷脂的影响,并探讨ATP敏感性钾通道在二氮嗪后处理心肌保护中的作用。方法:采用Langendorff装置建立离体大鼠心肌缺血/再灌注损伤模型,将SD大鼠随机分为对照组(control)、缺血再灌注模型组(I/R)、二氮嗪后处理组(I/R+D)、5-羟葵酸拮抗二氮嗪后处理组(I/R+5-HD+D),每组8只,均先灌注平衡20 min。Control组:灌注平衡后续灌70 min;I/R组:缺血前灌注4℃ST.Thomas停跳液,全心缺血40 min,再灌30min;I/R+D组:全心缺血40min,缺血后给予含二氮嗪(50μmol/L)的K-H液灌注5min后,再灌25min;I/R +5-HD+D组:二氮嗪后处理前给予含5-羟葵酸(100μmol/L)的K-H液灌注5 min,再灌20 min。观察各组续(再)灌注末心率、冠脉流出液量、心功能、心肌酶学及心肌线粒体心磷脂的变化。结果:各组续(再)灌注末比较,I/R组较control组及I/R+D组心率减慢、冠脉流出液量降低,心功能明显受损,心肌酶增加,心磷酯含量减少,但与I/R+5-HD+D无明显差异。结论:二氮嗪后处理通过增加线粒体心磷脂含量,减少心肌酶的释放,改善心脏功能,减轻心肌的再灌注损伤,产生心肌保护作用。5-羟葵酸能够完全阻断二氮嗪的心肌保护作用。
心磷脂;二氮嗪;缺血/再灌注损伤
[ABSTRACT]AIM:To investigate the effect of diazoxide(D)postconditioning on Cardiac function and mitochondrial cardiolipin in isolated rat heart and to explore the protective effect of ATP sensitive potassium channel on diazoxide postconditioningmyocardium.METHODS:The myocardial ischemia/reperfusion injury model in isolated rat hearts was established by Langendorff apparatus.The isolated rat hearts were randomized into 4 groups(n=8):control group (control),myocardial ischemia/reperfusion injury group(I/R),diazoxide postconditioning group(I/R+D),5-hydroxy decanoic acid(5-HD)plus diazoxide postconditioning group(I/R+5-HD+D).The hearts in each group were started with 20min perfusion for equilibration.The hearts in controlgroup perfused for70min;The hearts in I/R group was global ischemia for 40min after ischemia reperfusion at4℃ST.Thomas cardioplegia,then reperfusion for30min;The hearts in I/R+D group were treated with diazoxide(50μmol/L)in K-H perfusion for5 min after global ischemia for40 min,then reperfusion for 25 min;The hearts in I/R+5-HD+D group were treated with 5-HD(100μmol/L)in K-H perfusion for 5 min before diazoxide postconditioning,then reperfusion for 20 min.The heart rate,coronary outflow volume,heart function,myocardial enzymes and myocardialmitochondrial cardiolipin at the end of perfusion in each group were determined.RESULTS:Compared with control group and I/R+D group,the heart rate,the concentration of heart phospholipid and the coronary outflow volume were reduced,the heart function was significantly impaired the contents ofmyocardial enzymes were increased in I/R group.However,no significant difference between I/R group and I/R+5-HD+D group was ob-served.CONCLUSION:The diazoxide postconditioning protects the myocardium by increasing mitochondrial cardiolipin content,reducing the release ofmyocardial enzymes,improving heart function and reducingmyocardial reperfusion injury.Themyocardial protective effect of diazoxide is completely blocked by 5-hydroxy decanoic acid.
[KEY WORDS]Cardiolipin;Diazoxide;Ischemia/reperfusion injury
心肌线粒体内膜富含磷脂,作为膜磷脂双层分子的基本结构之一,心肌缺血/再灌注损伤(ischemia reperfusion injury,IRI)时含量明显减少,与心脏IRI有着密切的联系。Zhao等[1]在研究中发现并首先提出了缺血后处理(ischemic post-conditioning,IPO)可明显减轻IRI。本实验室的前期研究[2]表明,IPO通过激活线粒体ATP敏感性钾通道(mitoKATP)通道来保护心肌线粒体,从而产生心肌保护。随后有大量研究证实IRI与mitoKATP有关[3]。本实验进一步观察二氮嗪(diazoxide,D)后处理对离体大鼠IRI线粒体心磷脂(cardiolipin,CL)的影响,探讨二氮嗪后处理对心肌的保护机制。
材料和方法
1动物与实验材料
健康清洁级雄性SD大鼠32只,16~20周龄,体重250~350 g,由第三军医大学大坪医院实验动物中心提供。随机分为4组:对照组(control)、缺血再灌注模型组(I/R)、二氮嗪后处理组(I/R+D)、5-羟基癸酸(5-hydroxydecanoic acid,5-HD)拮抗二氮嗪后处理组(I/R+5-HD+D)。
二氮嗪、CL及5-HD(Sigma);Bradford蛋白浓度测定试剂盒(碧云天生物技术研究所);肌酸激酶(creatine kinase,CK)试剂盒及乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(南京建成生物技术研究所)。Langendorff离体心脏灌注装置(PanLab);Powerlab/8SP实验数据采集系统(AD Instrument);内切式高速均质器(IKA);HP-1100系列高效色谱分析仪(Agilent);色谱柱(编号C18B081203,中科院大连化物所)。其余试剂为国产分析纯和色谱纯。
2方法
2.1离体大鼠心脏模型的建立腹腔注射戊巴比妥钠(40 mg/kg)、肝素(250 U/kg),麻醉后迅速剑突下沿着肋缘剪开腹壁,打开膈肌,沿着两侧腋前线剪开胸壁并上翻头侧,保留主动脉3~4 mm于心脏根部剪下心脏,立即放入预冷的K-H液(4℃),轻轻挤压心脏洗清残留血液。液面下主动脉插管,固定置于Langendorff灌注管口。用37℃预先氧平衡的KH液心脏逆行灌注(灌注压力75~85 mmHg),心脏跳动后于左心耳剪一小口,将带有乳胶水囊的测压管经二尖瓣插入左心室,连接Powerlab/8SP生物机能试验压力换能器系统,调节水囊使LVEDP为4~8 mmHg。上述步骤均在2 min内完成。离体心脏用37℃的K-H液平衡灌注20 min,平衡后心率(heart rate,HR)>250 min-1、左室收缩压(left ventricular systolic pressure,LVSP)>85 mmHg、室性早搏<2 min-1者纳入实验,未达条件者舍弃。
2.2灌注方案Control组平衡20 min后,续灌70 min;I/R组平衡20 min,灌注4℃ST.Thomas停跳液10 mL/kg,常温下停跳后中断灌注40 min,再次灌注37℃含氧的K-H液30 min;I/R+D组于缺血后主动脉分别逆灌含二氮嗪(50μmol/L)的K-H液5 min、37℃含氧的K-H液25 min;I/R+5-HD+D组于缺血后主动脉分别逆灌含5-HD(100μmol/L)的K-H液持续5 min、含二氮嗪(50μmol/L)的K-H液5 min,再灌注37℃的K-H液20 min。
2.3心脏功能数据采集于续灌末或再灌注末采集心脏功能参数。记录HR、左心室舒张末压(left ventricular end diastolic pressure,LVEDP)及左心室最高收缩压(left ventricular peak systolic pressure,LVPSP),计算左室发展压(left ventricular developed pressure,LVDP)=LVPSP-LVEDP。
2.4冠脉流出液量及心肌酶学检测标本的收集
各组予量筒收集并测量冠脉流出液量(coronary flow,CF),留冠脉流出液2 mL,用于LDH及CK的检测,具体方法按试剂盒说明进行。
2.5心肌线粒体提取参照文献[3]方法,适当修改。各灌注终点取心脏后,立即将心脏在4℃线粒体分离液(10 mL/g心肌组织)中剪碎,内切式高速均质器匀浆(破碎头8G,设置6,时间5 s),600×g离心10 min,取上清液,3 600×g离心15 min取沉淀,取等量分离液将沉淀重新分散悬浮,1 000×g离心5 min,取上清液,5 500×g离心10 min,取沉淀,再次分散于适量分离液中。线粒体蛋白定量方法,参照Bradford蛋白浓度测定试剂盒说明书,用酶标仪测定A595,根据标准曲线计算出样品中的蛋白浓度。
2.6心肌线粒体总磷脂的提取参照Bligh等[4]方法,线粒体悬液按1∶(V/V)的比例加心磷脂提取液,混匀,静置20 min,1 000×g离心3 min(4℃),取下层,加1/5体积0.05 mol/L的氯化钙旋转混匀,静置1 min,1 000×g离心10min,取下层氯仿相,在40℃的水浴箱中用氮气吹至溶剂挥发殆尽,准确加入磷脂稀释液0.1 mL,密闭、避光、液氮-80℃储存待行高效液相色谱分析。除40℃的水浴箱外,其余过程均在0~4℃冰浴中进行,同时尽可能避光和隔绝空气。线粒体CL含量测定参照Lesnefsky等[5]液相色谱法进行定性及定量:色谱系统为Agilent 1100系列高效液相色谱分析化学工作站(G1312A二元泵,G1313A自动进样器,G1316A管柱控温箱,G1315A二极管阵列检测器);色谱柱为不锈钢正相柱(Lichrosorb si60,5μm,4.6mm×250mm,中科院大连化物所,色谱柱编号C18B081203);淋洗条件为流动相流速1 mL/min,柱温30℃,DAD检测器,检测波长206 nm,参考波长360 nm。定性分析用内标法,并以CL标准品在相同条件下的保留时间确定;定量分析以峰面积积分值记录,用峰面积积分值转换为CL量与线粒体蛋白含量之比表示CL含量(mg/g)。
3统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 17.0软件进行单因素方差分析,以P<0.05为差异有统计学意义。
结果
1HR及CF的变化
I/R组较control组和I/R+D组HR减慢,CF降低(P<0.01),但与I/R+5-HD+D组无明显差异,I/R+D组较control组的HR减慢,CF降低(P<0.01);I/R组心功能明显低于control组和I/R+D组(P<0.01),但与I/R+5-HD+D组无明显差异,control组的心功能优于I/R+D组(P<0.01),见表1。

表1 各组离体大鼠心脏HR、CF、LVEDP和LVDP的变化Table 1.The changes of the HR,CF,LVEDP and LVDP in the isolated rat heartswith different treatments(Mean±SD.n=8)
2心肌酶及心肌线粒体CL含量的变化
I/R组的心肌酶含量高于control组和I/R+D组(P<0.01),但与I/R+5-HD+D组无明显差异,control组的心肌酶低于I/R+D组(P<0.01);I/R组的CL含量低于control组和I/R+D组(P<0.01),但与I/R+5-HD+D组无明显差异,control组的CL含量高于I/R+D组(P<0.01),见表2。

表2 各组离体大鼠心脏LDH、CK和心肌线粒体CL的变化Table 2.The changes of LDH,CK and CL in isolated rat hearts with different treatments(Mean±SD.n=8)
3高效液相色谱结果
在0.31μg~40μg线性良好,回归方程为CL (μg)=0.003582×峰面积-0.7280(r=0.988);标准品最低检测质量为0.15625μg(S/N≥3);日内及日间变异均<7%,回收率>69%,回收率及精密度见表3;溶剂色谱图、CL标准品色谱图及心肌线粒体磷脂色谱图见图1。

表3 CL高、中、低浓度的回收率和精密度Table 3.The recovery rate and precision of CL detected at high,moderate and light concentrations(Mean±SD.n=8)
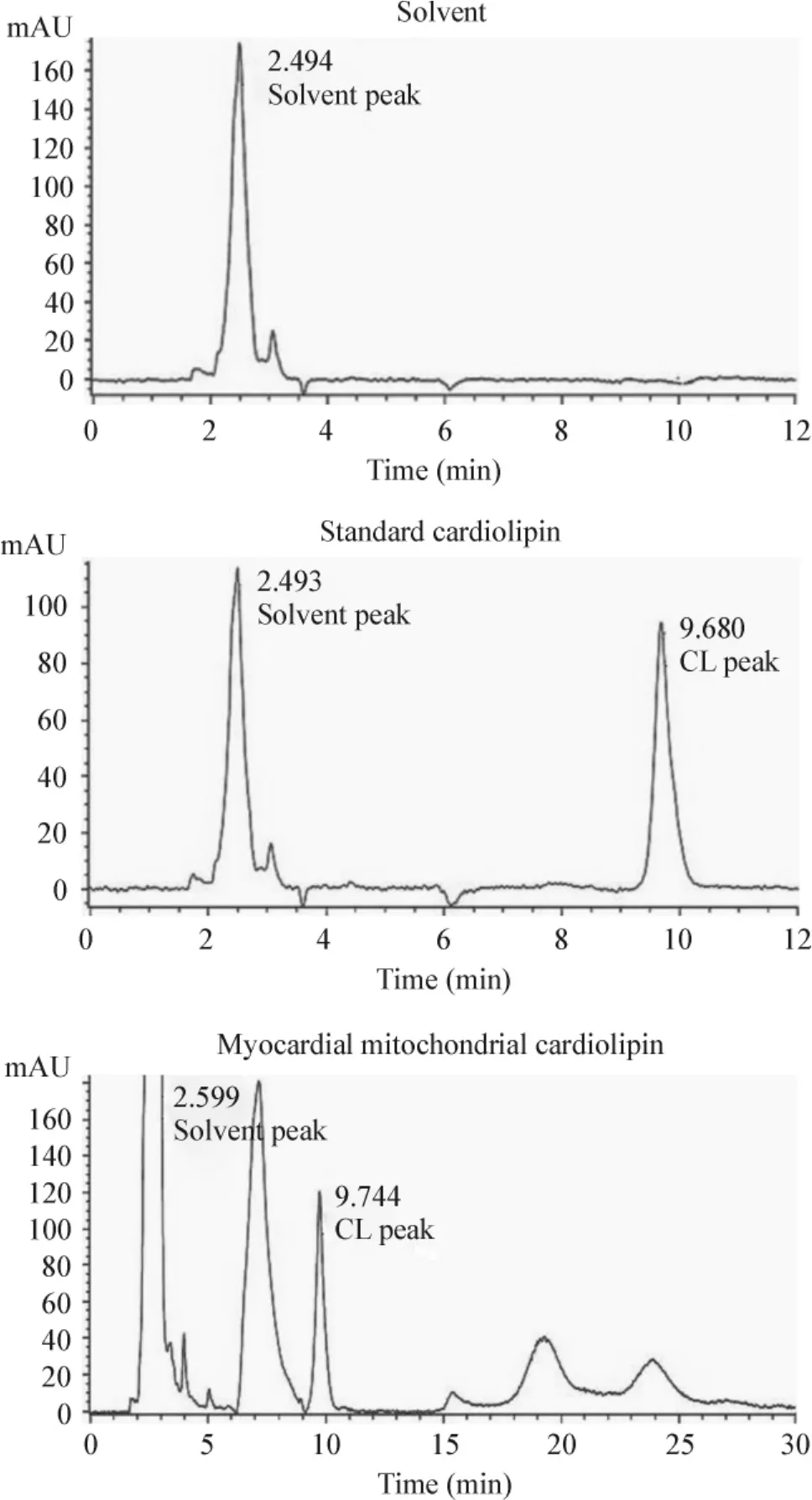
Figure 1.The chromatogram ofmyocardialmitochondrial cardiolipin.图1 心肌线粒体CL的色谱图
讨论
无论何种原因引起的心肌细胞损伤都会引起心肌酶不同程度的升高,心肌酶对于评价心肌损伤具有一定的敏感性和特异性。LDH是观测缺血再灌注损伤的重要指标;CK是目前临床上应用最为广泛的心肌损伤标记物。本研究观察冠脉流出液LDH及CK来判断心肌损伤。HR、CF、LVDP及LVEDP的变化可直接反映心肌的损伤及收缩能力。本实验结果表明二氮嗪后处理可显著改善缺血心肌的收缩和舒张功能,使心输出量增加,左室内压升高,LVEDP下降,从而有效减轻IRI,减少心肌酶的释放,产生心肌保护作用。5-HD能够完全阻断二氮嗪后处理对IRI的心脏保护功能。
线粒体膜是维持线粒体整体性与内外环境衡定的主要结构,是维护线粒体的电子传递、能量代谢及膜完整性必不可少的成分,其含量的降低影响内膜蛋白(阴离子转运蛋白及呼吸链复合体)的功能,导致能量合成障碍,严重者导致心肌细胞死亡或凋亡。CL位于线粒体内膜,是线粒体内膜的特征性磷脂,紧密结合并支撑着线粒体呼吸链氧化酶及其它某些线粒体蛋白发挥功能,并与线粒体呼吸功能及活性氧簇(reactive oxygen species,ROS)关系密切[6],CL减少导致活性氧生成增多,线粒体膜电位降低,导致细胞的凋亡[7]。IRI可使CL、卵磷脂、脑磷脂含量下降,以CL下降最明显。Petrosillo等[8]认为CL为复合体Ⅲ提供反应界面,补充外源性CL则复合体Ⅲ的功能几乎可以完全恢复,但是补充其它磷脂则不能恢复,表明只有保护CL才能维持呼吸链酶活性。近来研究发现,心肌IRI后线粒体呼吸功能受到抑制,电子传递受阻,ROS产生增加,而CL对ROS的攻击特别敏感,ROS攻击CL使复合体Ⅲ活性降低,电子漏增加,产生更多的ROS,导致线粒体CL含量下降,这种恶性循环最终导致细胞功能完全损害。细胞色素C(cytochrome C,Cyt C)存在于膜间隙,它与CL通过非离子与线粒体的内膜结合,CL含量下降会导致Cyt C与内膜亲和力下降,促进Cyt C释放到胞质[9],Cyt C漏出线粒体将使线粒体消除ROS的功能丧失,从而导致凋亡的发生。同时,脂质过氧化的中间产物还可使膜内蛋白质发生链式聚合作用,造成膜蛋白分子内和分子间交换,引起与CL密切相关的Cyt C氧化酶和三磷酸腺苷合成酶的活性降低,从而导致氧化磷酸化功能受损,细胞因能量供应障碍而死亡[10]。
本研究结果显示,二氮嗪后处理能够增加灌注末线粒体CL含量,保护和维持线粒体结构和功能的完整性而产生心肌保护作用。5-HD能够阻断二氮嗪后处理这一作用。其机制可能是增加CL含量,抑制3态呼吸活动、减少呼吸控制比率和磷氧比,4态呼吸活动的增加及抑制膜流动性的降低,使损伤呼吸链的氧化磷酸化偶联减轻[11],减轻心肌线粒体氧化损伤,保护心肌线粒体,从而保护心肌。
[1]Zhao Z,Corvera J,Halkos M,etal.Inhibition ofmyocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning[J].Am J Physiol Heart Circ Physiol,2003,285(2):H579-H588.
[2]刘兴奎,段忠心,喻田.缺血后处理对离体大鼠心肌线粒体功能的影响[J].中国病理生理杂志,2011,27 (02):229-233.
[3]Jin C,Wu J,Watanabe M,etal.Mitochondrial K+channels are involved in ischemic postconditioning in rat hearts[J].JPhysiol Sci,2012,62(4):325-332.
[4]Bligh TG,Dyer WJ.A rapid method of total lipid extraction and purification[J].Can J Biochem Physiol,1959,37(8):911-917.
[5]Lesnefsky E,Stoll M,Minkler P,et al.Separation and quantitation of phospholipids and lysophospholipids by high-performance liquid chromatography[J].Anal Biochem,2000,285(2):246-254.
[6]Kagan V,Bayir H,Belikova N,etal.Cytochrome C/cardiolipin relations in mitochondria:a kiss of death[J].Free Radic Biol Med,2009,46(11):1439-1453.
[7]Huang L,Mathew B,Li H,et al.Themitochondrial cardiolipin remodeling enzyme lysocardiolipin acyltransferase (LYCAT)is a novel target in pulmonary fibrosis[J].Am JRespir Crit Care Med,2014,189(11):1402-1415.
[8]Petrosillo G,Ruggiero FM,Di Venosa N,et al.Decreased complex activity in mitochondria isolated from rat heart subjected to ischemia and reperfusion:role of reactive oxygen species and cardiopin[J].FASEB J,2003,17(6):714-716.
[9]Lord CE,Gunawardena AH.Programmed cell death in elegans,mammals and plants[J].Eur JCell Biol,2012,91(8):603-613.
[10]Liu S,Soong Y,Seshan SV,etal.Novel cardiolipin therapeutic protects endothelial mitochondria during renal ischemia and mitigatesmicrovascular rarefaction,inflammation,and fibrosis[J].Am JPhysiol Renal Physiol,2014,306(9):F970-F980.
[11]Xu P,Yao Y,Guo P,etal.Curcumin protects ratheart mitochondria against anoxia reoxygenation induced oxidative injury[J].Can JPhysiol Pharmacol,2013,91(9): 715-723.
Effect of diazoxide postconditioning on cardiac function and m itochondrial cardiolipin in isolated rat heart
DUAN Zhong-xin1,2,LIU Xing-kui1,YU Tian1
(1Department of Anesthesiology,ZunyiMedical College,Zunyi563003,China;2Departmentof Anesthesiology,The Second Affiliated Hospital,University of South China,Hengyang 421001,China.E-mail:xkliu@zmc.edu.cn)
R363
A
10.3969/j.issn.1000-4718.2015.05.008
1000-4718(2015)05-0812-05
2014-07-23
2015-03-03
国家自然科学基金资助项目(No.30740044);贵州省科技基金资助项目[(2007)2121号]
Tel:0852-8608567;E-mail:xkliu@zmc.edu.cn
