豚草提取物脲醛树脂微胶囊制备与表征
2015-09-17张欣倩
包 颖,赵 杨,张欣倩
(1.吉林省林业技术推广站,吉林 长春 130022;2.淄博市野生动植物保护站,山东 淄博 255095;3.淄博市林业科学研究所,山东 淄博 255000)
豚草(Ambrosia artemisiifolia L)属菊科(Asteraceae)豚草属(Ambrosia)有花植物,有长豚草和短豚草之分,是全球性公害植物。能够使人引起过敏反应的主要为短豚草花粉。短豚草属1a 生草本植物,因其高传播率而遍布北美、加拿大及欧洲大部分地区,在北美地区发现了广泛分布的17 个种[1]。豚草已广泛分布于我国东北、华北、华中和华东等地近20 个省(市)[2],是我国重点防治的外来有害生物之一。许多研究者对豚草的综合防治进行研究,但近些年研究结果发现豚草提取物具有一定的杀虫效果。N.A.El-Ela 等人的研究发现,沿海豚草粗提取物中含有具杀虫作用效果的物质,并检测到其对1 ~3 龄尖音库蚊有一定杀虫效力[3]。L.M.Abou Basha 等人的研究结果表明,使用一定质量浓度的沿海豚草提取物会对椎实螺蜗牛产生致死作用[4]。P. H. Wang 等人从豚草地上部分分离出三种倍半萜烯内酯,试验表明均具有能够杀死软体动物的活性[5,6]。目前为止已有的研究结果证实,豚草可以作为低毒植物源杀虫剂使用,且安全性要高于化学农药[7]。然而植物源杀虫剂在使用过程中极易受温度、光照等外界条件影响失去生物活性,从而降低药效。微胶囊剂是新型的环境友好型剂型,能够缓慢释放、延长药效。以水取代二甲苯作为助剂,使毒副作用降低[8]。作者以豚草提取物为囊芯物质,以脲醛树脂为囊壁材料,采用原位聚合法制备豚草提取物脲醛树脂微胶囊,并对制得的微胶囊剂进行性能表征,旨在为其推广应用提供基础数据,并为进一步研制高效、低毒、安全的植物源微胶囊剂提供参考。
1 试验材料、试剂和仪器
材料:豚草提取物(自制)[6~9],尿素(分析纯,国药集团化学试剂有限公司)。
试剂:甲醛(质量分数30.03%,分析纯)、丙酮(质量分数58.08%,分析纯)、Tween-80(质量分数74.92%,分析纯,AMRESCO)、戊二醛(质量分数100.12%,分析纯)、冰乙酸(质量分数60.05%,分析纯)、氢氧化钠(质量分数40%,分析纯)、乙醇(质量分数95%,分析纯)、去离子水。以上试剂除Tween-80 外均为国药集团化学试剂有限公司产品。
仪器:高速粉碎机(RT-12),超声波清洗机(FRQ-1004HT),平行蒸发仪(V-700),磁力搅拌器(SZCL-A),高速离心机(D-37520),冷冻干燥机(LL3000),电子显微镜(OLYMPUS BX51TF),电子扫描显微镜(QUANTA200),紫外分光光度计(CARY 100),激光粒度分析仪(BT-9300H)[6~9]。
2 试验方法
2.1 豚草提取物脲醛树脂微胶囊悬浮液的制备
称取一定质量尿素和甲醛溶液于烧杯中,使用质量分数为1%氢氧化钠溶液调节pH 至8 ~9,在搅拌速度200 r·min-1、70℃条件下反应1h,制得脲醛树脂预聚体。
称取一定质量豚草提取物活性物质,与乙醇溶液(质量分数80%)1∶10 体积比混合;加入一定质量Tween-80(质量分数20%),置于磁力搅拌器进行搅拌,搅拌速度控制在低速400 ~600 r·min-1之间,制成豚草提取物悬浮液。将已制好的脲醛树脂预聚体缓慢倒入豚草提取物悬浮液中,边倒边搅拌,同时将温度缓慢升至45℃恒温;使用冰乙酸(质量分数10%)调节体系pH 至2 以下,继续搅拌进行一段时间乳化反应;加入一定质量去离子水,再继续反应一段时间后,加入固化剂戊二醛溶液1 mL 并调节体系pH 值至8 ~9;同时对溶液进行缓慢降温处理,固化1 h 后,取出微胶囊溶液进行离心,设置转速3 000 r·min-1,离心10 min;离心结束后取出上清液,用去离子水将离心管下方沉淀洗涤并抽滤;将最后得到的微胶囊置于冷冻干燥机内干燥,干燥完成后的物质为豚草提取物微胶囊粉末,置于室温下保存即可[10,11]。
2.2 豚草提取物脲醛树脂微胶囊的包封率
取一定质量的豚草提取物质分别配制成5个质量浓度的溶液,使用乙醇溶液作为空白对照,利用紫外分光光度计在660 nm 波长条件下测其吸光度A,以A 对质量浓度C 进行线性回归处理,得出标准曲线方程。将制备完成的微胶囊悬浮液离心后,取其上清液1 mL 稀释(上清液里含有游离的未被包覆的豚草提取物);取适量稀释液于比色皿中,置于紫外分光光度计进行测定,重复3 次;使用紫外分光光度计测定其在660 nm 处的吸光度A,根据得出的标准曲线方程计算出未被包覆的豚草提取物的含量,然合计算出包封率。
微胶囊的包封率(A.E.)计算公式如下:

式中:W1—芯材总量;
W2—微胶囊表面未被包覆的芯材总量[6 ~9]。
2.3 豚草提取物脲醛树脂微胶囊正交试验
豚草提取物脲醛树脂微胶囊制备过程中,首先采用原位聚合法制得脲醛树脂预聚体,其次制成豚草提取物脲醛树脂微胶囊悬浮液,此制备工艺中,尿素与甲醛质量比、芯壁比、酸化时间和乳化时间等条件都会对微胶囊的形态及性能产生影响。因此,本试验利用软件设计L9(34)正交试验(见表1),筛选出最优化的配 比方案,并检验每个因素对于成囊的影响大小。

表1 豚草提取物脲醛树脂微胶囊正交试验设计Tab.1 The orthogonal experimental design of Ambrosia artemisiifolia extractive urea resin microcapsule

表2 豚草提取物脲醛树脂微胶囊正交试验结果Tab.2 The orthogonal experimental result of Ambrosia artemisiifolia extractive urea resin microcapsule
2.4 豚草提取物脲醛树脂微胶囊形态特征
取制备好的豚草提取物脲醛树脂微胶囊悬浮液少许,置于载玻片上,在电子显微镜下观察,并用电脑拍下照片。将制备完成的微胶囊剂经干燥处理成为粉末状后,首先取少量粉末,均匀地平铺于直径为1 cm 观察台上,样品薄薄一层即可,切不可过多过厚,否则影响观察效果;再次进行喷金处理,掌握好处理时间;最后将处理后的样品缓慢置于扫描电子显微镜里,通过电脑观察豚草提取物微胶囊外部形态特征并拍下照片。
2.5 豚草提取物脲醛树脂微胶囊粒径分布
利用激光粒度分布仪测定粒径分布,将制好的微胶囊悬浮液搅拌均匀后,加水稀释,取适量倒入充满水的反应器里,先进行超声处理,同时观察浓度变化,待体系稳定后继续加样品,达到稳定状态时开始测定数据。得到粒径分布曲线、中位径及粒径分布区间。
2.6 豚草提取物微胶囊的缓释试验
分别取一定质量豚草提取物和制备好的豚草提取物微胶囊剂,将两种样品分别放入透析袋里,将两个装有样品透析袋分别置于盛有有机溶剂乙醇的烧杯里,封口。每天从两个装有样品透析袋的烧杯里取适量溶液,并同时注入等量乙醇有机溶剂,来维持整个体系体积。将每天取出的溶液置于紫外分光光度仪,在660 nm波长条件下测其吸光度A,利用标准曲线方程计算出样品每天的释放量,连续测定21 d,最后绘制释放曲线,将二者试验结果做比较分析。
3 结果与分析
3.1 豚草提取物脲醛树脂微胶囊正交试验
豚草提取物脲醛树脂微胶囊正交试验结果见表2。
从表2 中可以看出,制备豚草提取物脲醛树脂微胶囊最优配比方案为A3B3C1D2,即尿素与甲醛质量比1∶2.5,芯壁比1∶2,酸化时间1 h,乳化时间80 min。四因素中对成囊影响由大到小排列顺序为尿素与甲醛质量比>酸化时间>芯壁比>乳化时间。
3.2 豚草提取物脲醛树脂微胶囊形态特征
豚草提取物脲醛树脂微胶囊外部形态特征如图1、图2 所示。

图1 光学显微镜成像Fig.1 Optical microscope imagery

图2 扫描电子显微镜成像Fig.2 Scanning electron microscope imagery
从图1、图2 中可以看出,微胶囊大小基本一致、形状规则、排列整齐、表面光滑、无多余杂质、包覆完全。微胶囊外部形态不规则、不饱满,壁材所占比例会变大,既造成壁材和芯材的浪费,也会影响成囊大小和包封率,微胶囊成囊的形状是否规则直接影响微胶囊的性能和效果,进而影响药效。过多杂质出现说明微胶囊制备过程中体系不稳定,原位聚合试验中没有更好地完成聚合反应,或是离心过程中没有将杂质完全去除。杂质出现时应考虑改变反应条件,使聚合反应充分,尽量减少杂质形成。
3.3 豚草提取物脲醛树脂微胶囊粒径分布
豚草提取物脲醛树脂微胶囊粒径分布如图3 所示。

图3 豚草提取物脲醛树脂微胶囊粒径分布Fig.3 The particle size distribution of Ambrosia artemisiifolia extractive urea resin microcapsule
从图3 中可以看出,粒径分布集中,有极少的大粒径微胶囊出现。中位径为18.56 μm,大部分粒径分布在19.34 ~32.09 μm 之间。粒径分布检测是评价微胶囊制备是否成功的一个重要指标,粒径不宜过大也不宜过小,过大不利于微胶囊药物的缓释作用,也会造成试验材料的浪费;过小会影响微胶囊的包封率,也会形成杂质,同时也会使体系不稳定,十到几十微米的粒径大小均符合微胶囊成囊最佳粒度,本试验制备的豚草提取物脲醛树脂微胶囊绝大部分均符合要求[12],另外,极小与极大颗粒均占很少部分,说明本试验制备过程中原位聚合反应完全,壁材和芯材充分利用,杂质极少出现。
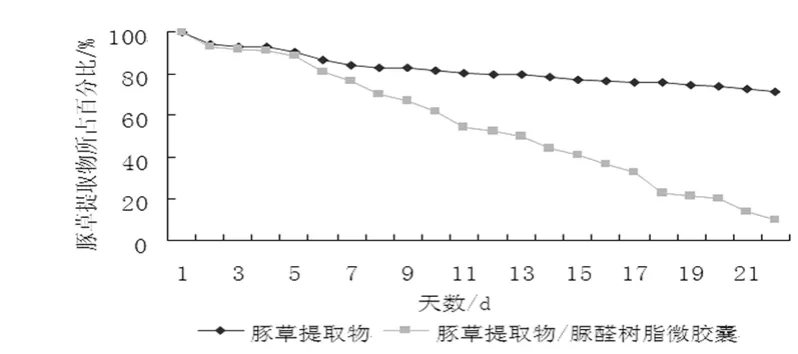
图4 豚草提取物与豚草提取物脲醛树脂微胶囊缓释试验结果Fig.4 The controlled-release experiment result of Ambrosia artemisiifolia extractive and Ambrosia artemisiifolia extractive urea resin microcapsule
3.4 豚草提取物微胶囊的缓释试验
从图4 中可以看出,豚草提取物的释放速度较快,试验期间样品的质量不断下降,而豚草提取物脲醛树脂微胶囊释放速度缓慢,试验结束后失重约28%,而豚草提取物失重高达89%。由此可以看出,豚草提取物与豚草提取物脲醛树脂微胶囊开始时缓放速率均较快,但随时间延长,豚草提取物释放速率变快,极易降解、流失,而豚草提取物脲醛树脂微胶囊由于有囊皮材料的保护起到缓慢释放作用,这样能够使药效更持久,可以免受外界环境的影响而失活。
一般来说,药剂从微胶囊中释放出来都符合封闭—渗透释放机理,即农药通过渗透或扩散作用穿过聚合物膜,然后从表面解吸进入外部环境,释放速度受扩散控制,如果胶囊内药剂的热力学性质保持稳定,则农药的释放速度由Fick,s 的第一定律得出[13]。

式中:Jt—释放速度;
A—微胶囊的外表面积;
h—胶囊壁厚;
D—药在聚合物中的扩散系数;
△C—胶囊壁内外表面上农药的浓
度差。
对某一特定的微胶囊,A,h,D 均一定,当扩散达到平衡时,△C 为定值,所以Jt也一定,即释放速度为常数[12],即图4 中豚草提取物脲醛树脂微胶囊应形成直线,本试验中豚草提取物脲醛树脂微胶囊缓释曲线虽然很平缓,但未达到直线水平,没有完全符合微胶囊农药释放机理,今后研究中应致力于如何改变成囊条件来完善微胶囊剂的缓释性能及探求影响微胶囊剂缓释性的因素,
4 结论与讨论
试验以豚草提取物为囊芯物质,脲醛树脂为囊壁材料,采用原位聚合法制备豚草提取物脲醛树脂微胶囊,通过正交试验得到豚草提取物脲醛树脂微胶囊最优配比方案为尿素与甲醛质量比1∶2.5,芯壁比1∶2,酸化时间1 h,乳化时间80 min。其中,四因素对成囊影响由大到小排列顺序为尿素与甲醛质量比>酸化时间>芯壁比>乳化时间。从光学显微镜及扫描电子显微镜成像显示微胶囊形状规则、表面光滑、无杂质、包覆完全。微胶囊中位径为18.56 μm,大 部 分 粒 径 分 布 在 19. 34 ~32.09 μm之间。从豚草提取物与豚草提取物脲醛树脂微胶囊缓释试验结果可以看出,制得的微胶囊剂缓释效果优于豚草提取物。
目前,国内外对于脲醛树脂微胶囊制备涉及化学、物理、医学、生物、农药等方面,如Y.T.Wang 和H. L.Guo 等人利用脲醛树脂将一种电子墨水制备成微胶囊剂应用于化学领域[14,15],H. Guo 等人利于原位聚合法,以脲醛树脂为材料制备对电场有悬浮体反应的功能性微胶囊综合体[16],R. Gong 等人利用脲醛树脂磁性微球和二氧化硅微球,用于提取人类DNA基因组[17],张大侠制备脲醛树脂微胶囊应用于农药研制[18],韩志任等人制备阿维菌素脲醛树脂微胶囊并讨论其缓释性[19]等。目前利用脲醛树脂微胶囊制备植物源农药方面的研究还鲜少。与其他方法相比较,使用脲醛树脂作为囊壁材料,利用原位聚合法制备农药微胶囊剂方法简便、易制取、易储藏,应大力推广并使之用于新型农药制备。其中,植物源农药制备工艺还有待于改善,缓释性能的稳定性还有待加强,其性能表征需更加细化。总之,针对此领域的研究还有很广阔的空间,进一步拓展植物源农药微胶囊剂的研制仍是未来研究方向。
[1]El-Qutob D.Vaccine development and new attempts of treatment for ragweed allergy[J]. Therapeutic Advances in Vaccines,2015,3(2):41-47.
[2]李建东,殷萍萍,孙备,等. 外来种豚草入侵的过程与机制[J].生态环境学报,2009,18(4):1 560-1 564.
[3]El-ela N A,Talha M,El-aziz A A.Response and effect of two plant crude extracts on mosquito larvae Culex pipiens[J]. J Egypt Public Health Assoc,1998,73(5-6):649-665.
[4]Abou Basha L M,El Sayad M H,Allam A F,et al.The effect of Ambrosia maritima(Damsissa)on the viability of Lymnaea cailliaudi;an experimental study[J].J Egypt Soc Parasitol,1994,24(3):513-517.
[5]Wang P H,Xu J,Wu M Y.Chemical constituents of ragweed(Ambrosia artemisiifolia L.)[J].Zhongguo Zhong Yao Za Zhi,1993,18(3)164-166,191.
[6]包颖. 复凝聚法制备豚草提取物微胶囊剂的研究[D].哈尔滨:东北林业大学,2013.
[7]张欣倩,张国财,包颖,等. 豚草提取液对小鼠肝脏CarE 活性及蛋白质含量的影响[J]. 北京林业大学学报,2012,34(002):109-111.
[8]梁治齐.微胶囊技术及其应用[M].北京:中国轻工业出版社,1999.
[9]包颖,张国财.单凝聚法制备豚草提取物微胶囊剂的研究[J].北京林业大学学报,2013,35(4):101-105.
[10]赵民,刘小辰,刘力.脲醛树脂包覆双环戊二烯微胶囊的制备[J].北京化工大学学报(自然科学版),2014,41(4):61-65.
[11]李冰,于萍,代晓东,等.脲醛树脂包覆α-烯烃减阻聚合物微胶囊的制备与性能[J].材料工程,2012,(1):77-82,88.
[12]石淑先,渠艳,衣丽娇,等.啶虫脒/脲醛树脂微胶囊的制备及表征[J].现代化工,2011,31(6):48-50.[13]莫秀梅,赵德仁.农药缓释剂的研究—Ⅰ[J].功能高分子学报,1989,2(1):12-18.
[14]Wang Y T,Zhao X P,Wang D W. Electrophoretic ink using urea-formaldehyde microspheres[J]. J Microencapsul,2006,23(7):762-768.
[15]Guo H L,Zhao X P,Wang J P.The relation between narrow-dispersed microcapsules and surfactants[J]. J Microencapsul,2005,22(8):853-862.
[16]Guo H,Zhao X,Wang J.Synthesis of functional microcapsules containing suspensions responsive to electric fields[J]. J Colloid Interface Sci,2005,284(2):646-651.
[17]Gong R,Li S. Extraction of human genomic DNA from whole blood using a magnetic microsphere method[J].Int J Nanomedicine,2014,9:3 781-3 789.
[18]张大侠.脲醛树脂和聚氨酯壁材微胶囊农药应用性能的对比研究[D].泰安:山东农业大学,2011.
[19]韩志任,杜有辰,李刚. 阿维菌素脲醛树脂微胶囊的制备及其缓释性能[J]. 农药学学报,2007,9(4):405-410.
