花荵组织培养与快速繁殖技术研究
2015-09-17黄宇松周万里
刘 娜,黄宇松,周万里
(1.长春市林业科学研究院,吉林 长春 130117;2.吉林省珲春林业局,吉林 延边 133300)
花荵(Polemonium chinensis)属花荵科花荵属多年生草本,分布于我国东北及河北、山西、内蒙古、新疆、云南西北部,欧洲温带、亚洲和北美亦有生长,多生于海拔(1 000 m)1 700 ~3 700 m的山坡草丛、山谷疏林下、路边灌丛或溪流附近湿地。花荵是一种少有的蓝色花卉,其花期长、叶形优美,是一种较好的观花草本[1]。目前花荵仍处于野生状态。作者对花荵外植体不同培养阶段的最适培养基配方及培养程序进行研究,在保持原株优良性状的同时,探索其组培快繁的有效途径,为实现工厂化育苗提供基础数据。
1 试验材料及方法
1.1 试验材料
选取长势良好的花荵茎基部新抽出的侧芽作为外植体。用温和洗洁精稀释液浸泡30 min,流水冲洗30 min;然后将外植体茎段放在超净工作台上,用75%酒精浸泡20 s,无菌水冲洗数次;用0.1%的氯化汞+吐温(1 ~2滴)消毒5 min,无菌水冲洗6 ~8 次;切取1.0~1.5 cm 长的茎段进行接种。
1.2 培养基的配制
各种培养基在不加特殊注明时,均加入蔗糖30 g·L-1、琼脂5 g·L-1,pH 值在分装灭菌前调至5.2 ~6.2。培养基分装在100 mL 广口玻璃培养瓶中,每瓶装培养基35 mL,在121℃温度下高压灭菌25 min,灭菌后自然冷却,置于无菌室备用。培养条件均为昼温25±2℃,夜温22±2℃,光照时数12 h·d-1,光照强度1 500 ~2 500 Lx。
1.3 试验方法
通过单因素随机区组试验,以无菌苗为材料,从1/2MS、MS、WPM 三种基本培养基及生长素、分裂素的不同配比中,确定最适启动培养基、增值与继代培养基、生根培养基。
2 结果与分析
2.1 启动培养
由表1、图1 中可以看出,比较①、②、③结果,以MS 作为基本培养基时启动率最高,达到85%,并且腋芽长势较好;以WPM、1/2MS 作为基本培养基时启动率相对较低,长势相对较差。比较③、④、⑤结果,添加生长素NAA 的培养基,明显高于添加IBA、IAA 的培养基,且长势较好。比较③、⑥、⑦结果,添加分裂素6-BA的培养基启动率明显高于添加KT、ZT 的培养基。根据试验结果,确定最适启动培养基为MS+6-BA1.0 mg·L-1+NAA0.05 mg·L-1。

表1 不同培养基对外植体启动培养的影响Tab.1 Effect of different culture medium on explant initiation culture

图1 花荵腋芽诱导10 d 的生长状态Fig.1 The growth status of axillary bud induction of Polemonium chinensis for 10 d

图2 花荵增殖培养20 d 的生长状态Fig.2 The growth status of enrichment culture of Polemonium chinensis for 20 d
2.2 增殖与继代培养
2.2.1 基本培养基的筛选
以1/2 MS、MS、WPM 为基本培养基,分级添 加 NAA0. 15 mg · L-1和 6 - BA 2.0 mg·L-1,接种40 d 后统计增殖系数,记录生长状况。从表2 中可以看出,以1/2 MS、WPM 作为增殖培养基本培养基时,植株长势均较差,增殖系数分别为1.78 和1.73,明显少于以MS 作为增殖培养基本培养基时的增殖系数3.6,且在MS 培养基上形成的丛生植株健壮,长势较好。由此可见,花荵最适增殖基本培养基为MS。

表2 不同基本培养基对增殖培养的影响Tab.2 Effect of different basic culture medium on enrichment culture
2.2.2 不同激素配比对试管苗增殖的影响
以MS 为基本培养基,添加NAA(0.00 mg·L-1、0.05 mg·L-1、0.15 mg·L-1)与6-BA(0.5 mg·L-1、1.0 mg·L-1、2.0 mg·L-1)3个质量浓度梯度,接种40 d 后统计增殖率。由表3、图2 中可以看出,细胞分裂素和生长素合理配比才能实现离体植物形态建成的目的,最优化的增殖体系不但要求有较高的增殖系数,还要有健壮的形态、颜色和便于继代转接的株高[2]。当NAA 质 量 浓 度 为0.15 mg·L-1、6-BA质量浓度为2.0 mg·L-1时,用量及比例适合花荵增殖培养。

表3 不同激素配比对增殖培养的影响Tab.3 Effect of different hormones proportion on enrichment culture
2.3 生根培养
接种20 d 后观察试管苗生长状态并统计生根率、平均根条数及根的生长状态。由表4、图3 中可以看出,比较①、②、③结果,以1/2MS作为生根基本培养基时,试管苗健壮,根的诱导效果最佳,生根率达97.78%,平均生根条数多。MS 也有一定的诱导生根效果,生根率为88.00%,单株生根数低于1/2MS。WPM 培养基中根细弱,试管苗状态差,愈伤组织较多。比较③、④、⑤结果,以NAA 作为生根培养的生长素生根效果最佳,明显高于IAA 与IBA 的生根率,并且根系生长粗壮,试管苗健壮,无愈伤组织生成。比较③、⑥、⑦结果,生根培养在低质量浓度时,生根率为68.89%,产生的根条数量较少,低质量浓度不利于根的诱导,生长素质量浓度升高时,诱导生根率呈上升趋势,根条数量也逐渐增多,但高质量浓度生长素也促进了愈伤组织的生成[3]。试管苗在生长素NAA 质量浓度为0.1 mg·L-1的培养基上生根效果最佳。
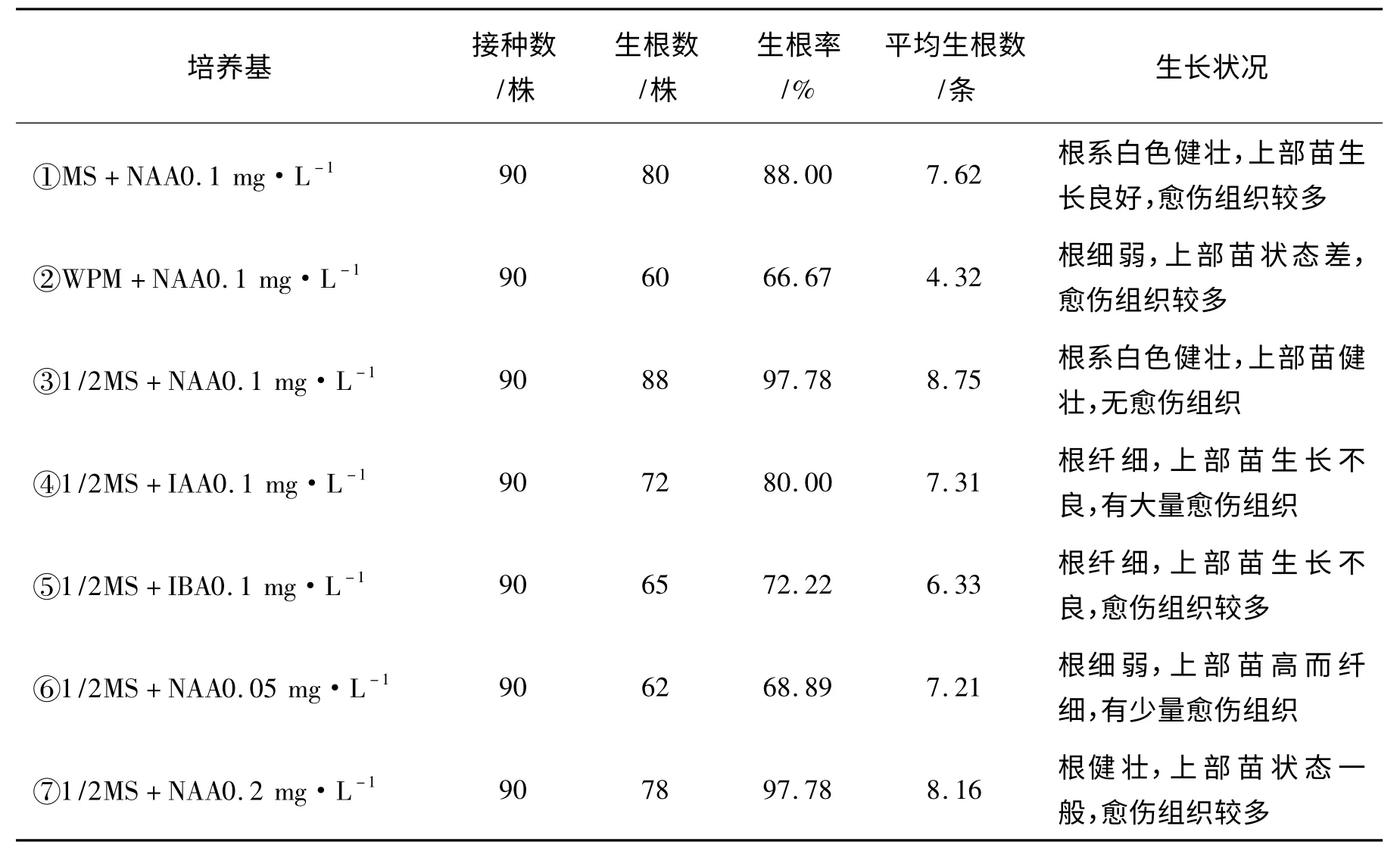
表4 不同培养基对试管苗生根培养的影响Tab.4 Effect of different medium on test-tube plantlet rooting culture
2.4 炼苗移栽
2.4.1 炼苗方式对试管苗移栽成活的影响
采用4 种方式进行炼苗,移栽30 d 后观察试管苗生长状态并统计成活率,试验结果见表5。

图3 花荵生根培养20 d 的生根状态Fig.3 The rooting status of rooting culture of Polemonium chinensis for 20 d

图4 移栽15 d 花荵的生长状态Fig.4 The growth status of transplantation of Polemonium chinensis for 15 d
从表5 中可以看出,瓶苗在室内阴凉处闭瓶放置2 ~3 d 后移栽,成活率为95.56%,且移栽苗长势健壮。分析原因,试管苗原是在无菌、光照充足、100%的相对湿度、适宜的温度、充足的营养下培养,在开口炼苗后,由于试管苗叶表面无蜡质、表皮毛极少、气孔又不能及时关闭,极易失水萎蔫,降低移栽成活率;炼苗开口时间太长,琼脂培养基容易感染杂菌,也会使移栽成活率明显下降。试验结果证明,试管苗最佳炼苗方式为室内阴凉处闭瓶放置2 ~3 d。
2.4.2 基质对试管苗移栽成活的影响
采用河沙等3 种基质,移栽30 d 后观察移栽苗的生长状态并统计成活率,试验结果见表6、图4。

表6 不同基质对花荵试管苗移栽成活的影响Tab.6 Effect of different media on test-tube plantlet transplantation survival of Polemonium chinensis
从表6、图4 中可以看出,试管苗移栽在河沙基质上平均成活率最高,为96.67%。分析原因,由于草炭与珍珠岩混合基质透水性、透气性不如河沙,因此小苗的成活率较低,生长速度慢。因此,花荵最佳移栽基质为河沙。
3 结论与讨论
花荵组织培养最适启动培养基为MS+6-BA1.0 mg·L-1+NAA0.05 mg·L-1;最适增殖培养基为MS+6-BA 2.0 mg·L-1+NAA0.15 mg·L-1,平均增殖系数3.6;最适生根培养基为1/2MS+ NAA0.1 mg·L-1,生根率97.78%;最佳移栽基质为河沙,移栽成活率为96.67%。
本试验通过花荵茎段(含茎尖)诱导产生的不定芽生长健壮,并且诱导的时间短,诱导效果好,有利于保持植物体的遗传特性[4]。合适的培养基选择需从两方面考虑:一是基本培养基,二是各种激素浓度的配比。本试验中采用如生长素NAA、IBA 和IAA,细胞分裂素6-BA和ZT、KT 等多种植物生长调节剂,在快速繁殖过程中,生长素的水平应该低一些,这是因为高水平的生长素会诱导形成愈伤组织,而产生的愈伤组织会降低增殖率。在试管苗生根培养中,生长素IBA、IAA 和NAA 对生根的影响有一定的差异,生长素浓度过低时根的分化不明显,生根效果不佳;浓度过高,愈伤组织的量增加,根的分化受到抑制[5]。试管苗的移栽成活是植物组织培养最后一关,移栽基质、炼苗方式和移栽环境条件,都对提高试管苗的移栽成活率起着至关重要的影响6]。因此,既要考虑基质的保水性、通气性,又不可忽视其营养性,还要选择合适的炼苗方式,同时也要兼顾到移栽时的季节、温度和湿度等对成活率的影响。这些问题在今后实践中应进一步研究。
[1]魏进华,王洪俊,白鸥.吉林省野生草本地被植物在园林中的应用[J].安徽农业科学,2006,34(21):5 531-5 533.
[2]罗希明,谢雪菊,陈忠亮.沙打旺、红豆草和野火球外植体一次培养再生植株[J].中国草地学报,1991,(6):79-80.
[3]王玉英,高新一.植物组织培养技术手册[M].北京:金盾出版社,2006.
[4]曲春香,奚惕,苗连山.黄莲花的组织培养及试管繁殖[J].植物生理学通讯,1990,(2):42.
[5]张素勤,邹志荣,耿广东,等.培养基和植物激素对非洲菊叶片愈伤组织诱导的研究[J].西北农林科技大学学报(自然科学版),2004,32(10):29-32.
[6]付印东,孙晓梅,杨宏光,等.紫花地丁组培快繁技术研究[J].北方园艺,2008,(5):200-201.
