Wnt/β-catenin信号通路上游基因在山羊绒周期性再生及着色过程中的表达分析
2015-09-15张恩平陈玉林闫海龙
马 森,张恩平*,陈玉林*,闫海龙
(1.西北农林科技大学 动物科技学院,陕西 杨凌712100;2.榆林学院生命科学研究中心,陕西 榆林719000)
山羊绒是绒山羊次级毛囊的产物,又称开司米,是极好的纺织原料。不同颜色绒毛中,又以白绒最为珍贵[1]。山羊绒随绒山羊皮肤内次级毛囊周期性在生长期、退行期及休止期间定向转换而循环生长、着色及脱落[2]。因此探索山羊绒周期再生及着色的分子机理,将对绒山羊遗传育种及羊绒产业发展具有促进作用。
Wnt/β-catenin 信 号 通 路 是 由 Nusse 等[3]于1982年在小鼠乳腺肿瘤病毒研究中首次发现的,其传导途径如下:Wnt蛋白与靶细胞膜受体结合而激活胞质内小分子β-catenin,促使其在胞质内聚集后转位入核,激活转录因子复合物Lef1/Tcf3而起始下游靶基因的转录。此外,一些拮抗因子如Dkk1[4]等能通过与Wnt蛋白竞争性地结合膜受体而抑制该信号通路。
国内外研究发现,Wnt/β-catenin信号通路是调控成熟毛囊周期性发育的中枢通路之一,该通路内β-catenin等上游基因在毛囊周期性发育过程中起着决定性作用[5]。β-catenin、Lef1/Tcf3等基因突变失活阻碍成熟毛囊再次进入周期性发育过程,而其过表达则诱导成熟毛囊提前由休止期向生长期的转换[6]。同时,β-catenin 等基因也能够促进生长中期毛囊内部细胞的大量增殖分化而快速重构毛干[7]。Dkk1基因的过表达则阻断毛囊周期性再生的过程。此外,β-catenin、Lef1/Tcf3及 Dkk1也参与调控毛囊内部黑素细胞生长发育及黑素合成的过程而影响毛干的着色[8]。
目前,Wnt/β-catenin信号通路调控成熟毛囊周期性发育及毛干着色过程的研究主要集中在人和小鼠上,而在绒山羊上则尚有相关研究报道。本研究拟对该通路上游基因β-catenin、Lef1/Tcf3及拮抗基因Dkk1mRNA在白色绒山羊绒毛生长不同时期及黑、白色绒山羊绒毛生长旺盛期时体侧部皮肤组织中的相对表达量进行测定,初步探究 Wnt/β-catenin信号通路是否参与山羊绒周期性再生及着色的过程,为进一步完善山羊绒毛周期性再生及着色的分子机理奠定基础。
1 材料与方法
1.1 样品采集
于榆林市陕北白绒山羊繁育中心选取成年黑、白色供试公羊3只,于2013年5月至2014年3月每间隔两月采取体侧部皮肤组织1cm2,共采集六次(黑色绒山羊只采集9月份皮肤样品)。皮肤组织离体后,置于DEPC处理过的生理盐水中冲洗血液及其他杂物,立即将皮肤组织置于RNA保存液中,低温运输,-80℃保存。
1.2 主要试剂与仪器
RNA保存液(Takara)、RNA提取试剂盒(康为世纪)、反转录试剂盒(Thermo Scientific)、实时荧光定量试剂盒(Takara)、胶回收试剂盒(Omega)。梯度PCR仪(Bio-Rad),pMD-19T克隆载体(Takara);核酸蛋白定量仪(NanoDrop);实时荧光定量PCR仪(Bio-Rad);凝胶电泳仪(北京六一仪器厂);凝胶成像仪(Bio-Rad);高速冷冻离心机(Eppendorf)。
1.3 皮肤组织总RNA提取及cDNA合成
皮肤组织解冻后经DEPC处理水吹洗三次以除去残留RNA保存液,经高通路组织研磨器研磨后按照超纯RNA提取试剂盒说明书所示步骤提取皮肤组织总RNA,1%琼脂糖凝胶电泳检测所提总RNA完整性,核酸定量仪测定总RNA纯度及浓度。
将所提取的皮肤组织总RNA均质化然后依照Thermo反转录试剂盒操作说明书所示步骤以Oligo(dT)18为引物进行cDNA第一链的合成。反应体系如下:2μg总RNA、1μL Oligo(dT)18引物、4 μL 5XReaction Buffer、1μL RibolLock RNase Inhibitor(20u/μL)、2μL 10mM dNTP Mix、1μL RevertAid M-MuLV Reverse Transcriptase(200u/μL),补足无酶水至20μL。上述试剂配置均在冰上进行。轻微混匀后离心,42℃孵育60min,70℃加热5min终止反应,反转录产物置于-80℃保存备用。
1.4 Wnt/β-catenin信号通路上游基因 mRNA 在白色绒山羊不同时期体侧部皮肤组织的表达
据NCBI数据库中已发表的β-catenin(XM_005695574.1)、Dkk1(XM_005698161.1)、Tcf3(XM_005682921.1)、Lef1(NM_001285746.1)及内参基因β-actin(XM_005946208.1)核苷酸序列,采用Primer premier 5.0设计定量引物。实时荧光定量确定引物的扩增特异性及效率。各基因引物见表1。

表1 Wnt/β-catenin信号通路上游基因实时荧光定量引物Table 1 Primers sequences of upstream genes within Wnt/β-catenin pathway for quantitative real-time PCR
取反转录合成的cDNA第一链,使用上述各基因引物进行qRT-PCR条件及体系的优化。优化后的反应体系如下:12.5μL SYBR®Premix Ex TaqII(Tli RNaseH Plus)2×、1μL PCR Forward Primer(10μM)、1μL PCR Reverse Primer(10 μM)、cDNA 2μL、灭菌ddH2O 8.5μL,总体积为25μL。实时定量采用三步法PCR程序:95℃预变性30s;95℃变性5s,58℃退火30s,72℃延伸30 s,共40个循环;60~95℃解链,梯度0.5℃,共71个循环。每个样品做三次重复。
1.5 Wnt/β-catenin通路上游基因 mRNA 在生长旺盛期黑白色绒山羊体侧部皮肤组织的表达
β-catenin、Lef1/Tcf3及 Dkk1基因所采用实时荧光定量引物及反应条件同1.5。
1.6 数据统计分析
相关基因在白色绒山羊绒毛生长不同时期及生长旺盛期黑、白色绒山羊体侧部皮肤组织中的相对表达量采用2-ΔΔCt法计算。各基因在不同月份白色绒山羊皮肤组织中的相对表达量以5月份为基准,而9月份黑、白色绒山羊皮肤组织内的相对表达量则以黑色为基准。数据显著性分析采用SPSS 17软件。
2 结果与分析
2.1 皮肤组织样品所提取总RNA检测
经紫外分光光度计检测所提取的绒山羊皮肤总RNA发现,OD260/280值均在1.8至2.0之间。1%琼脂糖凝胶电泳检测图中28S、18S电泳条带清晰可见,5S条带暗淡,各条带之间弥散较少。结果表明,所提取皮肤组织总RNA完整性良好,纯度及质量满足实验要求。
2.2 实时荧光定量PCR扩增效率及相关系数分析
绒山羊皮肤样品的总RNA进行反转录获得皮肤样品cDNA,经10倍梯度比稀释后进行实时荧光PCR,得到内参基因β-actin 及β-catenin 等基因相关系数(R)均在0.990以上,扩增效率(E)均在95%~110%之间。结果表明,反转录所得的cDNA可用于下一步实时荧光定量PCR试验,实时荧光定量PCR体系及条件适于β-actin及β-catenin等基因mRNA的相对表达量研究。
2.3 Wnt/β-catenin信号通路上游基因在白色绒山羊不同月份体侧部皮肤组织的表达
Wnt/β-catenin信号通路上游基因mRNA不同月份间相对表达量(5月份为基准)见图1。由图1知,βcatenin、Lef1/Tcf3基因mRNA相对表达量在5~9月份间逐步上调,9月份表达量最高(P<0.05);9月份到次年3月份间,表达量逐步下调;3月份表达量最低(P<0.05)。同时,各基因mRNA在5月份的相对表达量显著高于3月份(P<0.05)。Dkk1作为Wnt/β-catenin信号通路的拮抗基因,其各月份之间相对表达量差异不显著(P>0.05)。结果表明,Wnt/β-catenin信号通路内β-catenin等上游基因mRNA在间白色绒山羊各月份体侧部皮肤组织中的相对表达量有明显的先上调后下调的变化规律,而Dkk1基因mRNA各月份间相对表达量则无类似的变化规律。

图1 Wnt/β-catenin信号通路上游基因在白色绒山羊不同月份皮肤组织中的表达Fig.1 Expression of upstream genes within Wnt/β-catenin signaling in cashmere goat skin tissue among different months
2.4 Wnt/β-catenin通路上游基因在生长旺盛期黑白绒山羊皮肤组织中的表达
Wnt/β-catenin 信号通路中上游基因β-catenin、Lef1/Tcf3以及该通路拮抗基因Dkk1mRNA在9月份黑、白色绒山羊皮肤组织中的相对表达量见图2。由图2可知,各基因mRNA在黑、白绒山羊皮肤组织中的相对表达量均差异不显著(P>0.05)。
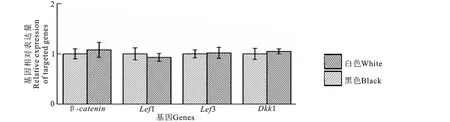
图2 Wnt/β-catenin通路上游基因在黑白色绒山羊皮肤组织中的表达Fig.2 Expression of upstream genes within Wnt/β-catenin signaling in cashmere goat skin tissue between the white and black
3 讨 论
研究表明,Wnt/β-catenin信号通路基因在小鼠皮肤组织中的表达具有毛囊周期依赖性的特征,即在生长前期出现表达,生长中期表达量最高,退行期及休止期表达量最低甚至没有表达[9]。本试验对Wnt/β-catenin信号通路上游β-catenin 等基因 mRNA在不同月份白色绒山羊体侧部皮肤组织中的相对表达量进行研究。对于绒山羊来讲,5、7月份为绒毛生长前期,9月份为生长旺盛期,11月份为生长后期,1月份处于退行期,3月份则处于休止期[10]。Wnt/β-catenin信号通路上游基因mRNA在处于各个时期内的白色绒山羊体侧部皮肤组织中均有表达,生长前期(5、7月份)至生长旺盛期(9月份)时表达量逐渐升高,旺盛期时表达量最高,生长旺盛期后进入生长后期(11月份)、退行期(1月份)时表达量逐渐下调,休止期(3月份)时表达量最低。Wnt/βcatenin信号通路上游基因在白色绒山羊不同时期体侧皮肤中的表达呈现同绒毛周期生长同步的规律性,表明该信号通路同次级毛囊的活动密切相关。
Wnt/β-catenin信号通路在毛囊生长发育过程中的作用主要与毛囊内部各类细胞增殖、分化有关。毛囊形态发生期时,Wnt/β-catenin信号首先在真皮中出现,构成“第一真皮信号”,诱导上皮细胞聚集增殖形成表皮基板以及真皮凝聚物[11]。随后,Wnt/βcatenin信号作为“第二真皮信号”促使表皮基底层细胞快速分裂,向下生长并入侵真皮层,包裹真皮凝聚物形成了毛乳头[11]。成熟毛囊进入周期性再生循环时,Wnt/β-catenin信号通路主要与休止期静息状态维持,休止期向生长期转换以及生长期毛囊的快速重构相关。研究发现,Wnt/β-catenin信号在休止期大部分时间内被BMP信号所抑制,仅在休止期快结束时抑制效应才被解除。Wnt/β-catenin信号在休止期被抑制主要是由于低水平的 Wnt/βcatenin信号能够抑制隆突部内毛囊干细胞的增殖分化而维持毛囊休止期的静息状态。休止期末时,BMP信号水平降低,Wnt/β-catenin信号水平升高从而促使毛囊干细胞的增殖分化,继而诱导毛囊由休止期向生长期的转换[12]。研究人员通过基因突变与转录组测序相结合的技术手段也发现,β-catenin在生长期起始时激活隆突部毛囊干细胞内同细胞增殖分化相关基因的大规模表达[13]。也有研究发现,β-catenin基因功能缺失则导致毛囊滞留于休止期,不能正常地实现由休止期向生长期的转换[6]。生长期时,大量的 Wnt/β-catenin信号通路基因以高水平且相互重叠的方式表达于毛囊内部以维持毛囊生长期的正常行进[13]。有研究指出,生长中期时β-catenin、Lef1等 Wnt/β-catenin信号通路上游基因高水平表达于毛母质区域,促进毛母质内毛干前体细胞向毛干各细胞谱系终末分化的过程而重构毛干[14-15]。一些毛发特异性的角蛋白基因启动子区域含有Lef/Tcf转录因子结合位点,因而受到 Wnt/βcatenin信号通路的转录调控[16]。此外,一些具有促进角蛋白细胞增殖分化作用的 Wnt/β-catenin信号通路靶基因如Shh、Jagged1等也在生长期毛母质内高表达[17]。当毛囊进入由细胞凋亡驱使的退行期及休止期时,Wnt/β-catenin信号水平也逐渐减弱至基本消失[15]。
Wnt/β-catenin信号强弱与毛囊内部细胞活动及毛囊不同时期的转换有直接关系。结合 Wnt/βcatenin信号通路上游基因在绒毛生长不同时期绒山羊体侧部皮肤组织中的表达规律推测,Wnt/βcatenin信号能够通过对次级毛囊内部细胞增殖分化的调控,而促进次级毛囊由休止期向生长期的转换以及生长期绒毛的快速生长。但 Wnt/β-catenin信号通路各上游基因具体在毛囊内的表达部位以及表达量与不同时期绒毛生长速度的关系还需通过原位杂交及免疫组化等试验进一步研究和验证。
哺乳动物皮肤及毛发着色是一个受复杂基因互作网络调控的过程。Wnt/β-catenin作为哺乳动物内保守且具有重要生理作用的信号通路之一,也参与了皮肤及毛发的着色过程。Wnt/β-catenin信号通路拮抗基因Dkk1在人皮肤着色较淡的掌拓(手、脚)部位高表达而在着色较深的非掌拓部位低表达,表明Dkk1基因与人类不同部位的皮肤着色深浅相关[18]。β-catenin基因在不同毛色的羊驼皮肤组织中的表达量存在差异,表明β-catenin基因参与动物毛发着色过程[19]。本试验对 Wnt/β-catenin信号通路上游β-catenin、Lef1/Tcf3基因及该通路拮抗基因Dkk1mRNA在生长旺盛期黑、白绒山羊皮肤组织中的相对表达量研究发现,上述基因在不同毛色绒山羊皮肤组织中的相对表达量并无显著差异,表明Wnt/β-catenin信号通路可能并不参与绒毛的着色过程。该结果同前述研究并不相符。
黑色素细胞通过产生黑素为皮肤及毛发着色。Wnt/β-catenin信号通路参与皮肤及毛发着色过程主要与其调控黑色素细胞增殖分化的作用相关。低水平的Wnt/β-catenin信号维持黑素前体细胞-黑素干细胞的未分化状态,高水平的 Wnt/β-catenin信号促进黑素干细胞终末分化成为成熟的黑素细胞[20]。β-catenin在已分化的黑素细胞中低表达而在未分化完成的黑素细胞中高表达,说明 Wnt/βcatenin信号主要是与黑素细胞生成及增殖分化相关,但可能并不参与已分化黑素细胞功能的调控[21]。之前研究中,Dkk1对不同部位皮肤着色深浅调节与其拮抗 Wnt/β-catenin信号而抑制黑素细胞增殖分化相关,也并没有涉及已分化黑素细胞的功能调控[18]。黑素是由已经分化的黑素细胞产生的,并被分泌到邻近角蛋白细胞中而为皮肤及毛发着色。对于绒山羊来讲,生长旺盛期时绒毛生长速度最快,此时次级毛囊内已分化黑素细胞也大量产生黑素为绒毛着色。Wnt/β-catenin信号通路上游基因生长旺盛期在黑、白绒山羊皮肤组织中的表达量并无差异,表明 Wnt/β-catenin信号通路并不涉及次级毛囊内部已分化黑素细胞产生黑素而为绒毛着色的过程。本研究只初步探讨 Wnt/β-catenin信号通路在是否参与生长旺盛期绒毛着色过程,而Wnt/β-catenin信号通路在整个毛囊周期中绒毛着色过程中的作用还需对 Wnt/β-catenin信号通路相关基因在不同时期及不同毛色绒山羊皮肤组织中的表达量进行测定。
4 结 论
Wnt/β-catenin信号通路上游β-catenin、Lef1/Tcf3基因mRNA在白色绒山羊不同时期体侧部皮肤组织中的相对表达量具有明显的变化规律即生长前期缓慢上调,旺盛期表达量最高,生长后期及退行期逐渐下调,休止期表达量最低;该通路拮抗基因Dkk1mRNA在白色绒山羊不同时期体侧部皮肤组织中无明显的变化规律。β-catenin、Lef1/Tcf3及Dkk1基因mRNA在生长旺盛期黑、白绒山羊体侧部皮肤组织中的表达并无显著差异。Wnt/β-catenin信号通路参与绒毛周期性再生过程,但并不参与生长旺盛期绒毛的着色过程。
[1] 朱玉成.影响山羊绒细度的因素及控制羊绒细度的研究现状[J].中国草食动物,2004,24(2):35-37.
[2] 贾志海.国外绒山羊研究现状及展望[J].中国畜牧杂志,1994,30(1):57-59.
[3] Ken M C,Roel Nusse.Wnt signaling:a common theme in animal development[J].Gene and Development,1997,11:3 286-3 305.
[4] Glinka A,Wu W,Delius H,et al.Dickkopf-1is a member of a new family of secreted proteins and functions in head induction[J].Nature,1998,391:357-362.
[5] Andl T,Reddy S T,Gaddapara T,et al.WNT signals are required for the initiation of hair follicle development[J].Development Cell,2002,2:643-653.
[6] Atit R,Sgaier S K,Mohamed O A,et al.β-Catenin activation is necessary and sufficient to specify the dorsal dermal fate in the mouse[J].Development Bio,2006,l296:164-176.
[7] Rabbani P,Takeo M,Chou W,et al.Coordinated activation of Wnt in epithelial and melanocyte stem cells initiates pigmented hair regeneration[J].Cell,2011,145:941-955.
[8] Tanimura S,Tadokoro Y,Inomata K,et al..Hair follicle stem cells provide a functional niche for melanocyte stem cells[J].Cell Stem Cell,2011,8:177-187.
[9] Plikus M V,Mayer J A,LA Cruz de D,et al.Cyclic dermal BMP signalling regulates stem cell activation during hair regeneration[J].Nature,2008,51:340-344.
[10] 王 丽,彭丽琴,张文彬,等.内蒙古白绒山羊皮肤毛囊发生发育规律的研究[J].畜牧兽医学报,1996,27(6):524-530.
[11] Narhi K,Ja rvinen E,Birchmeier W,et al.Sustained epithelialβ-catenin activity induces precocious hair development but disrupts hair follicle down-growth and hair shaft formation[J].Development,2008,135:1 019-1 028.
[12] Oshimori N,Fuchs E.Paracrine TGF-bsignaling counterbalances BMP-mediated repression in hair follicle stem cell activation[J].Cell Stem Cell,2012,10:63-75.
[13] Wen-hui Lien,Lisa Polak,Mingyan Lin,et al.In vivo transcriptional governance of hair follicle stem cells by canonical Wnt regulators[J].Nature cell biology,2014,16(2):179-190.
[14] Reddy S T,Andl T,Lu M-M,et al.Expression of Frizzled genes in developing and postnatalhair follicles[J].J Invest Dermatol,2004,123:275-282.
[15] Reddy S,Andl T,Bagasra A,et al.Characterization of Wnt gene expression in developing and postnatal hair follicles and identification of Wnt5aas a target of Sonic hedgehog in hair follicle morphogenesis[J].Mech Dev,2001,107:69-82.
[16] Fuchs E.Scratching the surface of skin development[J].Nature,2007,445:834.
[17] Enshell-Seijffers D,Lindon C,Kashiwagi M,et al.β-catenin activity in the dermal papilla regulates morphogenesis and regeneration of hair[J].Dev Cell,2010,18:633-642.
[18] Yamaguchi Y,Itami S,Watabe H,et al.Mesenchymal-epithelial interactions in the skin:Increased expression of dickkopf1by palmoplantar fibroblasts inhibits melanocyte growth and differentiation[J].J Cell Biol,2004,165:275-285.
[19] 于秀菊,董常生,范阔海,等.β-catenin在不同毛色羊驼皮肤中的表达和定位[J].畜牧兽医学报,2010,41(3):335-340.
[20] Piul Rabbani,Makoto Takeo,WeiChin Chou,et al.Coordinated Activation of Wnt inEpithelial and Melanocyte Stem Cells Initiates Pigmented Hair Regeneration[J].Cell,2011,145:941-955.
[21] 邓 芳,郭海英,连晓华,等.毛囊黑素谱系细胞中β-catenin在毛囊周期中的表达[J].第三军医大学学报,2011,33(8):44-46.
