绵羊骨骼肌特异表达miR-133前体在不同绵羊群体中的多态检测
2015-04-19宋广超许瑞霞赵伟利刘守仁甘尚权
宋广超,张 伟,许瑞霞,赵伟利,刘守仁,*,甘尚权
(1.石河子大学动物科技学院,新疆 石河子 832003;2.新疆农垦科学院畜牧兽医研究所,新疆 石河子 832000)
绵羊骨骼肌特异表达miR-133前体在不同绵羊群体中的多态检测
宋广超1,2,张 伟1,2,许瑞霞1,2,赵伟利1,2,刘守仁1,2,*,甘尚权2,*
(1.石河子大学动物科技学院,新疆 石河子 832003;2.新疆农垦科学院畜牧兽医研究所,新疆 石河子 832000)
试验旨在研究骨骼肌中特异表达miR-133前体在不同绵羊群体中的多态,分析其与绵羊骨骼肌发育表型的相关性。采用PCR-SSCP技术对miR-133前体序列在特克赛尔羊、中国美利奴细毛羊、阿勒泰羊和湖羊四种不同产肉性能的绵羊群体进行了多态性检测,并分析多态性位点对miR-133前体序列二级结构、二级结构稳定性及加工、成熟的影响。结果表明,miR-133前体序列下游194 bp(g.54047535)处检测到A>G突变,并且该SNP与绵羊的产肉性能存在明显的相关性,在特克赛尔羊中GG是优势基因型, G等位基因频率高达0.86,是中国美利奴细毛羊群体该位点频率的4倍。二级结构的生物信息学预测结果表明,该SNP位点致使miR-133前体的二级结构发生明显改变,自由能值降低3.2 kJ/mol。以上结果提示,绵羊miR-133前体序列的SNP(g.54047535)位点可能对miR-133前体的加工成熟具有重要影响,并最终影响绵羊的产肉性能。
pri-miRNA;pre-miRNA;miR-133;多态性;骨骼肌;绵羊
miRNA(microRNA)是一类长约22个核苷酸的非编码RNA,通过调控其靶基因的表达水平而发挥重要的生物学作用[1]。miRNA的转录、加工、成熟需要诸多蛋白质的参与,在细胞核中,miRNA先由RNA聚合酶Ⅱ转录(有少部分是由RNA聚合酶Ⅲ转录)产生一个长约1 000 bp的初始转录本(primary miRNA, pri-miRNA),然后由核酸内切酶Drosha切割成为长约几十个碱基的前体,称之为precursor miRNA(pre-miRNA)[2],再由Exportin 5转运到细胞质。在细胞质中,pre-miRNA由另一种核酸内切酶Dicer切割成为成熟的miRNA,并与Argonaut结合成为RNA诱导的沉默复合体(RNA-induced silencing complex, RISC)发挥基因表达调节作用[3]。大量研究表明,miRNA在基因表达过程中发挥着广泛而重要的调控作用[4-5],人类约有30%的基因受miRNA的调控[6]。
核酸内切酶Drosha和Dicer通过识别miRNA前体的特异构象对其进行切割加工[2-3],所以miRNA前体序列的突变,必然会影响其构象,进而使其加工成熟发生变化,使成熟miRNA水平上调或下调,并最终影响到其对靶基因的调控,如果突变发生在"种子序列",则有可能失去对原有靶基因的调控或者产生新的靶基因,使生物的相应性状发生改变甚至产生疾病[7]。例如,miR-146a(C>G, rs2910164), miR-149(T>C, rs2292832)和miR-196a2(T>C, rs11614913)的单核苷酸多态性(single nucleotide polymorphism,SNP)与希腊人群中的胃癌发病率密切相关[8],miR-185 的两个SNPs(C>T, rs2008591和 A>G, rs887205)与非洲人群中乳腺癌的发生存在关联性[9]。
到目前为止,miRNA前体多态性的相关研究主要集中在其与疾病发生之间的关系上,而对其它的生物学功能研究较少。近期的研究结果表明,在哺乳动物骨骼肌分化和增殖过程中,miRNA的调控发挥着重要作用[10-12],本实验室前期高通量测序的结果也表明,在绵羊骨骼肌发育过程中大约有300种miRNA表达,但是其中的22种miRNA的表达量占到99.6%(该部分数据未发表)。可以推断,这22种miRNA在绵羊骨骼肌的发育过程中发挥着重要作用。
miR-133在哺乳动物的骨骼肌和心肌中特异表达[15],小鼠的miR-133和miR-1基因成簇排列于2号和18号染色体上,并同时被转录出来,其中一个初始转录本(pri-miRNA)长约6 kb,经两次剪切加工后形成22 bp的成熟miRNA。miR-133通过调控其靶基因而促进肌细胞的增殖[12]。绵羊的miR-133基因位于13号染色体上,本实验室的前期研究结果表明,miR-133在绵羊骨骼肌中高表达,但其在不同绵羊群体中的多态性检测及其功能分析还未见报道。基于此,本文以miR-133为研究对象,采用PCR-SSCP检测其在不同绵羊品种中的多态性,并分析其与绵羊产肉性能之间的相关性,为绵羊肌肉发育调控机理的研究及优良肉羊品种的培育提供参考。
1 材料与方法
1.1 血样采集及基因组提取
150份阿勒泰羊血样采自阿勒泰富蕴县阿勒泰羊种群核心区,100份中国美利奴细毛羊血样采自新疆生产建设兵团农八师150团紫泥泉种羊场,144份湖羊血样采自江苏省泰州海伦羊业有限公司。所有血样均通过颈静脉采集,每只羊采集10 mL,1.5%的EDTANa2抗凝,酚-氯仿法抽提基因组。90份特克赛尔羊基因组样品由中国农业科学院北京畜牧兽医研究所储明星研究员馈赠。
1.2 引物设计与合成
从miRBase数据库(http://www.mirbase.org/)调取绵羊miR-133的成熟序列(MIMAT0014972,ID: oar-miR-133),并与UCSC(http://genome.ucsc.edu/)绵羊数据库进行比对并截取左右侧翼各500 bp序列,在成熟序列上下游各200 bp左右设计引物,上游引物:pri-133295U25:5'-TTGGTCACGTGACTGACCCTCAGAC-3',下游引物:pri-133780L25:5'- GTGATGCTGTGGTGTGCAGCAGACA-3',引物由上海生工合成。
1.3 PCR扩增
PCR反应采用25 μL体系:10×PCR buffer 2.5 μL, dNTPs(10 mmol/L) 2 μL, 上下游引物 (10 μmol/L)各0.5 μL, Taq DNA聚合酶(2.5 U/μL) 0.5 μL, 模板DNA (100 ng/μL) 1 μL,加ddH2O至25 μL。PCR反应条件:94 ℃预变性5 min,94 ℃ 30 s,64℃ 30 s,72 ℃ 30 s,共35个循环,72 ℃延伸10 min,4℃保存。PCR产物用1.5%的琼脂糖凝胶电泳检测,目标基因扩增片段为485 bp。
1.4 SSCP分型及测序
取2 μL PCR产物混合8 μL变性上样缓冲液,98 ℃变性10 min,立即置于冰上5 min,经10%非变性聚丙烯酰胺凝胶电泳进行分型鉴定。电泳条件:在4~15 ℃温度下,300 V电泳5 min,然后110 V电泳16 h。凝胶经固定、银染、显色并拍照,然后根据不同的带型对各样品进行分型鉴定。
根据SSCP分型结果,挑选不同带型的PCR产物,经回收纯化后送北京六合华大基因科技股份有限公司测序,以确定突变位点及序列。
1.5 多态位点对miR-133前体影响的分析
Pri-miRNA和pre-miRNA通过链内碱基配对形成带有多个颈环结构的复杂二级结构,并被核酸内切酶Drosha和Dicer识别切割。前体序列的碱基突变尤其是位于茎部的碱基发生突变可能会使原有的碱基配对发生变化,造成其最小自由能升高(G,C突变为A,U)或者降低(A,U突变为G,C),使其稳定性发生变化而最终影响其加工成熟。所以可以通过计算其最小自由能的方法对pri-miRNA和pre-miRNA的二级结构和稳定性进行预测。本文采用RNAstructure软件用Zuker算法对miR-133野生型和突变型前体序列最优二级结构进行预测,并通过能值△G的变化比较两种构象的稳定性。
1.6 数据分析
使用PCR-SSCP技术共检测150份阿勒泰羊基因组,100份中国美利奴细毛羊基因组,144份湖羊基因组及90份特克赛尔羊基因组,以检测miR-133前体序列的突变及其在上述四种不同绵羊品种中的分布。采用SPSS 13.0软件计算不同绵羊品种的基因型及等位基因频率,并使用卡方检验分析各群体中基因型是否处于Hardy-Weinberg平衡。
2 结果与分析
2.1 PCR-SSCP分型及测序
以上述绵羊基因组为模板进行PCR反应,经1.5%琼脂糖凝胶电泳,得到大小为485 bp的特异性条带,目标片段与预期大小一致,证明引物的特异性及扩增效率均较高,符合SSCP检测要求,部分PCR产物琼脂糖凝胶电泳结果见图1A。
经过非变性聚丙烯酰胺丙烯酰氨凝胶电泳检测,在上述4个绵羊品种中共检测到三种基因型,分别命名为AA、GG和AG。分别将上述三种基因型的PCR产物纯化回收后进行测序,对测序结果进行比对分析发现绵羊miR-133基因位于13号染色体上,在其成熟序列下游g.54047535处有一个A>G突变,杂合子测序峰图表现为套峰。部分样品的SSCP和对应的测序结果见图1B和图1C。
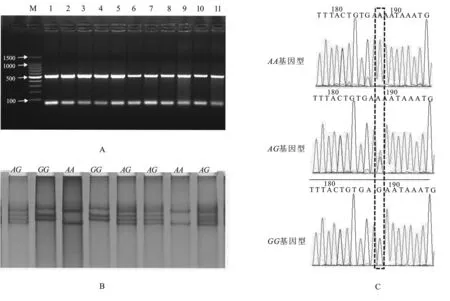
图1 部分PCR产物凝胶电泳图、非变性聚丙烯酰胺聚丙烯酰氨凝胶电泳图及测序峰图
A.gel electrophorogram of PCR agarophyte sugar, lane M is 100bp marker; lane 1~11 are PCR products.B.gel electrophorogram of AA,AG and GG polyacrylamides;C.sequencing peaks of various genetic samples,singlet peaks are AA and GG homo
zygotes,and set of peaks are AG heterozygotes
从表1可以看出,miR-133前体序列中g.54047535SNP位点的基因型频率和等位基因频率在不同产肉性能绵羊品种中存在明显的差异。特克赛尔羊是从国外引进的优良的肉样品种,肌肉丰满,产肉性能好,GG基因型频率和G等位基因频率分别达到77.8%和0.861,属于优势基因型,而阿勒泰羊和湖羊属于我国地方品种,产肉性能较差,中国美利奴细毛羊属于毛用羊品种,AA基因型属于优势基因型。遗传平衡分析表明,阿勒泰羊在该位点处于Hardy-Weinberg平衡状态(P>0.05),而特克赛尔羊处于不平衡状态(P<0.05),中国美利奴细毛羊和湖羊处于极不平衡状态(P<0.01),表明这两个群体受到杂交改良与选择的影响。
2.2 等位基因及基因型频率
PCR-SSCP分型后,利用SPSS 13.0软件计算g.54047535 位点SNP在4个绵羊品种中的等位基因频率和基因型频率,以及各基因型在群体中的遗传平衡性,结果见表1。
2.3 pri-miR-133序列的物种同源性分析
从UCSC(http://genome.ucsc.edu/)在线数据库中钓取绵羊、牛、马、人、猩猩、海豚、猪、鸡、猫、狗、大鼠、小鼠、兔pre-miR-133及其上游和下游各300 bp序列,使用DNAMAN6.0软件进行多序列比对,并绘制进化树(见图2)。结果表明, miR-133前体序列同源性可以精准地反映物种间的进化关系。miR-133的前体序列的同源性在人与猩猩(灵长目动物)、绵羊与牛(洞角科动物)中均高度保守,而人、猩猩、绵羊和牛等高等哺乳动物与小鼠、鸡等物种在进化上较远。但是以上各种物种的成熟miR-133序列均高度一致,提示miR-133在动物骨骼肌和心肌的正常生长发育中发挥着至关重要的作用。

表1 基因频率和基因型频率在不同品种绵羊中的分布以及Hardy-Weinberg平衡的卡方检验
2.4 SNP位点对miR-133前体构象及稳定性的影响
用RNAstructure软件对miR-133野生型和突变型前体序列构象进行预测,并通过能值△G的变化比较两种构象的稳定性,结果见图3。
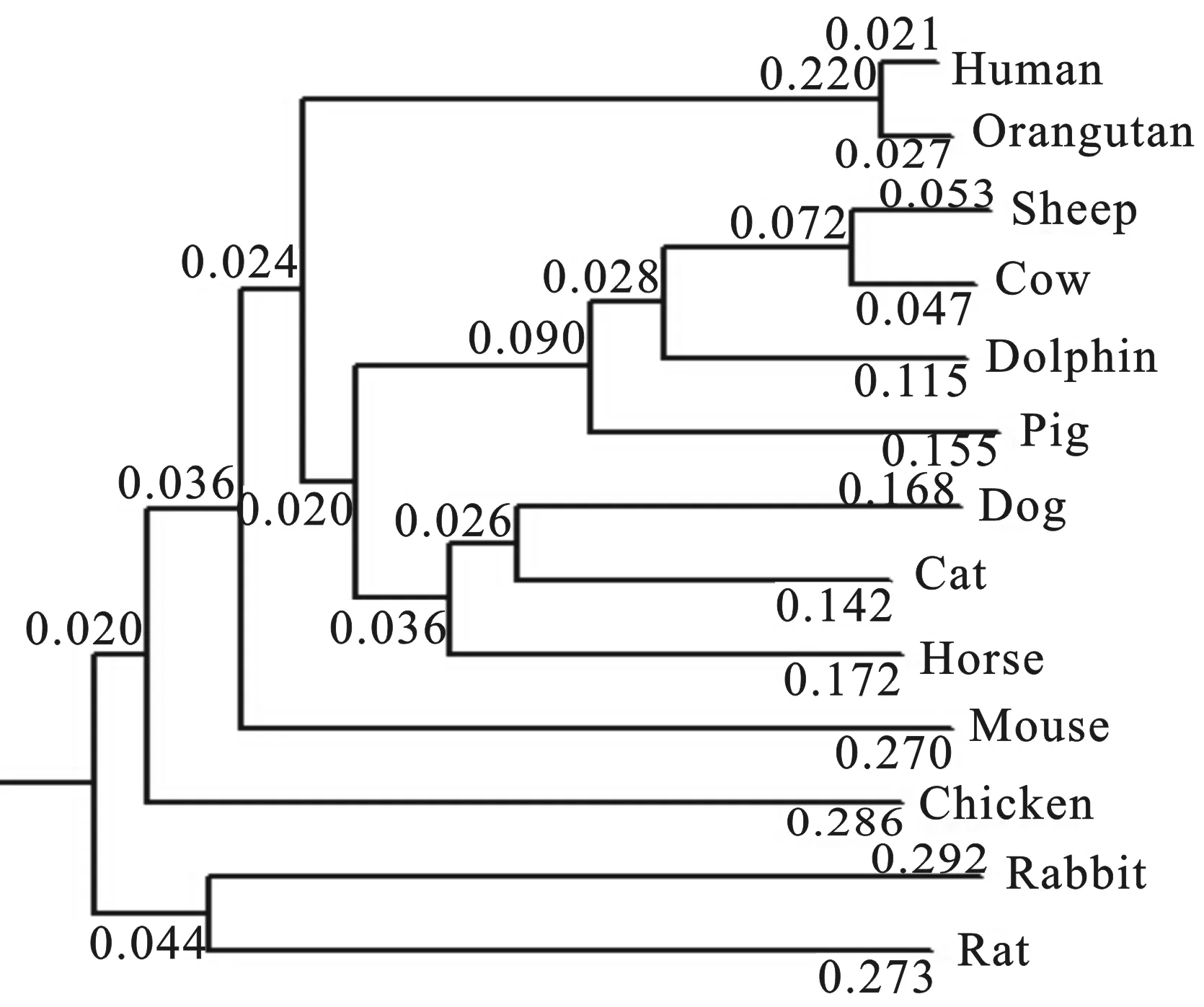
图2 miR-133前体序列在不同物种间的同源性及进化关系

图3 miR-133 g.54047535 SNP位点突变型(A)
由图3可知,当miR-133前体序列g.54047535位点由A突变为G后,使其构象发生明显改变,能值由原来的-44.3 kJ/mol,降低为-47.5 kJ/mol,结构更加稳定。同时,由于该突变位点发生在颈环结构的颈部,从而造成其构象的较大变化,这种构象的改变可能会影响到核酸内切酶Drosha和Dicer对前体序列的识别和切割加工,从而改变成熟miR-133的水平,并最终使其对靶基因的调控水平发生改变。
3 讨 论
miRNA通过调控其靶基因的表达,在动物肌肉发育过程中发挥着非常重要的作用。最典型的例子是特克赛尔(Texel)羊中miR-1和miR-206对肌肉生长抑制素基因(myostatin,MSTN)的调控。MSTN是肌肉细胞的自分泌因子,在动物骨骼肌中特异性表达并对肌肉的生长发育产生负调控作用[13]。特克赛尔羊MSTN基因mRNA的3'UTR区发生一处碱基突变,恰好成为miR-1和miR-206的靶位点,使MSTN基因的表达受到抑制,所以特克赛尔羊表现出典型的双肌性状[14]。miR-1和miR-133在哺乳动物的基因组中成簇排列,共同被转录,在动物的心肌和骨骼肌中特异表达[15]。miR-133通过调控其靶基因促进成肌细胞的增殖,对小鼠的研究表明,miR-133在胚胎期心肌和骨骼肌中的表达量较低,出生后表达量逐渐升高,直至成年阶段达到最大值并保持稳定[12]。成熟miRNA的表达水平会由于前体序列的改变而发生变化,如果这种序列变化发生在其"种子序列",则可能无法识别靶基因而失去对其的调控,或者产生新的靶基因,并最终引起性状的改变甚至发生疾病[7-16]。已有的研究结果表明,miRNA基因的突变主要发生在其成熟序列的上游和下游区域,而成熟序列在物种间高度保守[18-19],本文新发现的miR-133前体序列的突变发生在其成熟序列下游194 bp处,而在其成熟序列区域未发生突变,与上述研究结果相一致。
本研究发现的miR-133前体序列g.54047535位点的A>G突变,与绵羊的产肉性能存在明显的相关,特克赛尔羊是优良的肉样品种, G等位基因频率高达0.861,是A等位基因频率的6.19倍。阿勒泰羊属于脂肪沉积能力较强的品种,中国美利奴细毛羊属于毛用羊品种,湖羊的产肉性能均较差,该三品种绵羊属于典型的非肉用羊品种,均以AA基因型为优势基因型。对突变与野生型miR-133前体的二级进行生物信息分析,提示该突变位点可能会影响miR-133前体序列的加工,并使成熟miR-133水平提高,从而改变其对靶基因的调控,最终影响肌肉的生长发育。这推测已有数据支持,如Jun-Seong Lee等[17]在约克夏猪、兰德瑞斯猪和巴克夏猪群体中发现miR-133b g.72008C>T处的SNP与瘦肉率和肉质性状存在相关性,约克夏猪、兰德瑞斯猪中C等位基因频率分别为0.97和0.93,CC基因型属于优势基因型,而使用荧光实时定量PCR对不同基因型成熟miR-133b水平进行检测,结果表明TT基因型成熟miR-133b水平显著高于CC基因型。相比较Jun-Seong Lee发现的位置,所发现的miR-133突变更加靠近成熟的miR-133序列,对miR-133成熟体生物量的合成可能影响更大。
miRNA前体序列多态性研究是近几年miRNA研究的重要内容,已发现了大量与生长发育和疾病相关的SNP,并且可以通过NCBI dbSNP(http://www.ncbi.nlm.nih.gov/snp/),miRNA SNP(http://www.bioguo.org/miRNASNP/)等平台方便查询,对其功能的研究也在不断深入,同时也从另一个方面证实了miRNA的调控作用对生物性状表现的重要性,对miRNA调控机理的研究也将产生积极地推动作用。
[1] Bartel D P. MicroRNAs: target recognition and regulatory functions[J].Cell,2009,136:215-233.
[2] Lee Y, Ahn C,Han J,et al.The nuclear RNase III Drosha initiates microRNA processing[J].Nature,2003,425:415-419.
[3] Chekulaeva M, Filipowicz W. Mechanisms of miRNA-mediated post-transcriptional regulation in animal cells[J].Current Opinion Cell Biol,2009,21:452-460.
[4] Bartel D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J].Cell,2004,116:281-297.
[5] Sun G. MicroRNAs and their diverse functions in plants[J].Plant Mol Biol,2012,80:17-36
[6] Lewis B P, Burge C B, Bartel D P. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J].Cell,2005,120:15-20.
[7] Ryan B M, Robles A I, Harris C C. Genetic variation in microRNA networks: the implications for cancer research[J].Nature Review Cancer,2010,10:389-402.
[8] Dikeakos P, Theodoropoulos G, Rizos S, et al. Association of the miR-146aC>G, miR-149T>C, and miR-196a2T>C polymorphisms with gastric cancer risk and survival in the Greek population[J].Mol Biology Reporter,2014,41:1 075-1 080.
[9] Bensen J T, Chiu K T, Nyante S J, et al. Association of germline microRNA SNPs in pre-miRNA flanking region and breast cancer risk and survival: the Carolina Breast Cancer Study[J].Cancer Causes Control,2013,24:1 099-1 109.
[10] McDaneld T G, Smith T P L, Doumit M E,et al. MicroRNA transcriptome profiles during swine skeletal muscle development[J]. BMC Genomics,2009,10:77-87.
[11] McDaneld T G, Smith T P L, Harhay G P, et al. Next-generation sequencing of the porcine skeletal muscle transcriptome for computational prediction of MicroRNA gene targets[J].PLoS ONE, 2012,7(7): e42039.
[12] Chen J F, Mandel E M, Thomson J M, et al. The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation[J].Nature Genetics,2006,38(2):228-234.
[13] Rios R, Fernandez-Nocelos S, Carneiro I, et al. Differential response to exogenous and endogenous myostatin in myoblasts suggests myostatin acts as an autocrine factor in vivo[J].Endocrinology,2004, 145(6):2 795-2 803.
[14] Clop A, et al. A mutation creating a potential illegitimate microRNA target site in the myostatin gene affects muscularity in sheep[J].Nature Genetics,2006,38:813-818.
[15] Lagos Q M, Rauhut R, Yalcin A, et al. Identification of tissue-specific microRNAs from mouse[J]. Current Biology,2002,12:735-739 .
[16] Slezak-Prochazka I, Durmus S, Kroesen B J, et al. MicroRNAs, macrocontrol: regulation of miRNA processing[J].RNA,2010,16:1 087-1 095.
[17] Lee J S, Kim J M, Lim K S, et al. Effects of polymorphisms in the porcine microRNA MIR206/MIR133B cluster on muscle fiber and meat quality traits[J].Animal Genetics,2012,44:101-106.
[18] Liu Q P, Wang H, Zhu L Y, et al. Genome-wide identification and analysis of miRNA-related single nucleotide polymorphisms (SNPs) in rice[J].Rice,2013,6:1-10.
[19] Jing G J, Tong Y, Zhang H M, et al. Genome-Wide Identification of SNPs in MicroRNA Genes and the SNP Effects on MicroRNA Target Binding and Biogenesis[J].Human Mutation,2012,33:254-263.
Detection and Structure Prediction of Polymorphism at Skeletal Muscle-specific Pri-miRNA-133 among Different Sheep Breeds
SONG Guang-chao1,2, ZHANG Wei1,2, XU Rui-xia1,2, ZHAO Wei-li1,2, LIU Shou-ren1,2, GAN Shang-quan2*
(1.CollegeofAnimalScienceandTechnology,ShiheziUniversity,Shihezi832003,China;2.InstituteofAnimalHusbandryandVeterinary,XinjiangAcademyofAgriculturalandReclamationSciences,Shihezi,Xingjiang832000,China; )
To study the polymorphism of skeleton muscle-specific pri-miR-133 among different sheep breeds and analyze its correlation with the muscle phenotype, pri-miR-133 polymorphism among four breeds with different meat production performance (Texel, Chinese Merino Fine Wool, Altay and Hu Sheep), and the effects of the pri-miR-133b polymorphism on its secondary structure, stability and the capacity of mature miR-133 processing were detected and analyzed by PCR-SSCP. The result showed that there was a A/G transversion at 194 bp downstream of pre-miR-133b, and the SNP was clearly associated with its corresponding meat traits. In Texel flock, GG genotype was the preponderant genotype, and G allele frequency reached 0.86, the value of G allele frequency in Texel was four times the frequency of G allele in Chinese Merino flock. The Secondary structure further bio informatics analysis showed that the mutation significantly changed the secondary structure of pre-miR-133, and the free energy value was reduced by 3.2 KJ/mol. The above indicated that the SNP in pri-miR-133 may have a significant impact on the processing of mature miR-133, and affect the performance of sheep meat production.
pri-miRNA;pre-miRNA;miR-133;polymorphism; skeletal muscle; sheep
2014-07-21,
2014-09-23
国家自然科学基金地区基金(31160452、31060303);新疆农垦科学院引导计划(YYD2010-9)
宋广超(1990-),男,山东济宁人,硕士研究生,研究方向为动物生产学。E-mail:wosongtengchao@126.com
*[通讯作者] 甘尚权(1977-),男,安徽安庆人,副研究员,研究方向:绵羊分子育种设计。E-mail:shangquangan@163.com
S811.6
A
1005-5228(2015)01-0018-06
