注射用炎琥宁细菌内毒素检查方法的可行性研究
2015-09-11王爱红
王爱红


[摘要] 目的 研究注射用炎琥宁对细菌内毒素检查试验的干扰情况,建立其细菌内毒素限量及检查方法。 方法 按《中国药典》2010年版二部附录Ⅺ E进行实验,采用细菌内毒素凝胶法,用2个厂家的鲎试剂对3批注射用炎琥宁进行干扰试验和结果的判断。 结果 注射用炎琥宁最大不干扰浓度为0.33 mg/ml,即需要稀释240倍对测定不产生干扰。 结论 注射用炎琥宁细菌内毒素限值确定为0.75 EU/mg,可采用凝胶法应用鲎试剂进行细菌内毒素检查。
[关键词] 注射用炎琥宁;细菌内毒素;凝胶法;鲎试剂;干扰试验
[中图分类号] R286.0 [文献标识码] A [文章编号] 1674-4721(2015)08(c)-0095-03
[Abstract] Objective To study the interference to bacterial endotoxin test from Potassium Sodium Pehydroandrographolide Succinate for Injection,and estsblish a method of the limits and detection of bacterial endotoxin. Methods The experiment was performed according to Appendix Ⅺ E of Chinese Pharmacopeia (2010 edition,2 volume),interference experiment and result analysis were made in three batch samples of Potassium Sodium Pehydroandrographolide Succinate for Injection,in which bacterial endotoxin method of gelation assay was used by tachypleus amebocyte lysate (TAL) from two different manufacturers. Results The maximum noninterference concentration of Potassium Sodium Pehydroandrographolide Succinate for Injection was 0.33 mg/ml,which meaned the inhibition effect could be eliminated by diluting to 240 times. Conclusion The bacterial endotoxin test can be used to detect the endotoxins in Potassium Sodium Pehydroandrographolide Succinate for Injection and the bacterial endotoxin limit is 0.75 EU/mg.
[Key words] Potassium Sodium Pehydroandrographolide Succinate for Injection;Bacterial endotoxin;Gelation assay;Tachypleus amebocyte lysate;Interference test
注射用炎琥宁是由穿心莲内酯半酯单钾盐和适量的辅料组成的冻干制剂,具有促进发热的消退、增加机体对病原体感染的能力,有明显的镇静作用,临床常用于治疗病毒性肺炎和病毒性上呼吸道感染。
注射用炎琥宁的使用说明书根据国家食品药品监督管理局审核批准执行,静脉滴注,0.16~0.4 g/d,用0.5%葡萄糖氯化钠注射液稀释后滴注,其质量标准WS-B-10001-(HD-0016)-2002项下的热原检查法为家兔法。此法操作繁琐,不利于快速检测,因此本文依据《中国药典》2010年版二部Ⅺ E“细菌内毒素检查法”,利用鲎试剂对其冻干注射剂的细菌内毒素检查进行可行性的方法学研究,并给出细菌内毒素限值,为实验室对其质量进行快速并准确的检查提供依据。
1仪器与试药
1.1 仪器
数显式电热恒温水浴箱(上海跃进医疗器械公司,型号:HH·W21·420S);漩涡混合器(上海环球物化仪器厂,型号:WH-861)。实验所用的相关器皿均经250℃干燥1 h,以达到无外源性内毒素。
1.2 试药
注射用炎琥宁(安徽宏业药业有限公司,批号:150302、150304、150306、150308、150310、150312,规格:80 mg)。鲎试剂(湛江博康海洋生物有限公司,批号:1408300,规格:0.25 EU/ml,0.1 ml/支;福建新北生化有限公司,批号:14080912,规格:0.25 EU/ml,0.1 ml/支)。细菌内毒素工作标准品(中国食品药品检定研究院,批号:150601-201478,规格:80 EU/支)。细菌内毒素检查用水(湛江博康海洋生物有限公司,批号:1405130,规格:5 ml/支)。
2 方法与结果
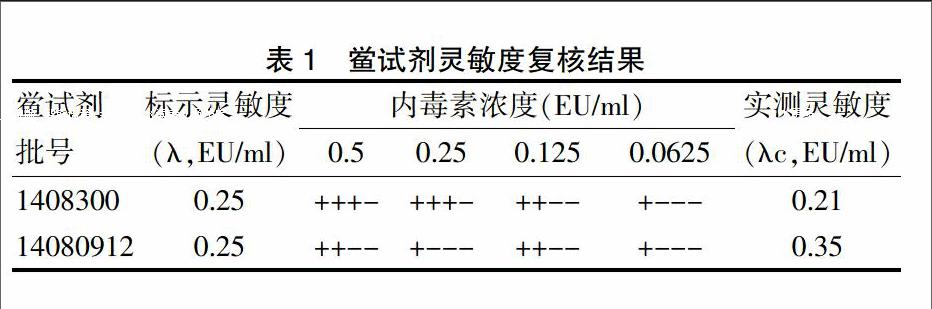
2.1 鲎试剂灵敏度的复核
为考察鲎试剂灵敏度的标示值(λ)是否准确、人员操作方法是否正确及实验条件是否符合规定,按《中国药典》2010年版二部附录Ⅺ E细菌内毒素检查法试验,对本实验所用2个厂家的鲎试剂进行灵敏度复核,要求所用的灵敏度在0.5λ~2.0λ之间。结果表明,上述2个厂家的鲎试剂均在灵敏度范围内,复核合格(表1),可以用于干扰试验和供试品的细菌内毒素检查。
2.2 细菌内毒素限值L的确定
根据细菌内毒素限值的计算公式:L=K/M,其中L为供试品细菌内毒素的限值,本品以EU/mg表示。K为按规定的给药途径,人用每公斤体重每小时最大可接受的内毒素的量,以EU/(kg·h)表示,其中注射剂,K=5 EU/(kg·h);M为每公斤每小时最大的药物剂量,以mg/(kg·h)表示,人均体重按60 kg计算。本品成人通常1~2次/d,静脉滴注160~400 mg,可根据年龄、症状适量增减,用药剂量限度为400 mg/d。按临床剂量1次400 mg炎琥宁计算,L=K/M=5 EU/(kg·h)/[400 mg/60(kg·h)]=0.75 EU/mg。
2.3供试品干扰试验预试验
应用上述2个厂家的鲎试剂,初步确定注射用炎琥宁的最大不干扰浓度。根据供试品L为0.75 EU/mg,取本品1瓶,加细菌内毒素检查用水5 ml使溶解,分别再用细菌内毒素检查用水稀释成20、120、240、480倍系列浓度的溶液,将20、120、240、480倍的系列溶液标记为供试品阴性对照(NPC);同时在20、120、240、480倍的系列溶液中加入等体积细菌内毒素工作标准品,制成2.0λ的内毒素标准溶液标记为供试品阳性对照(PPC);每个浓度平行做2支。另取2支鲎试剂加入2.0λ的内毒素标准溶液作为阳性对照(PC);2支加入检查用水作为阴性对照(NC)。当出现NPC为阴性,PPC为阳性时,则供试品在该稀释倍数下不干扰实验。结果表明,注射用炎琥宁对细菌内毒素检查有干扰,但可以通过稀释消除。初步确定注射用炎琥宁的最大不干扰浓度为0.33 mg/ml,即需稀释240倍以上,可在此浓度下进行正式的干扰试验(表2)。
2.4 供试品干扰试验
根据预实验的结果,在进行正式干扰试验时选择供试品最大不干扰浓度为0.33 mg/ml。取3批注射用炎琥宁,使用上述2个厂家灵敏度为0.25 EU/ml的鲎试剂,分别用稀释成0.33 mg/ml的供试品溶液将细菌内毒素工作标准品稀释成0.5、0.25、0.125、0.0625 EU/ml的系列细菌内毒素溶液,检测供试品在此浓度下是否对细菌内毒素检查存在干扰。每一浓度平行做4支,同时用供试品溶液作为2支NC,(37±1)℃下保温60 min后观察结果。经用2个厂家生产的鲎试剂进行正式干扰试验,结果Es在0.5λ~2.0λ范围内,Et在0.5 Es~2.0 Es的范围内,说明供试品在进行240倍稀释后已排除干扰作用,在此浓度下可以对注射用炎琥宁进行细菌内毒素检查(表3、表4)。
2.5供试品的细菌内毒素检查
取注射用炎琥宁6批,按《中国药典》2010年版二部附录ⅪE依法检查,按炎琥宁计算,每毫克炎琥宁中含内毒素的量应小于0.75 EU。在检查中,每批供试品做2支供试管NPC和2支供试管PPC,同时做2支PC和2支NC。结果表明,供试管和阴性管均为阴性,阳性管和供试品阳性管均为阳性,说明3批样品的细菌内毒素含量均小于0.75 EU/mg,符合规定(表5)。
3 讨论
细菌内毒素是革兰氏阴性杆菌生长或死亡时裂解出来的菌膜脂多糖成分。作为非肠道药物的质量控制,家兔法是传统的检查法。因兔试验法影响因素多,不能标准化。采用细菌内毒素法控制注射剂的产品质量是药品检验的发展趋势。本试验对采用细菌内毒素检查法控制注射用炎琥宁质量进行了可行性研究。在试验前,研究炎琥宁生产工艺的应用,笔者首先考察了原料溶媒注射用水和13个批次注射用炎琥宁中间体的热原(细菌内毒素)污染情况,结果表明注射用水和中间体的细菌内毒素均不超标,为注射用炎琥宁采用鲎试剂法控制其内毒素提供了研究基础。
注射用炎琥宁对不同厂家的鲎试剂可能存在不同的干扰程度,因此在干扰预试验中使用了2个厂家的鲎试剂进行凝胶法内毒素检查,结果表明2个厂家的鲎试剂检验结果一致,因此确定注射用炎琥宁的最大不干扰浓度为0.33 mg/ml,即稀释240倍。
正式的干扰试验用了2个厂家的鲎试剂(灵敏度为0.25 EU/ml),对3批经稀释240倍的注射用炎琥宁分别进行细菌内毒素的干扰试验,结果显示Es均在0.5λ~2.0λ范围,供试品均在0.5Es~2.0Es的范围,确认在此浓度下本品细菌内毒素与鲎试剂的反应试验无干扰作用。
在细菌内毒素限值确定为0.75 EU/mg的情况下,用2个厂家灵敏度为0.25 EU/ml的鲎试剂按凝胶法分别对6个批次供试品进行内毒素检查,结果均符合规定,表明注射用炎琥宁可采用鲎试剂进行细菌内毒素检查。
另外,注射用炎琥宁的细菌内毒素检查方法如下:取本品,依法检查(《中国药典》2010年版二部附录Ⅺ E),按炎琥宁计算,每毫克炎琥宁中含内毒素的量应小于0.75 EU。根据此法建立的细菌内毒素检查法是可行的,且方便快速,结果准确可靠。
[参考文献]
[1] 中华人民共和国药典委员会.国家药品监督管理局国家药品标准[S].WS-B-10001-(HD-0016)-2002,2002:109-110.
[2] 国家药典委员会.中国药典二部[M].北京:中国医药科技出版社,2010:附录99-102.
[3] 中国药品生物制品检定所.中国药品检验标准操作规程[M].北京:中国医药科技出版社,2005:310-325.
[4] 国家食品药品监督管理局药品认证管理中心.药品GMP指南——质量控制实验室与物料系统[M].北京:中国医药科技出版社,2011:258-259.
[5] 王蓓蓓.双黄连注射液细菌内毒素检查法的可行性考察[J].海峡药学,2007,19(8):70-71.
[6] 陈红英.注射用复方甘草酸苷细菌内毒素检查方法的研究[J].中国医药导报,2010,7(1):62-63.
[7] 施震,尹银嘉,李华.注射用头孢替唑中细菌内毒素的检测[J].中国药学杂志,2003,38(5):377-379.
[8] 王宗春,唐开勇,马福旺.鲎试剂方法检测岩黄连注射液中细菌内毒素[J].中国医院药学杂志,2005,25(4):371-372.
[9] 黄捷,王炳,崔志伟.细菌内毒素检查法与热原检查法[J].科技资讯,2006,(4):159-160.
[10] 杨忠思,吴振军,杜滨.热原和细菌内毒素检查研究进展[J].医学综述,2005,11(2):142-144.
[11] 黄清泉,王思理.浅谈药品细菌内毒素的定量测定[J].中国药房,1998,9(1):40-41.
[12] 王彦厚.细菌内毒素检查方法建立中应注意的几个问题[N].新药注册临床信息快讯,2007:43-44.
[13] 王贵英.氯解磷定注射液细菌内毒素检查法的建立[J].中国药房,2011,22(45):4288-4289.
[14] 田光彩.清开灵注射液细菌内毒素检查的可行性探讨[J].中国药师,2005,8(5):430-431.
[15] 吴卫中.注射用阿奇霉素细菌内毒素检查方法的研究[J].中国药事,2007,21(4):260-261.
[16] 王娅玲,肖华.注射用头孢噻肟钠细菌内毒素检查方法研究[J].安徽中医学院,2004,23(5):49-50.
[17] 童立年.注射用盐酸兰地洛尔的细菌内毒素检查法[J].中国药业,2008,17(24):29.
[18] 热孜亚.注射用奥沙利铂细菌内毒素检查法的实验研究[J].西北药学杂志,2008,23(6):383-384.
[19] 李展,周继春.注射用硫普罗宁细菌内毒素检查法的建立[J].中国药品标准,2012,13(3):203-205.
[20] 代秀梅,于风平.氟马西尼注射液细菌内毒素检查方法的建立[J].中国药房,2014,25(21):2003-2004.
[21] 国明,祝清芬,郑力真.无菌、微生物限度及细菌内毒素检查方法学验证中常见问题及分析[J].中国药品标准,2008,9(1):46-49.
(收稿日期:2015-03-31 本文编辑:卫 轲)
