四级杆串联质谱分析苄嘧磺隆污染蟾蜍耳后腺中蟾蜍甾烯水平
2015-09-11周婧王洪兰马宏跃闫文丽龚艳钱琎段金廒吴启南
周婧 王洪兰 马宏跃 闫文丽 龚艳 钱琎 段金廒 吴启南
摘 要 研究了除草剂苄嘧磺隆皮肤接触污染对中华大蟾蜍分泌蟾酥化学品质的影响。蟾酥样品经甲醇提取,以乙腈-1%甲酸水溶液为流动相,液相色谱(反相C18柱)分离\, 串联质谱(LC-MS/MS)分析检测。质谱条件为:MRM模式,脱溶剂温度500℃,碰撞电压30 eV,锥孔电压为30 V。结果表明,建立的LC-MS/MS测定方法对6种蟾蜍甾烯标准物质的检出限为0.42~4.86 ng/mL,相关系数R2=0.9953~0.9992,日内和日间RSD为3.8%~6.8%和4.0%~8.8%;加样回收率为96.9%~109.6%,相对标准偏差为2.0%~8.1%。应用此方法检测了36种蟾蜍甾烯化合物,有20余种化合物自身质谱积分面积在苄嘧磺隆污染前后发生改变,苄嘧磺隆皮肤接触污染可以改变蟾蜍耳后腺蟾蜍毒素的表达模式。本方法可应用于蟾蜍甾烯类物质检测。
关键词 中药资源学; 蟾蜍; 苄嘧磺隆; 蟾酥
1 引 言
蟾酥为中华大蟾蜍Bufo bufo gargarizans Cantor或黑眶蟾蜍Bufo melanostictus Schneider耳后腺的干燥分泌物。以往研究显示,蟾酥化学质量差异较大[1,2],不同产地商品中蟾蜍甾烯类成分含量相差数倍至数十倍。其原因除了遗传因素外,环境影响尤为重要。据调查,中药材蟾酥主要来自于野生蟾蜍,蟾蜍皮肤具有通透性,对环境重金属、农药、生活(工业)污水敏感[3],是环境科学研究的前哨物种。污染物能在蟾蜍体内蓄积和放大,但是污染物对蟾蜍耳后腺分泌物形成的影响研究甚少。
蟾酥主要含有强心苷类蟾蜍甾烯化合物,其含量测定方法大体可分为有LC-UV和LC-MS两类。MS在蟾蜍甾烯定性鉴别和定量灵敏度方面均显著优于UV方法。已有学者采用Q-TOF和LTQ-Orbitrap对多种蟾蜍甾烯的质谱二级裂解模式进行特征和含量分析[3~10]。在此基础上,本研究采用四级杆串联质对蟾酥中36种蟾蜍甾烯进行检测,以质谱积分面积表示每种蟾蜍甾烯化合物在不同样本组间的相对含量(化合物自身比较),并结合数学模式识别方法,评估苄嘧磺隆污染前后蟾蜍分泌蟾酥化学性质的变化。2 实验部分
2.1 仪器与材料
Waters Xevo-TQ 三重四极杆质谱仪, 配备Acquity UPLC 系统(包括四元泵溶剂系统、在线脱气机和自动进样器), 同时配有Waters Masslynx V4.1数据工作站 (美国Waters 公司); 低温超高速离心机(美国Thermo公司);离心浓缩仪、冷冻干燥仪(Labconco公司);EPED超纯水系统(南京易普达易科技发展有限公司);电子分析天平(上海精密仪器厂); 蟾蜍甾烯标准品Cinobufotalin,Resibufagenin,Gamabufotalin,Hellebrigenin,Cinobufagin 和Bufotalin按文献[1]报道方法分离制备,高效液相色谱鉴定纯度大于95%;苄嘧磺隆(丁贝生物公司)。中华大蟾蜍(捕于南京周边)。
2.2 苄嘧磺隆污染蟾蜍的分组与取样
中华大蟾蜍30只, 产地为江苏省,均分成3组,组间个体无显著差异。配制苄嘧磺隆低剂量组(0.15 g/L),高剂量组(0.3 g/L)及正常组(0 g/L)。中华大蟾蜍饲养在含或不含苄嘧磺隆的水溶液中。用分析天平称取苄嘧磺隆0.15和0.30 g,加到1 L盛有隔夜自来水的烧杯中,搅拌,使之充分溶解。待蟾蜍取食完毕后,将上述配好的药液倒入蟾蜍培养箱中,培养2天后,倒掉培养箱中原液,把培养箱冲洗干净,给蟾蜍喂食,待取食完毕后,加入药液,如此反复,培养半个月。抓取蟾蜍,称体重。用包裹胶布的镊子挤压蟾蜍耳后腺,使蟾酥喷溅到载玻片上,将鲜酥刮至EP管中,冷冻干燥,记录冻干前后蟾酥的重量。
2.3 供试品溶液的制备
将干燥后的蟾酥样本于研钵中研磨成粉末(未过筛),每个样本准确称取10 mg,置于玻璃试管中,分别准确加入5 mL甲醇,保鲜膜封口,超声提取30 min,冷却后经0.22 μm滤膜过滤,作为供试品溶液。
2.4 色谱/质谱条件
ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm, 1.7 μm); 柱温35.0℃;流速0.4 mL/min; 进样量5 μL;流动相A为0.1%甲酸溶液,流动相B为乙腈;梯度洗脱程序: 0~2 min, 20%~30% B; 2~6 min, 30%~35% B; 6~9 min, 35%~60% B; 9~10 min, 60%~95% B; 10~11 min, 95% B; 11~11.20 min: 95%~20% B。
离子源为电喷雾离子源(ESI),正离子模式检测;质量扫描范围为 MS1:20~1974 Da,MS2:2~2048 Da;扫描速率为 M1:100~2000 amu/s,M2:100~10000 amu/s;毛细管电压为3.00 kV;锥孔电压为30.00 V;离子源温度为150℃;脱溶剂气体流速为998 L/h;脱溶剂温度500℃。参照文献[8~15]总结蟾蜍甾烯化合物的分子离子和子离子,经UPLC-MS/MS预测,选取36种化合物(表1),其响应较强、干扰较小的两对子离子可用于定性分析,目标化合物检测离子对碰撞电压(CE)统一设置为30 eV,可以满足蟾酥生药中蟾蜍甾烯的测定。
2.5 数据处理
采用Waters公司的MarkerLynx XS软件进行数据的组间比较,用偏最小方差判别分析(PLS-DA)模型对正常对照组和污染组进行模式识别,利用有监督的OPLS-DA模型排除与样品分类无关的信息,得到变量权重值(Variable important in projection,VIP)。标记的为VIP>1的变量,具有统计学意义,其中p[1]绝对值越大,对组间差异的贡献度越大;p(corr)绝对值越大,分析结果的置信度越高。同时筛选含量差异为1.5倍以上的甾体物质为组间差异标志物。实验数据以均数±标准差(±s)表示。3 结果与讨论endprint
3.1 蟾蜍甾烯类化合物的质谱检测
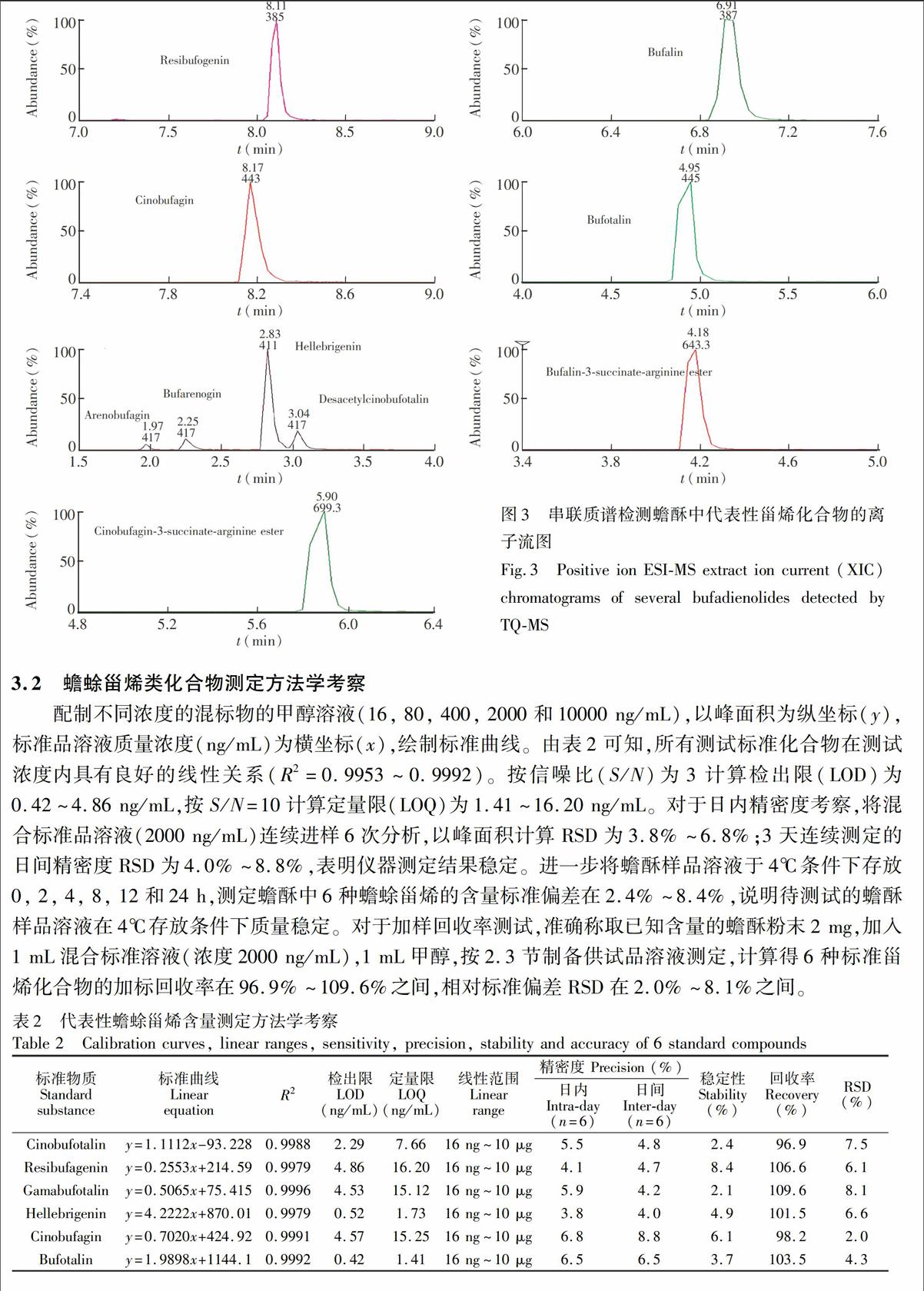
采用多反应检测模式(MRM)对蟾酥中蟾蜍甾烯水平进行测定。蟾蜍甾烯在阳离子模式下的质谱信号相应优于阴离子模式。基于文献报道[3~7]和本研究组研究确证,共收集了30余种蟾蜍甾烯类化合物的离子对信息用于MRM模式检测(表1)。蟾蜍甾烯类化合物具有相同的6-元内酯环甾体母核,母核上有羟基、醛基、环氧基、乙酰基等基团取代,在二级质谱碎裂时产生有规律性的裂解特征。图1是UPLC-Q-TOF测定蟾酥总离子流图,图2为蟾酥中含量较高3种质控成分质谱二级碎裂图谱。如Resibufogenin,[M+H]+ 385, [M+H-H2O]+ 367, [M+H-2H2O]+ 349,[M+H-2H2O-C5H4O2]+ 253;Cinobufagin,[M+H]+ 443,[M+H-CH2CO]+ 401,[M+H-HOAc]+ 383,[M+H-HOAc-H2O]+ 365,[M+H-HOAc-2H2O]+ 347。3种蟾蜍甾烯MS/MS图均显示,母离子脱去H2O (18 Da)和CO (28 Da) 是一种显著的裂解特征;当蟾蜍甾烯存在乙酰基取代时,母离子可以脱去HOAC (60 Da) 或C5H4O2。使用不同的离子对信息(母离子/子离子)可以区分蟾蜍甾烯化合物;对于具有相同离子对信息的物质,根据其色谱保留时间不同,进一步区分。图3为蟾酥中代表性化合物的离子流提取色谱图。
3.2 蟾蜍甾烯类化合物测定方法学考察
配制不同浓度的混标物的甲醇溶液(16, 80, 400, 2000和10000 ng/mL),以峰面积为纵坐标(y),标准品溶液质量浓度(ng/mL)为横坐标(x),绘制标准曲线。由表2可知,所有测试标准化合物在测试浓度内具有良好的线性关系(R2=0.9953~0.9992)。按信噪比(S/N)为3计算检出限(LOD)为0.42~4.86 ng/mL,按S/N=10计算定量限(LOQ)为1.41~16.20 ng/mL。对于日内精密度考察,
将混合标准品溶液(2000 ng/mL)连续进样6次分析,以峰面积计算RSD为3.8%~6.8%;3天连续测定的日间精密度RSD为4.0%~8.8%,表明仪器测定结果稳定。进一步将蟾酥样品溶液于4℃条件下存放0, 2, 4, 8, 12和24 h,测定蟾酥中6种蟾蜍甾烯的含量标准偏差在2.4%~8.4%,说明待测试的蟾酥样品溶液在4℃存放条件下质量稳定。对于加样回收率测试,准确称取已知含量的蟾酥粉末2 mg,加入1 mL混合标准溶液(浓度2000 ng/mL),1 mL甲醇,按2.3节制备供试品溶液测定,计算得6种标准甾烯化合物的加标回收率在96.9%~109.6%之间,相对标准偏差RSD在2.0%~8.1%之间。
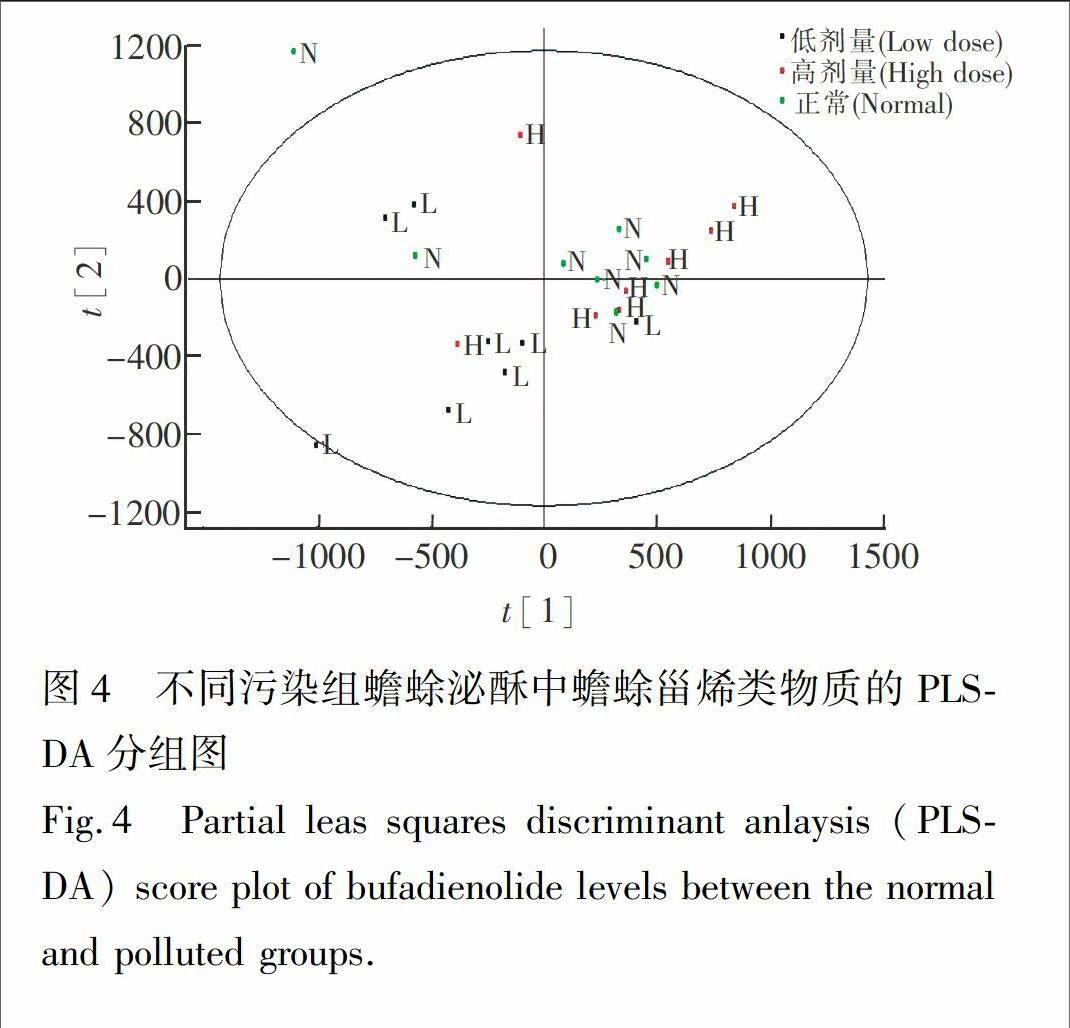
3.3 不同浓度苄嘧磺隆污染对中华大蟾蜍分泌蟾酥的化学质量的影响
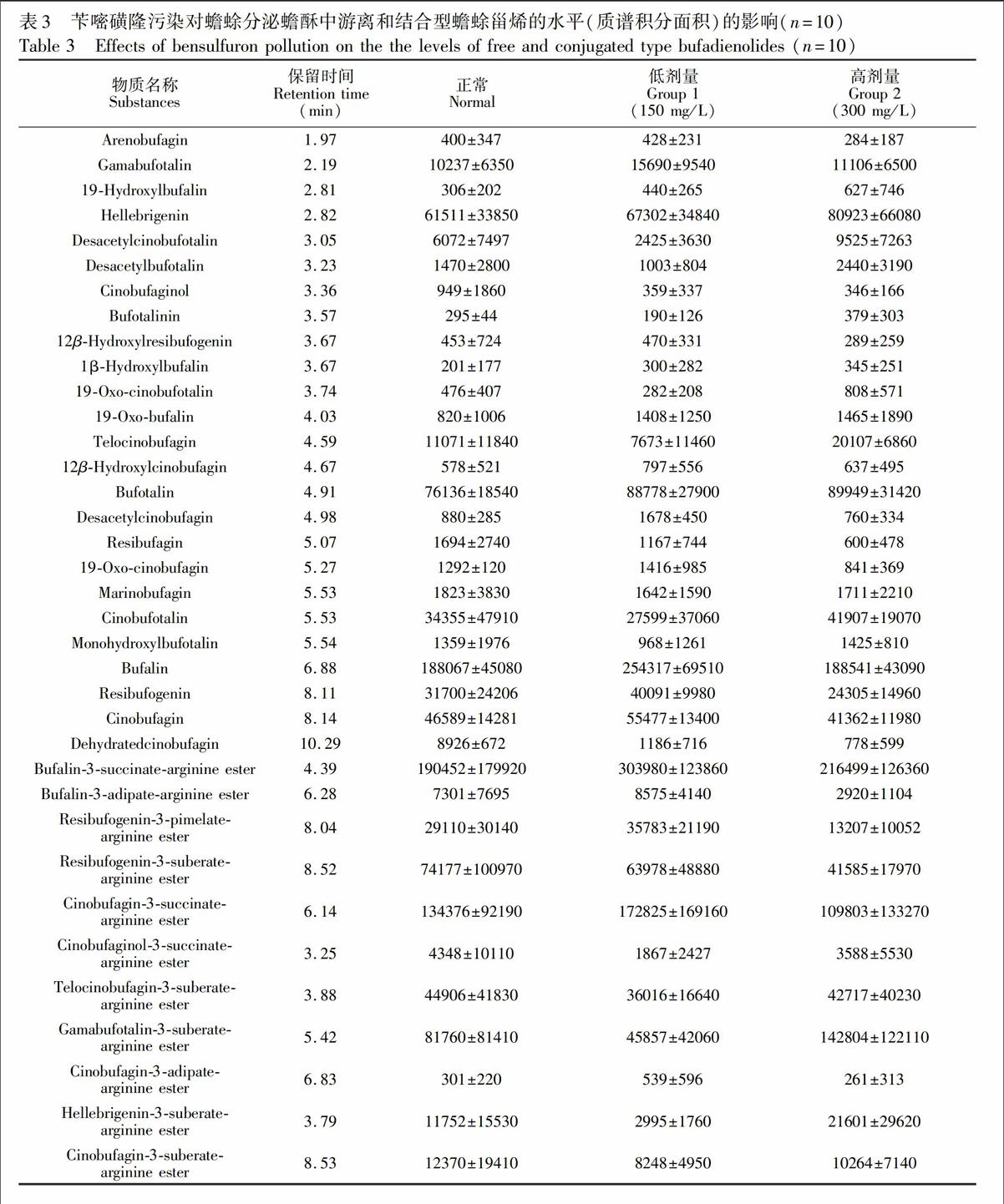
在上述色谱-质谱条件下,蟾蜍甾烯通过质谱响应的积分面积进行相对定量(表3)。与正常组相比较,苄嘧磺隆污染组的蟾蜍分泌蟾酥的化学质量明显不同,苄嘧磺隆低剂量组中,7种游离型蟾蜍甾烯、2种结合型蟾蜍甾烯水平发生1.5倍上调,6种游离型蟾蜍甾烯、3种结合型蟾蜍甾烯的水平发生1.5倍下调。在苄嘧磺隆高剂量组,9种游离型蟾蜍甾烯、2种结合型蟾蜍甾烯水平发生1.5倍上调,3种游离型蟾蜍甾烯、4种结合型蟾蜍甾烯的水平发生1.5倍下调。
将上述不同组别的蟾蜍甾烯的含量数据导入MassLynx V4.1 software (Waters Corp., Milford, USA)软件,进行数据的主成分分析(PCA)、偏最小二乘法-判别分析(PLS-DA)。由于蟾蜍耳后腺分泌的蟾酥的化学质量存在较大的组内差别,采用无监督的PCA方式不能对正常组蟾酥和苄嘧磺隆污染组蟾酥进行组间的分离。进一步采用有监督的PLS-DA统计方法进行了组间的区分(图4)。其中变量权重值(Variable important in projection,VIP)>1的变量,具有统计学意义,其中p[1]绝对值越大,对组间差异的贡献度越大;p(corr)绝对值越大,分析结果的置信度越高,同时变量指标平均含量差异发生1.5倍以上改变的甾体物质为组间差异标志物,总计16种差异标志物。可见,苄嘧磺隆污染会使蟾蜍毒素的表达模式发生改变。
4 结 论
蟾蜍耳后腺的分泌物是蟾蜍受到外界刺激,合成并分泌的具有自我保护作用的毒性物质。作为常用抗肿瘤中药,其化学质量波动常影响临床用药的有效性与安全性。采用建立的蟾蜍甾烯质谱检测方法对不同剂量除草剂苄嘧磺隆污染蟾蜍的蟾酥质量评价。结果表明,正常组和苄嘧磺隆组中大部分甾烯类物质可以被定性检测和相对定量分析,苄嘧磺隆污染组中多种蟾蜍甾烯表达模式出现明显改变,进一步加大了蟾酥的质量不稳定性,增加用药风险。虽然苄嘧磺隆污染影响蟾蜍甾烯表达的原因尚不清楚,推测苄嘧磺隆可能抑制或刺激了蟾蜍耳后腺中合成蟾蜍甾烯的相关酶系,使得蟾蜍甾烯生物合成受到影响。总之,本文所建立的四级杆串联质谱测定蟾蜍甾烯类成分的方法具有灵敏、快速、稳定的特点,能有效满足不同条件下蟾蜍耳后腺分泌物中蟾蜍甾烯成分的质量评价要求。
References
1 Zhang P,Cui Z, Liu Y, Wang D, Liu N, Yoshikawa M. Chem. Pharm. Bull., 2005, 53(12): 582-586
2 Ye M,Guo H Z, Han J, Guo D A. J. Chromatogr. B, 2006, 838(2): 86-95
3 DONG Ai-Hua, JIA Xiu-Ying, MA Xiao-Mei. Chinese J. Zoology, 2003, 38(6): 24-27endprint
董爱华, 贾秀英, 马小梅. 动物学杂志, 2003, 38(6): 24-27
4 Ye M,Guo D A. Rapid Commun. Mass. Spectrom., 2005, 19(13): 1881-1892
5 HE Jing, LI Yan, SI Nan, ZHAO Hai-Yu, BIAN Bao-Lin, WANG Hong-Jie. Acta Pharm. Sin., 2014, 49(10): 1446-1450
贺 晶, 李 艳, 司 南, 赵海誉, 边宝林, 王宏洁. 药学学报, 2014, 49(10): 1446-1450
6 Jing J, Ren WC, Li C, Bose U, Parekh HS, Wei MQ. Biomed. Chromatogr., 2013, 27(6): 685-687
7 Hu Y, Yu Z, Yang Z J, Zhu G, Fong W. J. Pharm. Biomed. Anal., 2011, 56(2): 210-220
8 Wang Y M, Li Z Y, Wang J J, Wu X Y, Gao H M, Wang Z M. J. Asian Nat. Prod. Res., 2015, 17(4): 364-76
9 Wang S, Peng C, Jiang P, Fu P, Tao J, Han L, Huang H, Chang W, Li L, Zhang W, Liu R. J. Chromatogr. B, 2014, 15(967): 255-63
10 HAN Ling-Yu, SI Nan,LIU Jun-Qiu, ZHAO Hai-Yu, YANG Jian, BIAN Bao-Lin, WANG Hong-Jie. Acta Pharm. Sin., 2014, 49(2): 244-248
韩玲玉, 司 南, 刘俊秋, 赵海誉, 杨 健, 边宝林, 王宏洁. 药学学报, 2014, 49(2): 244-248
11 Li X,Guo Z, Wang C, Shen A, Liu Y, Zhang X, Zhao W, Liang X. J. Pharm. Biomed. Anal., 2014, 92: 105-113
12 Gao H,Zeh M, Leitner A, Wu X, Wang Z, Kopp B. J. Ethnopharmacol., 2010, 131(2): 368-76
13 Ma H, Zhou J, Shang E, Zhang J, Lu W, Zhan Z, Qian D,Duan J, Fan X. Toxicol. In Vitro., 2013, 27(1): 396-401
14 Li X,Guo Z, Wang C, Shen A, Liu Y, Zhang X, Zhao W, Liang X. J. Pharm. Biomed. Anal., 2014, 92: 105-113
15 Jing J, Ren W C, Li C, Bose U, Parekh H S, Wei M Q. Biomed. Chromatogr., 2013, 27(6): 685-687endprint
