超高效液相色谱—荧光法测定番石榴中多菌灵农药残留
2015-09-11李盛安冯敏铃
李盛安+冯敏铃
摘要 建立了超高效液相色谱(UPLC)对番石榴中多菌灵(MBC)残留的分析方法。番石榴经乙腈提取后,MCX小柱净化,荧光检测器测定,外标法定量;对样品前处理和色谱分离条件进行优化。通过比较QuEChERS法与加速溶剂萃取ASE 2种提取方式,对比NH2和MCX固相萃取柱净化效果,确定番石榴中多菌灵的检测方法。结果表明:多菌灵含量在0.01~0.50 μg/mL间呈良好的线性关系,相关系数r=0.999 9。添加0.05~1.00 μg/mL浓度,平均回收率在84.6%~93.5%,方法最低检出限为0.004 mg/kg,方法定量限为0.020 mg/kg。方法具有前处理简单、准确性高、经济、分析速度快等特点,适合在番石榴大规模上市前集中批量快速检测。
关键词 多菌灵残留;超高效液相色谱;荧光检测器;MCX小柱;番石榴
中图分类号 S481+.8 文献标识码 A 文章编号 1007-5739(2015)14-0116-02
番石榴营养丰富,VC含量极高,果实具有治疗糖尿病及降低血糖的药效,叶片也可以治疗腹泻。果实除了能鲜食外,还可加工成果汁、浓缩汁、果粉、果酱、浓缩浆、果冻等[1-2]。由于种植番石榴可获得较好的经济效益,其在珠江三角洲地区种植面积广,已成为广大农民发家致富的一条有效途径。
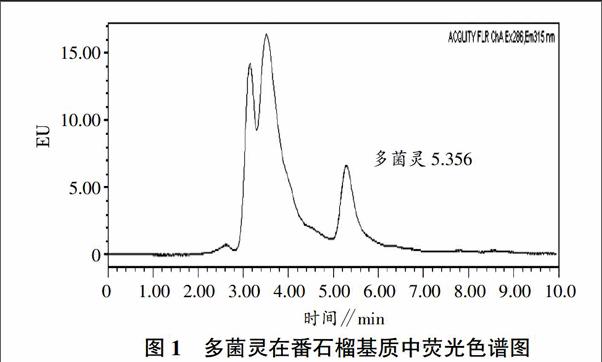
多菌灵又名棉萎灵、苯并咪唑44号,化学名2-苯并咪唑基氨基甲酸甲酯,是一种广谱性杀菌剂,广泛应用于蔬菜、水果等多种病害的防治[3-6]。农户常用多菌灵农药来预防番石榴炭疽病,多菌灵农药目前还未列入农业行政主管部门的例行监测项目,且大型农贸批发市场农残快速检测试剂盒只针对果蔬中有机磷和氨基甲酸酯类农药的检测。因此,开发一种快速简单检测多菌灵农药残留的方法迫在眉睫。本试验使用超高效液相色谱议UPLC进行检测,采用了小内径柱,柱效提高,有更好的分离效果,多菌灵保留时间为5.356 min。通过简化样品前处理过程、选择合适的固相萃取小柱及流动相,以达到回收率高、检出限低的要求,本方法具有简单、重复性好的特点,且荧光检测器响应值高,定性、定量准确,满足批量样品检测的工作要求,可在番石榴大规模上市前应用。
1 材料与方法
1.1 试验材料
1.1.1 试剂。多菌灵标样(农业部环境保护科研监测所100 μg/mL);乙腈、甲醇(德国merck色谱纯);盐酸、无水硫酸钠、氨水、磷酸二氢钠、磷酸氢二钠、无水硫酸镁、醋酸 (广州化学试剂厂 GR);癸烷磺酸钠(阿拉丁GR);磷酸、三乙胺(天津市科密欧 HPLC);PSA(N-丙基乙二胺)、石墨炭黑(美国Agilent);离子对试剂:吸取7.0 mL磷酸于200 mL水中,加入1.0 g癸烷磺酸钠,超声溶解,再加入10.0 mL三乙胺,稀释到1 000 mL;磷酸盐缓冲溶液(0.02 mol/L,pH值6.8):1.38 g磷酸二氢钠和1.41 g磷酸氢二钠溶于900 mL水中,用磷酸调节pH值至6.8,定容至1 000 mL。
1.1.2 仪器与设备。电子天平(Precisa公司);旋涡混合器(上海精科实业有限公司XW-80A);振荡摇床(IKA KS501);pH计(Sartorius PP-20-P11);氮吹仪(天津恒奥 HGC-24A);离心机(Sigma公司3-30k);Waters超高效液相色谱仪(带荧光检测器);分散机(德国IKA T18);加速溶剂萃取ASE(DIONEX ASE100);超纯水器(Millipore公司Mini-Q);固相萃取柱:NH2小柱(Agilent 500 mg,6 mL);MCX小柱(Waters 150 mg,6 mL)
1.2 试验方法
1.2.1 样品处理。将番石榴四分法切碎后置于食品搅拌机中打浆,用塑料样品瓶-18 ℃密封保存。
1.2.2 提取。准确称取试样25.00 g(精确至0.01 g)于100 mL具塞离心管中,放入陶瓷均质子(防止盐结块),加入约5 g无水硫酸钠,再加入25 mL乙腈,盖上盖子,在摇床上振摇20 min后取出。以5 000 r/min的转速离心5 min,使乙腈和水分层。吸取5 mL乙腈提取液在50 ℃氮吹仪吹至近干,备用。
1.2.3 净化。往吹至近干的试管中加入5 mL 0.1 mol/L盐酸漩涡溶解残渣2 min后,分2次待过柱。将MCX小柱依次用3 mL甲醇、3 mL水进行预洗,待液面到达填料表面时,迅速加入提取液,再用3 mL水、3 mL甲醇淋洗不收集。最后用3 mL 5%氨水-甲醇溶液洗脱,重复1次,挤干,收集。50 ℃氮吹仪吹至近干后,用1.0 mL流动相溶解,过0.2 μm滤膜,待测。
1.2.4 标准溶液配制。取1支多菌灵标准品,全部转移至10 mL容量瓶中,用甲醇定容至刻度,摇匀。相当于浓度为10.00 μg/mL多菌灵标准储备液,然后置于-18 ℃条件下保存,有效期为1个月。标准工作溶液,用流动相定容现配现用,相当于多菌灵浓度分别为0.01、0.05、0.10、0.20、0.50 μg/mL。
1.2.5 色谱条件。色谱柱:Agilent ZORBAX SB-C18 2.1×150 mm 3.5 μm;流动相:甲醇∶水(v/v)=6∶4;流速0.2 mL/min;检测波长:荧光FLR激发波长286 nm、发射波长315 nm;进样量10 μL。
2 结果与分析
2.1 流动相选择
本试验分别考查了甲醇+癸烷磺酸钠离子对试剂溶液(40+60)、乙腈+水(50+50)、甲醇+水(60+40)、乙腈+磷酸盐缓冲溶液(80+20)作为流动相对多菌灵的分离效果。试验结果表明,上述几种流动相都能分离多菌灵,而考虑到对环境的影响因素和配制过程的复杂程度,选择毒性相对较小、价格便宜且配制过程简单的甲醇+水(60+40)作为流动相,多菌灵在番石榴基质中的超高效液相色谱图如图1所示。endprint
2.2 固相萃取柱的选择
分别选取6 mL的NH2小柱与MCX小柱做加标回收试验,将NH2与MCX小柱进行对比,同时每种小柱做3个平行,选择平均回收率高的作为净化柱,NH2小柱净化方法如下:按上述1.2.2步骤后,往吹至近干的试管加入2 mL甲醇+二氯甲烷(1+99)漩涡溶解残渣2 min后,待过柱。将NH2小柱用3 mL甲醇+二氯甲烷(1+99)进行预洗,当溶剂液面到达柱子吸附层表面时,迅速加入提取液,再用3 mL甲醇+二氯甲烷(1+99)淋洗,重复1次,挤干,收集。在用50 ℃氮吹仪吹至近干后,用1.0 mL甲醇溶解,过0.2 μm滤膜,待测。
结果表明:NH2小柱平均回收率接近65%,MCX小柱平均回收率则接近90%,因此,选择MCX小柱作为净化小柱。
2.3 样品前处理的选择
本试验前处理方法与加速溶剂萃取ASE进行加标回收提取效率比较,提取液氮吹近干后,按上述1.2.3步骤操作。结果表明:本试验方法与加速溶剂萃取ASE回收率都大于80%,皆可以作为多菌灵的提取方法。但考虑到加速溶剂萃取ASE操作复杂、萃取池少、需要定时更换仪器消耗品等特点,难以满足快速批量检测的需要。最后选择乙腈振荡提取,适合样品量大,能快速筛查,满足了批量检测的工作要求。
2.4 固相萃取与QuEChERS的比较
QuEChERS是一种简单快速的样品提取和净化方法,多用于水果蔬菜中的多农药残留检测[7-12]。对比试验设计如下:称5 g加标质控样品于50 mL试管中,依次加入5 g无水硫酸钠、1.5 mL醋酸、20 mL乙腈,振荡摇床上振摇20 min取出,5 000 r/min离心5 min。取出乙腈提取液10 mL加入1 000 mg无水硫酸钠、300 mg PSA(N-丙基乙二胺)、50 mg石墨炭黑旋涡混合5 min,5 000 r/min离心3 min。上清液过0.2 μm滤膜,待测。结果表明,经QuEChERS方法前处理后供色谱上机分析时,干扰物质较多,样品分析基线分离不理想,目标峰难以积分,不能准确地定性、定量,容易出现假阳性。QuEChERS方法前处理简单,净化后多供GC/MS或LC/MS分析[9-15]。由于质谱分析法是对样品离子质荷比(m/z)的测定来进行分析的一种分析方法,定性的准确度要高于色谱分析。但由于GC/MS与LC/MS价格昂贵、操作复杂、维护成本高等特点不容易普及,因此本试验超高效液相色谱法不采用QuEChERS方法做前处理方法。
2.5 方法标准曲线、检出限及定量限
用不含多菌灵的番石榴空白溶液作基质,以峰面积为纵坐标,以标准溶液浓度为横坐标绘制标准曲线。求得线性方程y=2 941 333x-19 929.5,相关系数r=0.999 9。按本方法测定的结果,以3倍信噪比确定多菌灵分析物的检出限(S/N=3)为0.004 mg/kg,10倍信噪比定量限(S/N=10)为0.020 mg/kg。
2.6 回收率与精密度
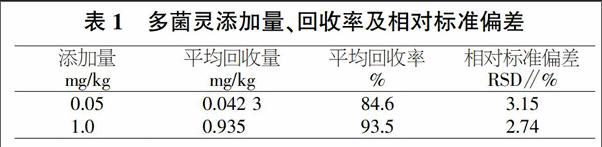
以不含多菌灵的番石榴溶液作空白基质添加一定量的多菌灵标准品做添加回收试验,每个添加浓度重复测定6次,同时做空白试验。如表所示,添加平均回收率在84.6%~93.5%,相对标准偏差(RSD)为2.74%~3.15%(表1)。说明该方法具有较好的回收率和精密度,可以满足相关检测要求。
3 结论与讨论
通过优化提取溶剂、样品净化等前处理方法建立了超高效液相色谱法测定番石榴中多菌灵农药残留的方法。本方法采用超高效液相色谱达到了节约试剂,减少有机试剂对环境污染的目的,具有样品前处理操作简单、准确性高和快速等特点,较高的灵敏度和精密度满足实际样品检测的需要,适用于番石榴样品中多菌灵残留快速、批量检测的工作要求,在实际检测过程中可以将其作为常规残留检测方法使用。
4 参考文献
[1] 张福平,陈蔚辉. 热带各优水果:番石榴[J].中国果菜,2002(3):30.
[2] 温靖,徐玉娟,肖更生,等.番石榴果实的营养价值和药理作用及其加工利用[J].农产品加工(学刊),2009(6):11-13,17.
[3] 刘杰,杨春亮,查玉兵,等.高效液相色谱法-荧光检测器同时检测龙眼中多菌灵和噻菌灵残留[J].广东农业科学,2010(3):150-152.
[4] 欧翔,黄义彬,李卿.蔬菜中多菌灵残留量的高效液相色谱法测定方法[J].农技服务,2010(4):470-471.
[5] 王宇,陈彤,张月梅,等.高效液相色谱-串联质谱法测定人参中的多菌灵残留[J].大连工业大学学报,2010(3):165-167.
[6] 刘杰,杨春亮,查玉兵,等.凝胶渗透色谱净化-高效液相色谱法同时检测葡萄中多菌灵和噻菌灵残留[J].安徽农业科学,2010(23):12554-12555.
[7] 胡西洲,程运斌,胡定金.QuEchERS法测定蔬菜中有机磷类农药多残留分析[J].中国测试技术,2006(3):132-133.
[8] 胡西洲,程运斌,胡定金.农药多残留分析中QuEchERS方法介绍[J].现代农药,2006(4):24-29,44.
[9] 赵祥梅,董英,王和生,等.QuEChERS-气-质联用法检测大米中12种农药残留物[J].中国食品学报,2010(2):214-220.
[10] 董静,潘玉香,朱莉萍,等.果蔬中54种农药残留的QuEChERS/GC-MS快速分析[J].分析测试学报,2008(1):66-69.
[11] 李春艳,孔祥虹,何强,等.改进的QuEChERS-GC-MS法快速分析茶叶中30种农药残留[J]. 中国食物与营养,2010(2):57-60.
[12] 刘亚伟,董一威,孙宝利,等.QuEChERS在食品中农药多残留检测的应用研究进展[J].食品科学,2009(9):285-289.endprint
