第1讲 身边的化学物质
2015-09-10杨洁
杨洁






第1节 我们周围的空气
重点难点热点
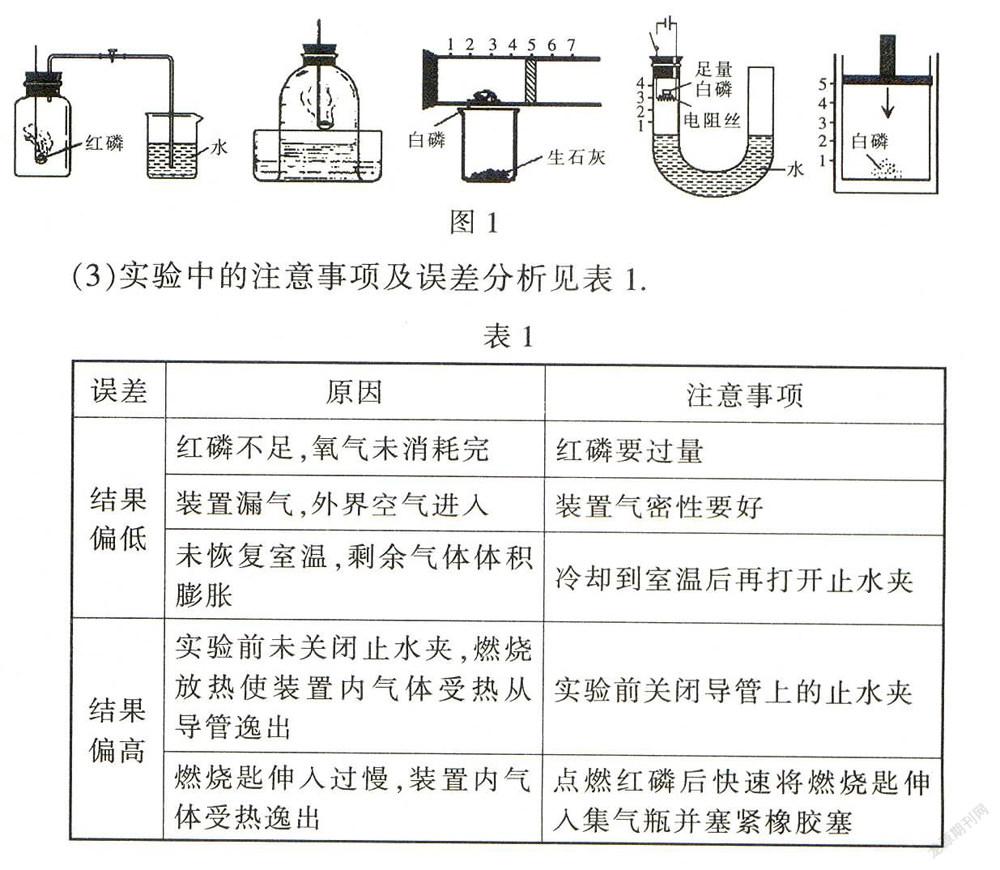
1.空气中氧气含量的测定
(1)原理:在密闭装置中,利用足量的磷燃烧消耗氧气,生成固体,使装置内压强减小,通过进水或活塞移动,得出氧气的体积.
(2)装置及现象:同学们要会结合图1所示装置描述实验现象.
(4)实验反思:不能用碳(生成气体)、硫(生成气体)、铁(在空气中不能燃烧)、镁(能与氮气、二氧化碳反应)代替红磷.
该实验药品应满足的要求:能与空气中的氧气反应,小与空气中的其他气体反应,不生成气体或生成的气体能被溶液吸收(例如,若集气瓶中先放入氢氧化钠溶液,则可用硫进行实验).
2.氧气的性质
许多物质在氧气中可以燃烧,但氧气本身没有可燃性,它具有的是助燃性.
3.二氧化碳的性质与用途
同学们要理解验证二氧化碳性质的几个重要实验:(l)证明二氧化碳能溶于水;(2)阶梯蜡烛实验;(3)探究二氧化碳与水的反应;(4)探究二氧化碳与氢氧化钠溶液的反应.
另外,应注意二氧化碳与“温室效应”、“低碳生活”等社会热点的联系,并正确认识到二氧化碳对环境有一定的影响,但并不能算作污染物.
4.氧气、二氧化碳的制取
氧气、二氧化碳等气体的制取常综合考查,建议同学们在复习时将两种气体的制取方法进行整理、对比.明确实验原理和选择装置的原则,提高综合应用能力.
典型中考新题
例1 (2014.武汉)某化学兴趣小组的同学在老师的指导下,正确完成如图2所示的两个实验,已知所用实验装置气密性良好.
关于实验,有如下说法:①红磷熄灭并冷却后才能打开弹簧夹;②点燃酒精灯加热铜丝,可观察到铜丝由红色变成黑色;③停止加热后即可读出注射器内气体的体积约为24 mL;④实验取用铜丝质量的多少不会影响实验结果;⑤两个实验均能证明空气是混合物;⑥两个实验均能证明空气中约含1/5体积的氧气,其中正确说法有().
A.2个
B.3个
C.4个
D.5个
研析与解答:红磷燃烧并冷却后打开弹簧夹,可避免集气瓶内剩余气体体积膨胀而进水少,故说法①正确;加热铜丝,2Cu+02 ≌ 2Cu0(黑色),所以铜丝表面由红色变成黑色,故说法②正确:应该在停止加热并冷却至室温后才能读数,故说法③错误;实验过程中为了将空气中的氧气完全耗尽,加入的铜丝应是过量的,故说法④错误;两个实验均能证明空气中含有氧气和其他成分,故说法⑤正确;两个实验均能证明氧气在空气中的含量,故说法⑥正确,答案:C
例2 (2014.永州)如图3是某研究性学习小组进行C02与NaOH溶液反应的探究实验装置.
【查阅资料】水的沸点与气体压强有关,气体压强小,沸点低;气体压强大,沸点高.
【实验探究】实验步骤如下.
步骤①:如图3所示,锥形瓶A盛满C02气体,锥形瓶B盛有96℃以上但未沸腾的热水,烧杯中加入同样温度的热水(起保持锥形瓶B中水温恒定的作用).
步骤②:取2支注射器,一支抽取20 mL,水,另一支抽取20 mL浓NaOH溶液.
步骤③:将注射器中20 mL水注入锥形瓶A中,振荡后发现,锥形瓶B中的热水没有沸腾.
步骤④:取下盛水的注射器,再将盛20 mL浓NaOH溶液的注射器迅速连接到锥形瓶A上,注入该溶液并振荡,观察到明显的现象.
(1)实验开始前,依图3连接好装置(锥形瓶A、B和烧杯均未盛装物质),将一支空注射器连接到锥形瓶A上,并将其活塞缓慢向上拉,几秒钟后松手,观察活塞是否复位,这个操作的目的是______ .
(2)锥形瓶A中CO2与NaOH溶液反应的化学方程式是______.
(3)步骤④锥形瓶B中产生的明显现象是______ ,产生明显现象的原因是______.
研析与解答:(1)连接好装置,将空注射器连接到锥形瓶A上,上拉活塞使气体进入注射器,装置内的压强减小,若不漏气,外界大气压会将活塞压回原来的位置.(2)考查化学方程式的书写,C02与NaOH的反应属于非金属氧化物+碱一盐+水,注意总结反应特点.(3)步骤③、④对比说明C02与NaOH发生了反应,装置内的气体减少,压强变小,故水会在低于100 cc的温度下沸腾.答案:(1)检查装置气密性 (2)2NaOH+C02=Na2C03+H20 (3)水沸腾B中压强减小,水的沸点降低
2015年中考小预测
1.下列物质的用途与性质不对应的是().
A.食品包装中充氮气以防腐——常温下氮气的化学性质不活泼
B.一氧化碳用于冶炼金属——一氧化碳具有可燃性
C.稀有气体能制成多种用途的电光源——稀有气体在通电时发出不同颜色的光
D.干冰可用作制冷剂——干冰升华吸热
2.打捞韩国“岁月号”沉船是在水下作业,潜水员需要呼吸富氧空气.富氧空气中氧气的含量高于普通空气中氧气的含量,那么在富氧空气中氧气与其他气体的体积比可以是().
A. 1:2
B.1:5
C.1:4
D.21:79
3.下列有关物质燃烧的现象中,正确的是().
A.铁丝在氧气中燃烧:火星四射,生成红色固体
B.硫粉在空气中燃烧:产生淡蓝色火焰,生成一种t有刺激性气味的气体
C.镁条在空气中燃烧:发出耀眼的白光,只生成一种黑色固体
D.红磷在空气中燃烧:发出白光,生成大量的白色烟雾
4.两个软塑料瓶中分别充满CO和C02两种无色气体,下列试剂不能将二者鉴别出来的是().
A.澄清石灰水
B.水
C.紫色石蕊溶液
D.氯化钠固体
5.某学习小组利用如图4所示的仪器或装置进行气体制备,回答有关问题.
(1)写出仪器a的名称:____,用A装置制取氧气的化学反应方程式为______.
(2)若要在实验室制取二氧化碳气体,其发生装置可选用图中的______(填序号)进行组装,连接玻璃管和胶皮管的操作:先把玻璃管口______,然后稍稍用力即可把玻璃管插入胶皮管内.
(3)要制得干燥的二氧化碳,可在收集装置前增加盛有______的洗气瓶.
(4)实验室收集氧气和二氧化碳都可用到的装置是____(填序号).
(5)用澄清石灰水检验二氧化碳,其反应的化学方程式为_________.
6.多角度认识物质,能帮助我们更全面地了解物质世界.以氧气和二氧化碳为例,回答下列问题.
(1)认识物质的组成和构成
①从宏观上看,氧气和二氧化碳都由______(填“元素”、“原子”或“分子”,下同)组成.
②从微观上看,氧气和二氧化碳都由______ 构成.
(2)认识物质的制法
①某同学用软塑料瓶自制气体发生装置,通过捏放瓶身可随时控制反应发生和停止(如图5).若利用该装置制氧气,反应的化学方程式为______,若利用该装置制二氧化碳,无纺布包内的药品应为____________.
②工业上常用液化空气制氧气,该过程属于(填“物理变化”或“化学变化”).
(3)辩证地认识物质
①量变引起质变,例如:碳在充足氧气中燃烧生成二氧化碳,在不充足的氧气中燃烧生成____(写化学式).
②功过相对论.从“二氧化碳导致温室效应”的事实分析.“过”:使全球气候变暖导致海平面上升等;“功”:
(举1例).
第2节
与常见的溶液
重点难点热点
1.水
(1)水的组成:通过电解水实验得出,其现象可简单概括为“正氧负氢、氢二氧一”.
(2)水的净化:净水的一般方法,按照净化程度由低到高依次是沉淀、过滤、吸附、蒸馏,这些都是物理变化;理解硬水与软水的区别及硬水软化的方法.
(3)保护水资源的措施:一方面应节约用水,一方面要防治水污染.
2.溶解时的吸热、放热现象
物质溶解时的热量变化常与压强、溶解度等综合考查.溶解时放热的物质有NaOH、H2SO4等,吸热的有NH4NO2、NH4C1等.
3.饱和溶液与不饱和溶液
随着溶剂质量、溶质质量或温度的变化,饱和溶液与不饱和溶液可以相互转化,所以在说明“饱和”、“不饱和”时,必须指明“一定的温度”和“一定量的溶剂”,二者相互转化的方法如下:
注意饱和溶液、不饱和溶液与浓溶液、稀溶液之间没有必然联系:浓溶液不一定就是饱和溶液,稀溶液也不一定就是不饱和溶液,但在一定温度下,同种物质的饱和溶液一定比它的不饱和溶液浓.
4.溶解度和溶解度曲线
(1)同体物质的溶解度只受温度这一个外因的影响,大多数同体物质的溶解度随温度的升高而增大(如KN03),少数固体物质的溶解度受温度的影响不大(如NaCI),极少数固体物质的溶解度随温度的升高而减小[如 Ca(OH)2].气体的溶解度受温度和压强两个外因的影响.
(2)学会分析和应用溶解度曲线.
典型中考新题
例1 (2014.上海)河水净化的主要步骤如图1所示.下列有关说法错误的是().
A.步骤I可除去难溶性杂质
B.X试剂可以是活性炭
C.步骤Ⅲ呵杀菌、消毒
D.净化后的水是纯净物
研析与解答:沉降、过滤去除的是水中的不溶性杂质:活性炭有吸附性,可除去水中的异味和色素;液氯是处理自来水时常用的消毒剂,起杀菌、消毒的作用;净化后的水还含有可溶性的杂质,不是纯净物,答案:D
例2(2014.德阳)甲、乙两种物质的溶解度曲线如图2所示.下列叙述正确的是().
A.将甲的溶液从t2℃降到tl℃,其溶质的质量分数一定减小
B.t2℃时,甲、乙的饱和溶液各100 g,其溶质的质量一定相等
C.当温度高于O℃而低于t1℃时,乙的溶解度比甲的溶解度大
D.t2℃时,蒸发溶剂可使乙的饱和溶液析出晶体后变为不饱和溶液
研析与解答:A选项,t2℃时的甲溶液不知是否饱和,若为不饱和溶液,降温后溶质的质量分数可能不变:B选项,饱和溶液的溶质质量分数=()100%,t2℃时甲、乙的溶解度不相等,故饱和溶液的溶质质量分数不相等,因此等质量饱和溶液中的溶质质量不相等;C选项,由溶解度曲线可判断该温度范围内乙的溶解度比甲的大;D选项,饱和溶液蒸发溶剂析出晶体后,得到的仍是饱和溶液,答案:C
2015年中考小预测
1.下列含有“水”的物质中,属于纯净物的是().
A.硬水
B.蒸馏水
C.矿泉水
D.雨水
2.下列有关水的说法,正确的是().
A.海水、湖水是混合物,自来水是纯净物
B.用紫色石蕊溶液区分硬水和软水
C.淡水资源是取之不尽、用之不竭的
D.电解水生成氢气和氧气,说明水是由氢、氧两种元素组成的
3.下列有关溶液的说法中错误的是().
A.溶液一定是无色、透明的混合物
B.溶液加溶剂稀释前后溶质的质量不变
C.溶液的各部分性质均相同
D.浓溶液不一定是饱和溶液
4.同学们做完实验后的玻璃试管中常附着难清洗的物质,下列清洗方法错误的是().
A.内壁有CaC03的试管用稀盐酸清洗
B.内壁有碘的试管用酒精清洗
C.内壁有铜粉的试管用稀硫酸清洗
D.内壁有植物油的试管用洗洁精清洗
5.图3是甲、乙两种固体物质的溶解曲线,图4是盛水的烧杯中放着t2℃下甲、乙两种物质饱和溶液的试管(不考虑溶剂的蒸发),根据有关信息判断,下列说法中错误的是().
A.t2℃时,甲、乙两种物质的饱和溶液中溶质的质量分数大小关系为:甲>乙
B.将甲、乙两种物质的饱和溶液都从£:℃降至t1℃时,两种溶液中溶质的质量分数相等
C.向烧杯的水中加NaOH固体后,只有乙溶液中溶质的质量分数变小
D.向烧杯的水中加NH4N03固体后,只有盛放Ifi溶液的试管中有晶体析出
6.0℃时,分别向盛有10 g水的A、B两支试管中加入等质量的甲、乙两种固体,充分溶解后,观察到如图5所示的现象.图6表示甲、乙两种物质的溶解度曲线.
(1)0℃时,(填“A”或“B”)试管中的溶液一定是饱和溶液.
(2)图6中,______(填“M”或“N”)表示乙物质的溶解度曲线.
(3)要使B试管中剩余的固体继续溶解可采用的方法是______(答1种方法即可).
(4)将10℃时M的饱和溶液升温到20℃(假设水不蒸发),其溶质质量分数 ______(填“增大”、“减小”或“不变”).
第3节 金属和金属矿物
重点难点热点
1.金属活动性顺序及其应用
(1)判断置换反应能否发生,有关反应的规律可简单记作“金酸氢之前、金盐前置后”.
(2)设计实验验证金属的活动性顺序时,常利用的验证依据是:能否与酸反应:能否发生“前置后”的反应,常见的类型是验证三种金属的活动性强弱,最简方案是将三种金属按活动性强弱排好顺序,然后选“金、盐、金”或“盐、金、盐”的试剂组合.
(3)判断金属与盐溶液反应后的滤液、滤渣的成分.金属与盐溶液的反应遵循两个原则:前置后原则——在金属活动性顺序中,前面的金属能把后面的金属从其盐溶液中置换出来:距离越远的越先发生原则——在金属活动性顺序中距离越远的,越先发生反应,且一个置换反应进行充分后,另一个置换反应才会进行,例如,在硝酸铜和硝酸银的混合溶液中加入铁粉,铁会先和硝酸银反应,反应充分后铁才和硝酸铜反应.
2.铁的冶炼
掌握一氧化碳还原氧化铁的实验原理、现象及装置等.要注意比较冶铁(用还原剂CO将铁从氧化物中还原出来)与炼钢(用氧化剂02将生铁中多余的碳氧化)的区别.
3.金属的防锈和金属资源的保护
铁的生锈原理和防锈方法是命题的热点,有时会延伸到铜的生锈和防锈.此外,勿将保护金属资源的措施错误地等同于防止铁生锈的措施,金属的防锈只是保护金属资源的途径之一,
典型中考新题
例1 (2014.威海)下列现象或事实,可用金属活动性作出合理解释的是().
①黄铜(铜锌合金)的外观与黄金相似,但可将两者放人稀盐酸中加以区别;②金属铝比金属锌更耐腐蚀,说明锌比铝活动性强;③用硫酸铜、石灰水配制农药波尔多液时,不能用铁制容器;④铜的导电性比铁强. A.②④ B.①③ C.②③ D.①②③
研析与解答:①黄铜(铜锌合金)中的锌能与盐酸反应生成氢气,可利用该性质鉴别;②金属铝更耐腐蚀是由于其化学性质活泼,在常温下就可以和氧气反应而形成致密的氧化铝薄膜,从而阻止进一步氧化;③铁的活动性比铜强,能将硫酸铜中的铜置换出来;④导电性是金属的物理性质,与金属活动性无关.答案:R
例2 (2014.泸州)某化学兴趣小组用一氧化碳与氧化铁的反应来探究炼铁的原理,装置如图l所示.
(1)实验进行一段时间后,A装置中玻璃管内观察到的现象是______.
(2)B装置中氢氧化钠溶液的作用是______,反应的化学方程式为 ______.
(3)为避免将CO排放到空气中,并回收利用CO,方框中连接的是C和D装置,导管接口的连接顺序为a→_______.
研析与解答:第(1)题考查实验现象,该反应的原理为3CO+Fe203()2Fe+3C02,其中Fe203为红色粉末,生成的铁粉为黑色粉末;第(2)题应结合完整的实验来理解NaOH溶液的作用,A装置产生的尾气主要成分是CO和CO2,为了回收利用CO,应除去C02,而NaOH溶液正是除去C02常用的试剂;第(3)题气体进入C中,聚集在集气瓶上部,需将水从下部长导管排出,故气体应从d端导入.答案:(1)红色固体变成黑色 (2)吸收二氧化碳 2NaOH+C02=N a2C 03+H20 (3)d→b→e
2015年中考小预测
1.中国南车株洲时代集团生产的油电双动力公交车因省油、环保而在全国推广,双动力公交车制造时需要大量使用金属材料.下列有关金属材料的说法正确的是().
A.金属材料中一定不含有非金属元素
B.多数合金的抗腐蚀性能比组成它们的纯金属更好
C.双动力公交车所有部件都是由金属材料制造的
D.地球上的金属资源是取之不尽、用之不竭的
2.“对比法”是实验探究中常用的一种科学方法.某同学设计铁钉生锈的实验如图2所示,则下列结论不正确的是().
A.对比①②可以说明铁生锈一定要有氧气参加
B.对比②③可以说明铁生锈一定要有水参加
C.对比①③可以说明铁生锈一定要有水参加
D.对比①②③可以说明铁生锈必须水和氧气同时参加
3.仅用下列各组试剂无法验证Zn、Cu、Ag三种金属活动性顺序的是().
A.Zn、Ag、CuS04溶液
B.Cu、ZrlS04溶液、AgN03溶液
C.Zn、Ag、稀硫酸、CuS04溶液
D.Zn、Cu、稀硫酸、AgN03溶液
4.等质量的X、Y两种金属分别和足量的同体积、同浓度的盐酸反应,产生气体的质量与时间的关系如图3所示,下列说法中不正确的是().
A.t1时,产生气体的质量:X>Y
B.t2时,消耗金属的质量:X>Y
C.t3时,消耗金属的质量:X=Y
D.t3时,消耗盐酸的质量:X=Y
5.“低碳生活,绿色出行”,图4为潍坊公共自行车,请回答下列问题.
(1)图4中所标示的各部件中,属于金属材料的是____(填写序号,下同),属于有机合成材料的是______.
(2)公共自行车的闸线为钢丝,说明金属具有______ 性.
(3)车架表面喷漆不仅美观,而且可有效防止与
接触而生锈.防止公共自行车链条生锈的有效措施是______.
(4)公共自行车有些零件选用了铝合金材料,其优点是质量轻、硬度大和______ .废旧自行车回收利用的意义是减少环境污染及______.
6.铁及其化合物在生活生产中有重要的应用.请回答下列问题:
(1)在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是____,为防止集气瓶破裂,常采取的措施是____.
(2)已知铁能与氯化铁反应生成氯化亚铁.将生锈的铁钉(铁锈的主要成分是Fe203)放人盐酸中,充分反应后有铁剩余,写出发生置换反应的化学方程式______,溶液中的金属阳离子是______(用符号表示).
(3)把铁粉和铜粉的混合物放入硝酸银溶液中,反应结束后有固体剩余.下列说法正确的是______(填写字母序号).
A.剩余固体肯定含有银
B.剩余固体肯定是银和铜
C.反应后溶液中一定有Fe2+和Cu2+
D.反应后溶液中可能含有Ag+和Cu2+
第4节 生活中常见的化合物
重点难点热点
这部分最为重要的是关于酸、碱、盐的知识.涉及的内容与工农业生产、生活联系密切,灵活性、综合性较强,注重让同学们用所学的知识解决实际问题.下面请看两个有关探究,体会一下知识的综合应用.
1.探究中和反应是否发生
酸溶液和碱溶液反应一般没有明显的现象,要证明反应发生可利用多种方法,例如,测溶液的酸碱性、测溶液的pH、测温度的变化、证明有新物质生成等,在探究过程中注意酸和碱恰好完全反应时的实验现象.
2.探究NaOH的变质情况
(I)变质原因:2NaOH+C02=Na2C03+H20.
(2)检验NaOH是否变质,即检验有无Na2C03.可利用CO;-的性质,取样后加入过量的稀盐酸或含钙、钡离子的溶液.
(3)检验是否全部变质,即检验有无NaOH.要注意的是Na2CO,溶液也呈碱性,它的存在对检验NaOH造成了干扰,故需要先除去溶液中的Na2C03,才能检验NaOH.具体做法:取样,加过量的CaCl2溶液,再在上层清液中滴加酚酞溶液,如果溶液变红,说明有NaOH存存.即NaOH部分蛮质.
典型中考新题
例1 (2014.杭州)在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明两者恰好完全中和的是().
A.滴入适量FeCl3溶液,溶液变黄,但无沉淀生成
B.滴入几滴酚酞溶液,酚酞溶液不变色
C.测得反应后溶液中Na+与Cl-的个数比为1:1
D.滴入适量AgN03溶液和稀硝酸,观察到有白色沉淀生成
研析与解答:当盐酸过量或适量时,溶液中都不含氢氧化钠,滴入FeCl3溶液不会有沉淀生成,加入酚酞溶液也不会变色,故A、B错误;当氢氧化钠溶液和稀盐酸恰好完全反应,溶液中的溶质只有NaCl,即Na+与Cl-的个数比为1:1,故C正确;只要滴入稀盐酸,溶液中就含有Cl,再滴入AgN03溶液和稀硝酸,就会生成AgCl沉淀,故D错误.答案:C
例2(2014.雅安)镧(IJa)是一种活动性比锌更强的元素,它的氧化物的化学式为La203,La(OH)3是不溶于水的碱,而LaCl3、La(N03)3都可溶于水.由此判断下列几组物质,不能直接反应制取LaCl3的是().
A.La(OH)3和HCl
B.La203和HC1
C.La和HCl
D.NaCl和La(OH)3
研析与解答:碱与酸反应生成盐和水,故La(OH),和HC1能直接反应生成LaCl3和水;金属氧化物和酸反应生成盐和水,故La203和HC1能直接反应生成LaCl3和水;La比Zn活泼,故和HC1能直接反应生成LaCl3和氢气;碱和盐反应要求反应物均可溶,而La(OH)3是不溶于水的物质,故不能与NaCl反应.答案:D
2015年中考小预测
1.柠檬酸( C6H807)是一种较强的有机酸,在水溶液中可以解离出来H+,从而呈现酸性,可作为饮料的酸化剂.下列物质不能与柠檬酸反应的是().
A. Mg
B.Fe203
C.C0,
D.NaOH
2.下列实验中无明显现象的是().
A.向H2S04溶液中滴加Ba(OH)2溶液
B.向Mg(N03)2溶液中滴加Na2S04溶液
C.将浓硫酸加入蒸馏水中并不断搅拌
D.将(NH4)2S04和熟石灰混合研磨
3.现有盐酸和CaCl,的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图1所示.则X是().
A.水
B.澄清石灰水
C.纯碱溶液
D.稀盐酸
4.在盛有稀硫酸的烧杯中,分别加入下列物质,最终只存在无色液体的是().
A.Na2C03溶液、KC1溶液
B.BaCl2溶液、KOH溶液
C.FeS04溶液、NaN03溶液
D.Cu0、Na2S04溶液
5.表1中各组物质间通过一步反应不能实现图2转化的是().
6.下列物质在空气中敞口放置一段时间后,请将物质的质量变化填在物质后的横线上:①浓盐酸____ ;②浓硫酸______ ;③氢氧化钠同体____;④生石灰____;⑤氯化钠固体______ ,以上物质在空气中敞口放置一段时间后,发生化学变化的有______(填序号).
7.NaOH是化学实验中常用的试剂.
(1)将NaOH溶液逐滴滴人一定量的盐酸中,图3中合理的是______(填“甲”或“乙”).
(2)向长期敞口放置的NaOH溶液中滴加盐酸时,意外发现有气泡产生,请解释其原因.
(3)向足量NaOH溶液中通入C02,反应后溶液中的溶质可能只有Na2C 03,也可能还有NaOH,请设计实验检验溶质的成分,简要写出实验步骤、现象和结论.(提示:Na2C03溶液呈碱性)
