生防放线菌代谢产淀粉酶工艺的优化
2015-09-10李堆淑
李堆淑
摘要: 从陕西省商洛市商州区不同植被下采取土样,分离出65株生防放线菌,其中从苜蓿中分离的MX3菌株对黄芩根腐病菌的生防效果最强。采用单因素试验及正交试验对MX3菌株代谢产物产淀粉酶活性进行测定,优化发酵条件。结果表明:单因素试验得出MX3菌株的最佳碳源、氮源分别为玉米粉、酵母膏,最适装液量为125 mL,最适温度为28 ℃,最适初始pH值为6 0,最适摇床转速为130 r/min,最适发酵时间为6 5 d。由正交试验得到MX3菌株的最佳发酵条件组合为装液量125 mL、pH值7 0、发酵时间5 5 d、摇床转速200 r/min。
关键词: 生防放线菌;淀粉酶;发酵液;正交试验;发酵条件;优化
中图分类号:Q939 97 文献标志码: A
文章编号:1002-1302(2015)08-0376-03
生防放线菌,尤其是链霉菌属是药物研究的重要微生物资源,也是微生物生长发育和代谢产物研究的良好材料 [1-2]。放线菌的链霉菌属及其相关类群也用在植物病害的生物防治方面,生防放线菌在寄主体外通过各种生物作用降低病原菌侵染 [3-4]。Kemira将从泥煤中分离的灰绿链霉菌作为制剂,主要用于防治镰刀菌、腐霉菌、疫霉菌、丝核菌等土传病原菌 [5]。我国研制的细黄链霉菌“5406”不但能够防治多种植物病原菌的生长,还对植物生长具有促进作用 [6],也可以在寄主植物组织内诱发其产生抗性。淀粉酶对淀粉的水解作用是生物体利用淀粉进行新陈代谢的初级反应,也是工业上产量最大的酶制剂品种 [7]。淀粉酶分布广泛,遍及微生物及高等植物,其种类繁多,特点各异,用途较广,主要应用于发酵、果汁、食品加工、医药、造纸、印染、洗涤剂、工业副产品、青贮饲料及废料的处理等多种领域 [8-10]。目前对细菌产淀粉酶的研究较多,其中研究芽孢杆菌产淀粉酶 [11-14]、放线菌产淀粉酶的较少 [15]。生防放线菌的研究主要集中于抑菌性 [16-17],但对高抗菌、高产淀粉酶的放线菌研究未见报道。因此,本研究从陕西省商洛市商州区苜蓿地采集土样,通过选取培养基组成和培养条件等因素进行试验,以期获得生防放线菌代谢产物产淀粉酶的最优发酵条件,不仅为研究生防放线菌在不同条件下的高抗菌性作了铺垫,而且为开发新菌株用于淀粉酶工业的研究提供依据。
1 材料与方法
1 1 材料
1 1 1 供试材料 从陕西省商洛市商州区不同植被模式下采集土样,分离出65株生防放线菌;从黄芩根部分离的黄芩根腐病菌。[LL]
1 1 2 培养基 高氏1号培养基(改良):每300 mL培养基中滴加1 mL 50 μg/mL K2Cr2O7;马铃薯培养基(PDA);种子培养基;淀粉发酵培养基(150 mL规格的三角瓶中装液量为125 mL)。
[BT2++0 2mm]1 2 试验方法
1 2 1 粗酶液淀粉酶活性测定 采用3,5-二硝基水杨酸显色法测定酶活性 [18]。在60 ℃、pH值=6 0的条件下,1 h内2%的可溶性淀粉溶液中释放出1 mg葡萄糖的酶量定义为1个酶活性单位。
1 2 2 单因素试验对MX3菌株发酵条件的优化 活化斜面保存的MX3菌株,接种到改良的高氏1号培养基上,于28 ℃恒温培养箱中培养5 d后,以4%的接种量接种培养5 d的种子培养液;再将种子培养液以10%的接种量接种于发酵液中,在28 ℃、130 r/min条件下培养5 d后,测定MX3菌株发酵液的淀粉酶活性。
主要单因素的设置为:(1)碳源:淀粉、玉米粉、牛肉膏、碳酸钠、葡萄糖;(2)氮源:黄豆饼粉、硝酸钠、硫酸铵、蛋白胨、酵母膏;(3)装液量:50、75、100、125、150 mL;(4)温度:25、28、30、35、37 ℃;(5)初始pH值:6 0、7 0、8 0、9 0、10 0;(6)发酵时间:5 0、5 5、6 0、6 5、7 0 d;(7)摇床转速:80、100、130、150、200 r/min。
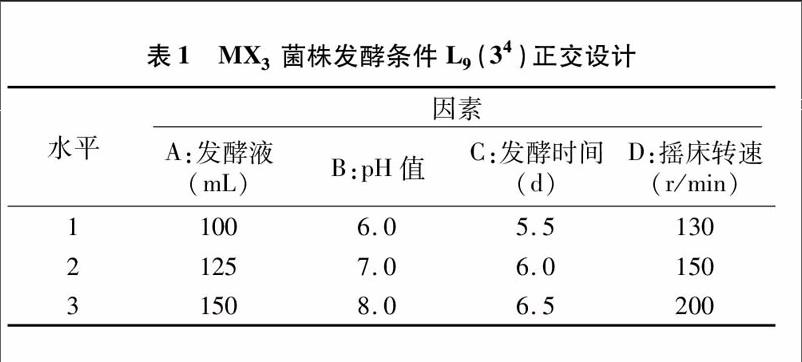
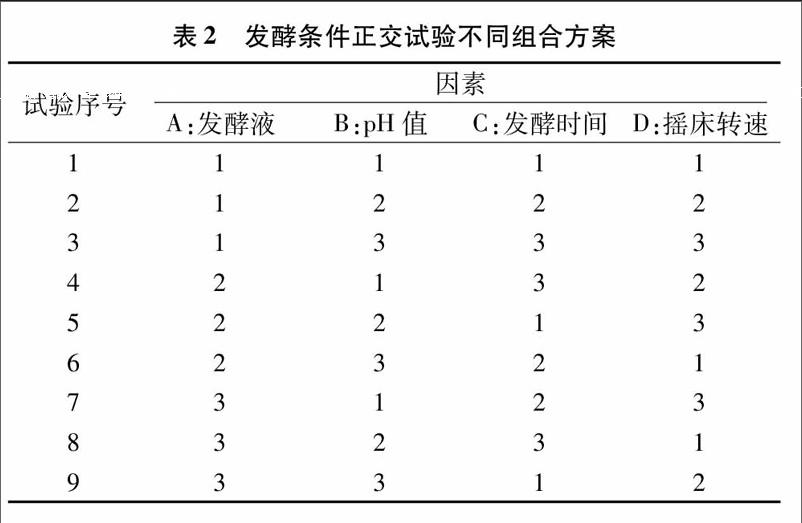
1 2 3 正交试验对MX3菌株发酵条件的优化 根据单因素试验所得的各个最佳发酵条件进行正交试验,详见表1设计的因素水平和表2组合的L9(34)发酵条件,发酵培养各组合的MX3菌株发酵液,测定其发酵液的淀粉酶活性。
2 结果与分析
2 1 单因素试验结果
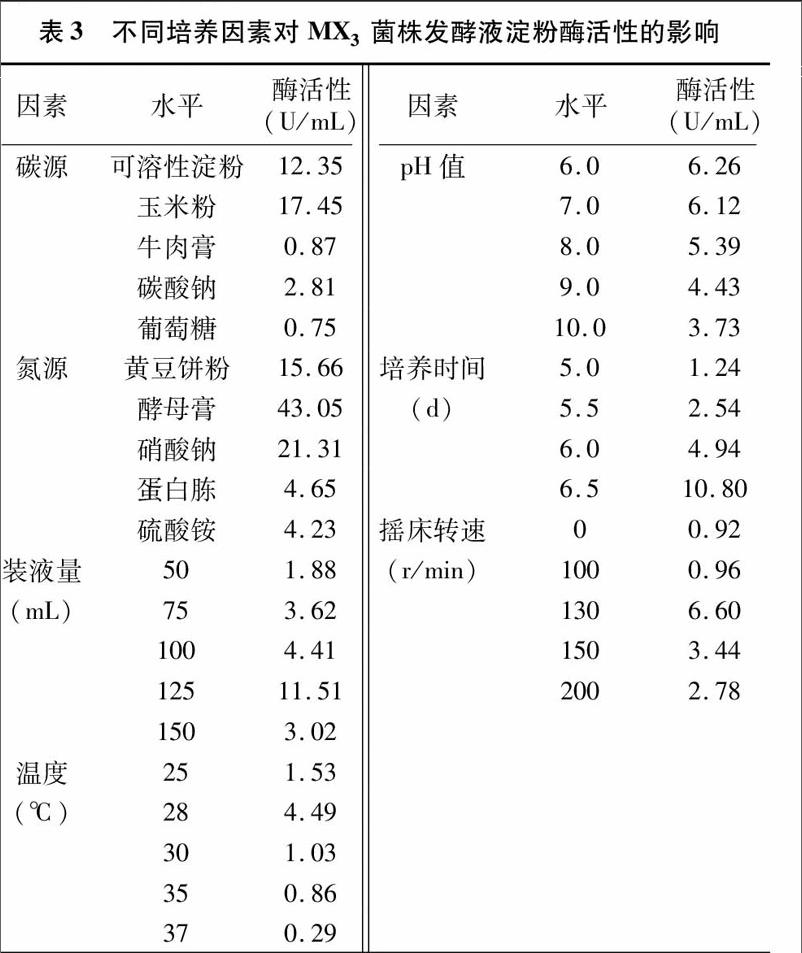
2 1 1 确定MX3菌株发酵液的最佳碳源 采用改良高氏1号培养基,用淀粉、玉米粉、牛肉膏、碳酸钠、葡萄糖5种碳源,测定MX3菌株发酵液的淀粉酶活性,从中筛选最佳碳源。如表3所示,酶活性排序为玉米粉>可溶性淀粉>碳酸钠>牛肉膏>葡萄糖,可见玉米粉作为碳源时,MX3菌株发酵液的淀粉酶活性最大,为17 45 U/mL,因此玉米粉为最佳碳源。
2 1 2 确定MX3菌株发酵液的最佳氮源 改良高氏1号培养基以玉米粉为碳源,对其进行最佳氮源选择,采用黄豆饼粉、酵母膏、硝酸钠、蛋白胨、硫酸铵5种氮源,测定MX3菌株发酵液的淀粉酶活性。如表3所示,酶活性排序为酵母膏>硝酸钠>黄豆饼粉>蛋白胨>硫酸铵,可见以酵母膏作为氮源时,MX3菌株发酵液的淀粉酶活性最大,为43 05 U/mL,因此认为酵母膏为最佳氮源。
2 1 3 确定MX3菌株发酵液的最佳装液量 改良高氏1号培养基分别以玉米粉为碳源、酵母膏为氮源,在150 mL的三角瓶中分别装入发酵培养基50、75、100、125、150 mL,接种MX3菌株。如表3所示,当装液量增加到125 mL时,发酵液的淀粉酶活性达到最大值,为11 51 U/mL;发酵液量继续增加,其淀粉酶活性下降,可见MX3菌株发酵液最佳摇瓶装液量为125 mL(三角瓶规格150 mL)。
2 1 4 确定MX3菌株的最佳培养温度 改良高氏1号培养基分别以玉米粉为碳源、酵母膏为氮源,装液量为125 mL(三角瓶规格150 mL),温度分别设为25、28、30、35、37 ℃,培养 5 d 后测定MX3菌株各发酵液的淀粉酶活性。如表3所示,温度对发酵液中淀粉酶活性有一定的影响,温度在25~28 ℃,随着温度的升高,发酵液的淀粉酶活性逐渐增大,在 28 ℃ 时,其淀粉酶活性达到最大值,为4 49 U/mL;当温度升高到30、35、37 ℃时,发酵液的淀粉酶活性逐渐减小,说明温度偏高不利于MX3菌株的发酵培养,因此认为28 ℃为MX3菌株的最佳培养温度。endprint
2 1 5 确定MX3菌株发酵液初始pH值 改良高氏1号培养基分别以玉米粉为碳源、酵母膏为氮源,装液量为125 mL(三角瓶规格150 mL),于28 ℃培养。将MX3菌株发酵液初始pH值分别调至6 0、7 0、8 0、9 0、10 0,然后分别培养 5 d,测定MX3菌株发酵液的淀粉酶活性。如表3所示,当发酵液初始pH值为6 0时,其淀粉酶活性最大,为6 26 U/mL;随着发酵液的初始pH值增加,MX3菌株发酵液代谢产物淀粉酶活性逐渐减小。
2 1 6 确定MX3菌株的最佳发酵时间 改良高氏1号培养基分别以玉米粉为碳源、酵母膏为氮源,装液量为125 mL(三角瓶规格150 mL),于28 ℃培养,pH值设为6 0,筛选MX3菌株最佳发酵时间,每隔12 h取样。如表3所示,MX3菌株发酵液培养5 0~6 5 d时,发酵液的淀粉酶活性不断增大,在6 5 d时其淀粉酶活性最大,为10 80 U/mL;继续延长培养时间,其淀粉酶活性不断降低,培养7 0 d时,其淀粉酶活性已经下降为0 92 U/mL(表中未列),因此最佳的发酵时间为6 5 d。
2 1 7 确定MX3菌株发酵培养的最佳摇床转速 改良高氏1号培养基分别以玉米粉为碳源、酵母膏为氮源,装液量为125 mL(三角瓶规格150 mL),于28 ℃培养,pH值设为6 0,发酵时间为6 5 d,MX3菌株发酵液的摇床转速分别设为0、100、130、150、200 r/min,分别测定其发酵液的淀粉酶活性。如表3所示,随着摇床转速的增加,其发酵液的淀粉酶活性逐渐增大,转速为130 r/min 时其发酵液的淀粉酶活性最大,为6 60 U/mL;随后,再增加发酵液的摇床转速,其发酵液的淀粉酶活性缓慢下降。
2 2 正交试验结果
根据4因素3水平的L9(34) 正交表设计9种不同的发酵培养条件,测定MX3菌株发酵液的淀粉酶活性,优化发酵条件。如表4所示,各因素的影响力排序为C>A>B>D,最优组合为组合A2B2C1D3,即装液量125 mL、pH值为7 0、发酵时间5 5 d、摇床转速200 r/min时,MX3菌株发酵液的淀粉酶活性最大,为35 71 U/mL,比改良高氏1号培养基分别以玉米粉为碳源、酵母膏为氮源时,以及单因素(装液量、pH值、培养时间、摇床转速)试验的发酵液淀粉酶活性都高(表4)。
根据正交试验结果可知,因素D(摇床转速)对MX3菌株发酵液的淀粉酶活性的影响最小,经正交试验结果的方差分析,因素D的均差平方和太小,与其他3个因素的均差平方和相差太大,因此可以将其合并到误差效应中,用合并后的误差效应做F检验,自由度大,灵敏度更大。F0 01(2,2)=99 0,F0 05(2,2)=19 0,F0 10(2,2)=9 0,由表5可见,FA< F0 10,FB< F0 10,F0 10 3 结论与讨论 本试验研究生防放线菌MX3菌株代谢产物产淀粉酶的活性,通过单因素试验得出MX3菌株发酵液最佳单因素发酵条件:碳源为玉米粉、氮源为酵母膏、装液量为125 mL、温度为28 ℃、pH值为6 0、发酵时间为6 5 d、摇床转速 130 r/min。根据选定的最佳碳源、氮源的培养基配方和4因素3水平的L9(34)正交试验,确定最佳发酵条件组合,得出各因素的影响力排序为C>A>B>D,各因素的最优组合为A2B2C1D3,即生防放线菌MX3菌株发酵液的装液量为 125 mL、pH值为7 0、发酵时间为5 5 d、摇床转速为 200 r/min 时,MX3菌株发酵液的代谢产物产淀粉酶活性最大,为35 71 U/mL。经正交试验结果的方差分析可知,发酵时间(C)对MX3菌株发酵液的淀粉酶活性有显著影响,发酵液、pH值、摇床转速对MX3菌株发酵液的淀粉酶活性影响都不显著。通过本试验优化生防放线菌MX3菌株最佳产淀粉酶活性的发酵条件。刘雪珠等通过紫外线、超声波、热等多种物理诱变选育的产淀粉酶放线菌A24,经优化培养其酶活性为 353 67 U/mL [19],比本研究分离出的生防放线菌MX3菌株的淀粉酶活性高得多,主要是由于本研究的生防放线菌MX3菌株并未经过各种物理条件的诱导处理,其方法还须进一步研究。本研究分离出产淀粉酶生防放线菌MX3菌株,初步的酶学性质测定表明,该菌株应用前景较好,一方面放线菌MX3菌株既能被制成各种制剂应用于植物病害防治,同时不污染环境;另一方面能通过改良该菌株的遗传与基因工程,使其有利于淀粉酶工业发展。 参考文献: [1] 方羽生,杨卫华,张洪玲,等 放线菌对4种病原真菌的拮抗作用初探[J] 广东农业科学,2001(5):39-41 [2]魏艳敏,刘大群,田世民,等 链霉菌(Streptomyces spp )对几种蔬菜病原菌的拮抗作用[J] 河北农业大学学报,2000,23(3):65-68 [3]Adams P B The potential of mycoparasites for biological control of plant diseases[J] Annual Review of Phytopathology,1990,28:59-72 [4]Kortemaa H,Pennanen T,Smolander A,et al Distribution of antagonistic Streptomyces griseoviridis in rhtzosphere and nonrhizosphere sand[J] Journal of Phytopathology,1997,145(4):137-143
[5]陈立梅 玉米弯孢菌叶斑病菌拮抗链霉菌的分离、鉴定及其发酵条件探索[D] 长春:吉林农业大学,2006
[6]郭志英 生防菌剂接种方法对辣椒防病促生作用及根区微生态的影响[D] 杨凌:西北农林科技大学,2008
[7]韩 萍,魏云林 α-淀粉酶低温适应性分子机制的研究进展[J] 微生物学杂志,2006,26(4):77-81
[8]金志雄,毛达勇,张 珍,等 产α-淀粉酶菌株液体培养条件的探讨[J] 环境科学与技术,2006,29(2):32-33,116
[9]Konsoula Z,Liakopoulou-Kyriakides M Thermostable α-amylase production by Bacillus subtilis entrapped in calcium alginate gel capsules[J] Enzyme and Microbial Technology,2006,39(4):690-696
[10] 徐良玉,石贵阳,陶 飞,等 快速筛选耐酸性α-淀粉酶生产菌株的平板透明圈法[J] 无锡轻工大学学报,2003,22(5):91-94
[11]叶光斌,王彩虹,熊 俐,等 3株芽孢杆菌产酶性质的初步研究[J] 江苏农业科学,2013,41(7):240-242
[12] 邹艳玲,徐美娟,饶志明 耐热β-淀粉酶高产菌株的筛选及其产酶条件优化[J] 应用与环境生物学报,2013,19(5):845-850
[13]古丽娜孜,库米拉,张晓燕,等 低温淀粉酶高产菌株的诱变选育[J] 新疆农业大学学报,2013,36(4):288-292
[14]李 习 高产α-淀粉酶地衣芽孢杆菌的筛选及重组质粒的构建[D] 武汉:湖北工业大学,2014
[15]阿不都克里木·热依木,古丽米热·热孜 新疆鄯善产淀粉酶沙漠放线菌的生长特性研究[J] 新疆师范大学学报:自然科学版,2007,26(2):77-79
[16]王小琴,龚 斌,朱薇玲,等 放线菌327的发酵培养基筛选及培养条件优化[J] 中国酿造,2010,3(10):47-50
[17]陈双臣,刘爱荣,王晓清,等 放线菌株F培养条件优化和抗菌物质的稳定性研究[J] 生物技术,2009,19(2):76-79
[18]黄秀梨 微生物学实验指导[M] 北京:高等教育出版社,1999:114-115
[19]刘雪珠,杨小盼,王健鑫,等 海洋来源产淀粉酶放线菌的分离鉴定、诱变选育及培养条件优化[J] 浙江大学学报:理学版,2010,37(6):680-685,732endprint
