金线莲丛生芽增殖的液体悬浮培养条件优化
2015-09-10刘荣申刚罗晓青等
刘荣+申刚+罗晓青等


摘要: 研究金线莲液体悬浮培养的基本培养基和不同激素浓度配比对丛生芽增殖的影响,以筛选出金线莲丛生芽增殖液体悬浮培养的最优培养基和激素浓度配比,提高丛生芽增殖系数,为金线莲快速繁殖开辟一条新途径。结果表明:影响液体悬浮培养金线莲丛生芽增殖的主要因素是基本培养基和6-苄氨基嘌呤(6-BA),主次关系为6-BA>NAA>IAA>2,4-D。筛选得到的最佳培养条件是1/2MS+6-BA 2.5 mg/L+NAA 0.2 mg/L+IAA 0.3 mg/L+2,4-D 0.5 mg/L,外加蔗糖30 g/L,pH 值5.8。
关键词: 金线莲;丛生芽增殖;悬浮培养;正交设计
中图分类号: S682.310.4+3 文献标志码: A
文章编号:1002-1302(2015)08-0061-02
金线莲[Anoectochilus roxburghii(Wall. )Lindl]是一种兰科开唇兰属多年生草本,具有清热凉血、除湿解毒等多种功效,兼具赏叶和观花之功用,民间称其为“神药” [1-2]。金线莲喜阴凉、潮湿,为典型的阴性药用植物 [3]。因野生资源濒危,而且其种子小、种胚发育不全、发芽困难、对生长条件要求颇为严格,所以在自然条件下,该植物难以大量繁殖,利用组织培养进行繁殖可以有效保存种质资源及用于商业化生产 [3-5]。通过组织培养方法对珍稀植物进行快繁研究,不仅可以克服种子繁殖中存在的诸多问题,还可以克服扦插繁殖速度慢、繁殖率低、难生根等缺点,而且组织培养繁殖快,不受季节、环境条件和场地的制约 [6]。近年来,研究者们先后开展了金线莲的组织培养、内生真菌的分离、内生真菌与其共培养体系的建立及相互作用机制的研究 [7-11]。目前,金线莲组织培养快速繁殖技术主要通过原球茎增殖和丛生芽增殖2种途径进行。多数研究集中在原球茎增殖途径,但其历时较长且后代再生植株中有较高的变异率 [12-13],而丛生芽增殖途径能够克服此类难题 [14]。由于固体培养基存在营养分配不均、接触面积小等缺点,金线莲丛生芽增殖途径速度依然较慢,生长不均匀,影响标准化生产体系的建立。因此,食用液体悬浮培养可弥补以上缺点。本试验研究了液体悬浮培养的基本培养基和不同激素浓度配比对丛生芽增殖的影响,旨在为金线莲的快速繁殖开辟一条新途径。
1 材料与方法
1.1 试验材料
野外采集的金线莲植株。将采集回来的野生金线莲用自来水冲洗干净,彻底清理叶、叶苞鞘、根,用肥皂水浸泡 20 min,流水冲洗30 min,在超净工作台用75%乙醇消毒 30 s,0.1% HgCl2消毒10 min,无菌水洗3~5次,无菌滤纸拭干,将植株切为0.5 cm带节茎段,接种于固体培养基上诱导丛生芽。
1.2 基本培养基的选择
以MS、1/2MS、1/4MS为液体培养的基本培养基,每组培养基同时添加6-BA 0.2 mg/L+NAA 0.2 mg/L+蔗糖 30 g/L,pH值调至5.8。接种茎段于装有50 mL基本培养基的三角瓶中,在25 ℃ 120 r/min条件下振荡培养45 d,比较增殖效果。
1.3 激素浓度配比的筛选
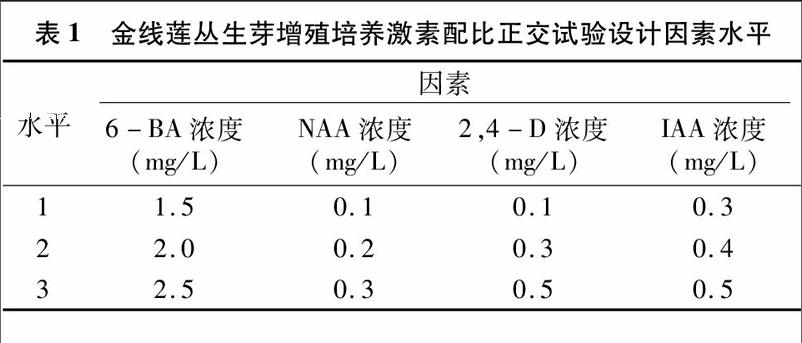
以1/2MS+30 g/L蔗糖为基本培养基,采用L9(34) 4因素3水平正交试验筛选6-苄氨基嘌呤(6-BA)、萘乙酸(NAA)、2,4-二氯苯氧乙酸(2,4-D)、吲哚乙酸(IAA) 的最佳配比,试验因素水平见表1。选取在固体培养基上诱导出的颜色较绿、长势良好的丛生芽作为接种材料,每个处理20瓶,每瓶接种5个丛生芽,接种后在25 ℃ 120 r/min条件下振荡培养45 d后观察长势,计数。数据分析采用SPSS 200软件进行。
2 结果与分析
2.1 基本培养基对丛生芽增殖的影响
由表2可见,金线莲在1/2MS液体培养基中培养后的芽数达到最高,生长状况最佳,其后依次为1/4MS、MS。由此看出,1/2MS是金线莲丛生芽增殖的最佳液体基本培养基。
2.2 不同浓度激素配比对丛生芽增殖的影响
正交试验方差分析。从单因素水平出发,由表4、表5可见,6-BA对增殖芽数有显著影响(P<0.05),其他激素无显著影响,所以数据未列出。方差分析结果(表6)表明,6-BA 的P<0.05,NAA 和IAA的P>0.05;而且F值显示6-BA>NAA>IAA,说明6-BA能显著促进金线莲液体悬浮培养丛生芽增殖,而NAA 和IAA表现为无显著性差异。综合以上试验结果,金线莲液体悬浮培养丛生芽增殖的最佳培养条件是6-BA 2.5 mg/L+NAA 0.2 mg/L+IAA 0.3 mg/L+2,4-D 0.5 mg/L,外加蔗糖30 g/L,pH值5.8。
3 结论与讨论
金线莲的组织培养技术研究较早,影响其组织培养的因素主要有基本培养基、不同添加物、激素配比及培养条件等,其中激素配比尤为重要 [15-17]。金线莲成苗主要通过原球茎和丛生芽2种途径进行,据相关研究,原球茎的年理论增殖系数能达到1.83×106 [18]。但是原球茎途径从诱导起始材料开始,必须经历脱分化和再分化,这比丛生芽途径多用2个多月的时间,而且长出来的苗大多数纤细,还必须壮苗才能培养出更好的植株,另外原球茎后代再生植株中变异率较高,难以保持母株的优良遗传特性。为了进一步减少遗传变异的发生,有人提出采用丛生芽途径直接出苗。这在大花蕙兰和蝴蝶兰的组织培养快速繁殖中已取得成功 [19-20]。丛生芽途径可以直接出苗,1个芽在2.5个月内增殖6.53倍,年理论增殖系数约为0.82×104,其繁殖系数比原球茎低2个数量级,但丛生芽途径繁殖周期短,而且可以跨越原球茎途径中的分化、壮苗等;不仅节约了时间,还降低了生产成本,最主要的是丛生芽途径再生植株变异率低,能较好地保持母株优良特性。
液体悬浮培养在铁皮石斛、大花蕙兰等植物中已获得成功。因此,本试验确认1/2MS为金线莲丛生芽液体悬浮培养的基本培养基,在此基础上,采用正交试验研究6-BA、NAA、2,4-D、 IAA等4种激素浓度配比对液体悬浮培养金线莲丛生芽增值的影响,得出金线莲液体悬浮培养丛生芽增殖的最佳培养条件为6-BA 2 5 mg/L+NAA 0 2 mg/L+IAA 0 3 mg/L+2,4-D 0 5 mg/L,外加蔗糖30 g/L,pH值5 8。其中影响较大的激素是6-BA,其他3种激素对其的影响均不显著。
参考文献:
[1] 赵元藩 金线莲的开发利用价值及林下栽培技术初步研究[J] 林业调查规划,2008,33(3):61-63
[2]钟岑生 金线莲的药用价值与开发[J] 广西农业科学,1997(2):51-53
[3]杨柏云,高荫榆,李春华,等 金线莲原球茎的诱导与快速繁殖[J] 安徽农业科学,2008,36(10):3999-4001
[4]阚世超,张明生,李 花 金线莲丛生芽诱导研究[J] 安徽农业科学,2009,37(3):981-982
[5]肖木兴 台湾金线莲增殖培养试验[J] 福建林业科技,2007,34(2):124-126
[6]吴安湘,金晓玲,熊 芳 珍稀濒危植物组织培养研究进展[J] 西北植物学报,2006,26(1):211-216
[7]于雪梅,郭顺星 金线莲与内生真菌共生培养体系的建立[J] 中国中药杂志,2000,25(2):17-19
[8]唐明娟,郭顺星 内生真菌对台湾金线莲栽培及酶活性的影响[J] 中国中药杂志,2004,29(6):28-31
[9]唐明娟,孟志霞,郭顺星,等 内生真菌对福建金线莲栽培及酶活性的影响[J] [HJ1 86mm]中国药学杂志,2008,43(12):890-893
[10] 罗安雄,孟志霞,陈晓梅,等 福建金线莲种子萌发及幼苗培养研究[J] 中国药学杂志,2012(15):1199-1203
[11]伍成厚,冯毅敏,贺漫媚,等 金线莲种子培养的研究[J] 中国野生植物资源,2008,27(1):47-50
[12]何松林,十鸟三和子,王 献,等 不同基本培养基及培养方式对文心兰原球茎增殖的影响[J] 华北农学报,2001,16(1):88-91
[13]Kerbally G B In vitro flowering of oncidirm varicosum meri-clones[J] Plant Science Letters,1984,35(1): 73-75
[14]丁 兰,付庭治 兰花生物工程研究进展[J] 西北师范大学学报:自然科学版,2000,36(3):111-116
[15]韩晓红,王春龙,段春红 不同激素水平对金线莲组织培养的影响[J] 广东农业科学,2012,39(18):94-97,封2
[16]刘润东,郭文杰,林忠宁,等 金线莲组织培养及营养成分的分析研究[J] 广西农业科学,2006,37(5):506-509
[17]陈汉鑫,王雅英,杨忠耿,等 金线莲组织培养快繁技术[J] 广西农业科学,2004,35(4):325-326
[18]张正梁,尹 华 文心兰分株繁殖和控花栽培[J] 中国花卉园艺,2003(12):26-27
[19]李进进,廖俊杰,柯丽婉,等 蝴蝶兰根段的组织培养[J] 植物生理学通讯,2000,23(1):37
[20]郑迎冬,杨承勇,蒋 林 大花蕙兰的茎段培养[J] 仲恺农业技术学院学报,2000,13(1):19-22
