滨麦草与百萨偃麦草PHR1基因的克隆及序列分析
2015-09-09张雪莹李太强王洪刚等
张雪莹 李太强 王洪刚等


摘要:充分挖掘植物自身磷高效利用的生物学潜力,提高农作物对土壤难溶性磷的吸收和利用效率,对于培育磷高效利用的作物新品种、减少肥料投入和保护生态环境具有十分重要的意义。PHR1基因是植物磷信号调控网络的重要低磷应答转录因子,本研究利用同源克隆的方法,分别从小麦近缘植物滨麦草和百萨偃麦草中克隆获得了其PHR1基因序列。滨麦草LmPHR1和百萨偃麦草TbPHR1基因的ORF均为1 356 bp,编码451个氨基酸;与已报道的小偃54A1、B1、D1的PHR1基因高度同源,一致性达到98.63%;对两基因的氨基酸序列进行预测,结果表明它们均具有MYB-DNA结合结构域和一个预测的CC(Coiled coil)结构域;利用ClustalX软件对已报道的水稻、小麦等PHR1基因进行聚类分析并构建系统进化树,结果显示,TbPHR1基因与二穗短柄草、水稻、玉米、拟南芥的PHR1基因在进化关系上更近一些,而LmPHR1基因与其他植物的PHR1基因进化关系较远。
关键词:滨麦草;百萨偃麦草;PHR1基因;同源克隆
中图分类号:S512.9+S188 文献标识号:A 文章编号:1001-4942(2015)08-0001-06
Abstract To fully explore the plant potential for high-efficiency phosphorus utilization and enhance the plant absorption and use efficiency of insoluble phosphorus in soil will play important roles in breeding new varieties, reducing fertilizer input and protecting agro-ecological environment. PHR1 is an important transcription factor of multiple Pi starvation responses in Pi signaling pathways. By homologous cloning, two PHR1 genes were cloned from Elymus mollis and Thinopyrum bessarabicum, which were named as LmPHR1 and TbPHR1. Their ORFs were both 1 356 bp, and both of them encoded 451 amino acids; their cDNA sequences shared 98.63% identity with the cDNA sequences of Xiaoyan 54 PHR1-A1, PHR1-B1, PHR1-D1. Their encoded proteins both had a MYB DNA binding domain and a predicted coiled-coil domain. Using the ClustalX for phylogenetic analysis of the two PHR1 genes with the reported PHR1 genes in rice and wheat, ect. The results showed that PHR1 had closer evolutionary relationship with the PHR1s from Brachypodium distachyon, Oryza sativa, Zea mays and Arabidopsis thaliana; while the LmPHR1 had more faraway evolutionary relationship with other plants PHR1 genes.
Key words Leymus mollis; Thinopyrum bessarabicum; PHR1 gene; Homologous clone
磷是植物生长发育所必需的营养元素之一,然而由于被土壤固定成为植物难以利用的形式(如有机磷、磷酸铝、磷酸铁等)或随水流失,磷肥的利用率很低,导致土壤磷的“遗传学缺乏”,即土壤中总磷含量高,但能被植物吸收利用的磷(有效磷)却很低[1~3]。
磷缺乏是影响植物生长的一个主要营养胁迫。植物已进化出一系列复杂的代谢途径来适应环境长期的磷元素营养缺乏,主要通过诱发形态学的变化、生理生化过程的变化以及与菌类共生等,这些统称为低磷胁迫应答反应。这些应答反应涉及数百个磷胁迫可诱导基因的协同作用,它们可以调整植物体内磷利用的优先顺序,同时提高体外对磷的吸收[4]。最近几年通过对拟南芥和水稻两种模式植物的低磷芯片数据分析发现,植物对低磷反应的适应性调控机制主要发生在转录水平上,目前已经分离鉴定到了多个参与低磷反应的关键转录因子,包括:PHR1、WRKY75、ZAT6、MYB62、PTF1、bHLH32。PHR1属于MYB类转录因子,是第一个鉴定到的参与拟南芥低磷反应的转录因子,它以二聚体的形式结合在磷响应基因的启动子区P1BS序列,调控下游基因的表达[5~7];最新研究表明,PHR1基因在磷胁迫光合作用调控中也起重要作用,并在磷胁迫时参与调控脂质重塑和三酰甘油积累[8,9]。目前已从多种植物中克隆到了PHR1基因,如拟南芥[5]、水稻[10]、小麦[11]、玉米[12]、欧洲油菜[13]等。
滨麦草(Leymus mollis,2n=28,JJNN)和百萨偃麦草(Thinopyrum bessarabicum,2n=14,JJ)是小麦重要的野生近缘植物,滨麦草属植物主要集中于环境条件恶劣地区,因此保留了野生植物的抗性、耐逆等优良基因,具有耐盐碱、耐旱、耐瘠薄等优良耐力以及抗叶锈病、条锈病、秆锈病、白粉病、赤霉病、蚜虫等优良抗性[14]。百萨偃麦草为自花授粉的多年生海岸禾草,原产于黑海和地中海沿岸,是偃麦草属中基因组最简单的二倍体物种,对环境胁迫和生物胁迫具有很强的抗性,是小麦遗传改良的重要资源,研究人员已利用远缘杂交等手段将其部分优良特性基因转入小麦[15]。然而,现有研究主要集中在抗病基因的挖掘上,对于抗逆境耐瘠薄等基因的研究很少。endprint
本研究以滨麦草和百萨偃麦草为材料,克隆其PHR1基因并进行序列和遗传进化分析,为今后小麦磷高效新品种的培育及遗传改良提供优良的基因资源。
1 材料与方法
1.1 试验材料
本试验所用材料为滨麦草(Leymus mollis)与百萨偃麦草(Thinopyrum bessarabicum),滨麦草引自西北农林科技大学,百萨偃麦草引自南京农业大学,均种植于山东农业大学农学院温室。
1.2 试验方法
1.2.1 RNA提取及cDNA第一链的合成 取滨麦草与百萨偃麦草幼叶,利用RNAsimple Total RNA Kit(天根公司)提取植物总RNA,提取步骤按试剂盒说明书进行。cDNA第一链合成用TransScript First-Strand cDNA Synthesis SuperMix(全式金公司),步骤按试剂盒说明书进行。
1.2.2 基因克隆 以cDNA第一链为模板扩增目的基因,所用引物为F(5′-ATGAGGARGTKTGATCTGAGRC-3′)、R(5′-TTAACTATCATGCASYCTWCG-3′)。PCR反应体系为15 μL,依次加入反转录产物2 μL,LA Taq 0.2 μL,Buffer I 7.5 μL,2.5 mmol/L dNTP 2.4 μL,正向引物(10 mmol/L)1 μL,反向引物(10 mmol/L)1 μL,最后加水至15 μL。PCR反应条件:95℃预变性5 min;94℃变性40 s,50℃退火30 s,72℃延伸2 min,35个循环;最后72℃延伸10 min,4℃保存。PCR产物经琼脂糖凝胶电泳后,切胶回收。将回收片段连pEASY-T1载体(全式金公司),转化大肠杆菌DH5α感受态细胞。取阳性克隆送上海桑尼公司测序。
1.2.3 序列比对与系统进化树分析 将序列通过NCBI数据库(http://www.ncbi.nlm.nih.gov/)进行Blast比对,下载其他物种的PHR1基因序列及蛋白序列。利用DNAMAN软件,对PHR1的cDNA序列及蛋白序列进行同源比对分析,并构建系统进化树,采用默认参数设置。
2 结果与分析
2.1 LmPHR1和TbPHR1基因的克隆及序列分析
以滨麦草和百萨偃麦草cDNA为模板,利用兼并引物进行PCR扩增,获得了各自的PHR1基因全长,分别命名为LmPHR1和TbPHR1。两基因的开放阅读框(Open reading frame,ORF)均为1 356 bp,编码451个氨基酸。起始密码子为ATG,终止密码子为TTA。LmPHR1和TbPHR1与报道的小偃54A1、B1、D1的PHR1基因序列一致性均为98.63%(见图1)。
2.2 同源性分析
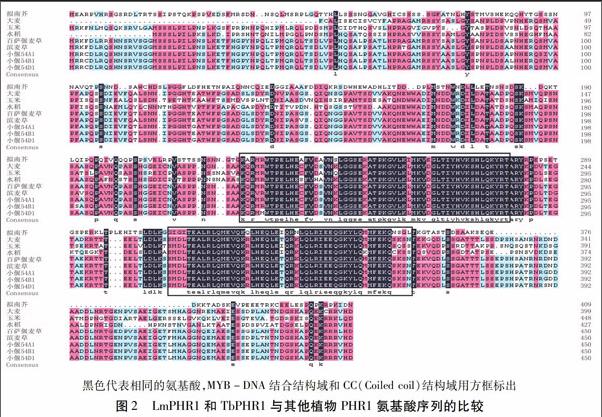
利用DNAMAN软件对推导的LmPHR1和TbPHR1氨基酸序列与拟南芥、大麦、玉米、水稻、小麦的PHR1氨基酸序列进行同源性分析,结果(图2)显示,氨基酸序列比对一致性为79.88%,LmPHR1和TbPHR1与小偃54和大麦的PHR1氨基酸序列同源性较高,而与水稻、玉米、拟南芥的氨基酸同源性较低;保守结构域及特征序列的同源性相对较高一些,均存在MYB-like DNA-binding结构域和MYB-CC-LHEQLE转录激活域,其中DNA-binding结构域由55个氨基酸组成,在不同的植物中非常保守。
2.3 LmPHR1和TbPHR1基因的系统进化分析
为进一步了解LmPHR1和TbPHR1与其他植物PHR1之间的进化关系,在多重比对的基础上,用上述9个PHR1基因序列与二穗短柄草的PHR1基因序列构建系统进化树,结果(图3)显示,TbPHR1与二穗短柄草和小偃54的PHR1基因的进化关系更近一些,而LmPHR1与其他植物的PHR1基因进化关系较远。
3 结论
PHR1被认为是植物磷胁迫基因调控网络中的核心调控因子,其表达水平基本不受外界磷浓度的影响,但控制着一部分低磷反应,如花青素的积累以及部分IPS基因的表达。本研究成功克隆了滨麦草与百萨偃麦草的PHR1基因的全长,并对其进行了序列比较和遗传进化分析。结果显示,LmPHR1和TbPHR1均与小偃54的PHR1基因序列和氨基酸序列高度同源,与已报道的大麦PHR1氨基酸序列一致性也较高,两个结构域的基因序列高度保守;在进化关系上,TbPHR1与二穗短柄草和小偃54进化关系更近一些,而LmPHR1与其他植物的PHR1进化关系较远。该试验结果为进一步研究LmPHR1和TbPHR1的功能及磷胁迫响应机制奠定了基础,也为小麦磷高效新品种的培育及利用基因工程手段改良小麦提供了优良的基因资源。
参 考 文 献:
[1] 林海建,张志明,高世斌,等.玉米耐低磷研究现状及磷高效育种策略的探讨[J].中国农学通报, 2008, 24(1): 181-185.
[2] Tilman D. Global environmental impacts of agricultural expansion: the need for sustainable and efficient practices[J].Proceeding of the National Academy of Sciences of the United States of America, 1999, 96(11): 5995-6000.
[3] 鲁如坤,史陶钧.土壤磷素在利用过程中的消耗和积累[J].土壤通报, 1980(5): 6-8.
[4] Yuan H, Liu D. Signaling components involved in plant responses to phosphate starvation[J]. Journal of Integrative Plant Biology, 2008, 50(7): 849-859.endprint
[5] Rubio V, Linhares F, Solano R, et al. A conserved MYB transcription factor involved in phosphate starvation signaling both in vascular plants and in unicellular algae[J]. Genes & Development, 2001, 15(16): 2122-2133.
[6] Wykoff D D, Grossman A R, Weeks D P, et al. Psr1, a nuclear localized protein that regulates phosphorus metabolism in Chlamydomonas[J].Proceeding of the National Academy of Sciences of the United States of America, 1999, 96 (26): 15336-15341.
[7] Nilsson L, Müller R, Nielsen T H. Increased expression of the MYB-related transcription factor, PHR1, leads to enhanced phosphate uptake in Arabidopsis thaliana[J]. Plant, Cell & Environment, 2007, 30(12): 1499-1512.
[8] Nilsson L. The MYB-related transcription factor PHR1plays a central role in adjusting photosynthesis during phosphate starvation[D]. Copenhagen:University of Copenhagen, 2014.
[9] Pant B D, Burgos A, Pant P, et al. The transcription factor PHR1 regulates lipid remodeling and triacylglycerol accumulation in Arabidopsis thaliana during phosphorus starvation[J]. Journal of Experimental Botany, 2015: eru535.
[10]焦芳婵. 水稻低磷胁迫相关转录因子OsPHR1和OsPHR2的研究[D]. 杭州:浙江大学, 2005.
[11]Wang J, Sun J H, Miao J, et al. A wheat phosphate starvation response regulator Ta-PHR1 is involved in phosphate signaling and increases grain yield in wheat[J]. Annals of Botany, 2013, 111:1139-1153.
[12]王秀红. 玉米低磷应答转录因子ZmPHR1的克隆及功能分析[D]. 太原:山西大学, 2013.
[13]Ren F, Guo Q Q, Chang L L, et al. Brassica napus PHR1 gene encoding a MYB-like protein functions in response to phosphate starvation[J]. PLoS ONE, 2012, 7(8): e44005.
[14]何方. 小麦—滨麦草中间材料的创制及鉴定[D]. 泰安:山东农业大学, 2008.
[15]温辉芹, 裴自友, 任永康. 简单重复序列 (AAG)5 在百萨偃麦草染色体上的分布[J]. 山西农业科学, 2011, 39(6): 505-507.endprint
