刚性与柔性连接的骨架型二芳烯聚合物
2015-09-08张诗曼张复实邓爱明
张诗曼,张复实,邓爱明
(1西南技术工程研究所,重庆 400039;2清华大学化学系,北京 100084)
刚性与柔性连接的骨架型二芳烯聚合物
张诗曼1,2,张复实2,邓爱明1
(1西南技术工程研究所,重庆 400039;2清华大学化学系,北京 100084)
以二芳基乙烯(二芳烯)为共聚单体之一,通过便捷的合成步骤,合成了两个骨架型二芳烯类聚合物,研究了其溶解性、光致变色能力及抗疲劳性等性质。所得到的两个二芳烯聚合物均具有可逆的光致变色能力和优秀的抗疲劳性。在两个聚合物合成过程中,二芳烯与共聚单元的连接分别采用刚性和柔性两种连接方式,从而得到了具有不同分子量及光谱性质的二芳烯聚合物。
光化学;光致变色;聚合物;合成;抗疲劳性
引 言
光致变色类化合物在光或热的刺激下可以在两种异构体之间互相转化,导致化合物吸收光谱发生改变,其他诸如氧化还原性[1-4]、折射率[5-6]、介电常数[7-9]、荧光性质[10-12]等均会发生变化。二芳基乙烯类化合物(简称二芳烯)是一类热稳定性及抗疲劳性表现突出的光致变色化合物,自从 1988年Irie等[13]报道的第一个二芳烯分子开始,在近30年的研究中,吸引了大批研究者的目光。将二芳烯结构单元以化学键的形式引入到聚合体系中,形成二芳烯聚合物,提高了二芳烯的成膜能力和固相中分散能力,使二芳烯向实际应用更进一步。
将二芳烯作为单体之一,和二芳烯本身或者另外的单体进行聚合,得到聚合物主链上具有二芳烯单元的聚合物称为骨架型(backbone)二芳烯聚合物。第一个骨架型二芳烯聚合物是1999年Stellacci 等[14-15]设计的,得到相对分子质量为3000左右的均聚型二芳烯聚合物,理论上二芳烯单元含量为100%,并且表现出非常高的环化量子产率(86%)。Irie等[16]在同一年报道了另一骨架型二芳烯聚合物,通过Suzuki耦合与二辛基芴(dioctylfluorene)衍生物进行聚合,得到共聚型的二芳烯聚合物。随后,众多课题组加入到二芳烯聚合物的研究当中,设计出了一大批各具特色的二芳烯聚合物[17-19]。
由于二芳烯单元的合成路线一般较长,合成二芳烯聚合物效率较低,并且对于二芳烯聚合物的性质几乎无法预测,甚至得到的聚合物无法进行光致变色反应。在本文中,利用简洁的路线合成了两种骨架型二芳烯聚合物,并且通过改变二芳烯单体和另外单体的连接方式,得到了具有不同性质的二芳烯聚合物。
1 实验材料和方法
1.1实验原料和仪器
实验所用2,3,4,5,6-五氟苯甲酸为南京康满灵化工实业有限公司购买,硫酸肼、多聚磷酸为国药集团化学试剂有限公司购买,丁基锂、戊二酰氯为阿尔法试剂公司购买,AlCl3、5-氯-2-甲基噻吩、锌粉、对羟基苯硼酸为百灵威试剂有限公司购买,其余常见溶剂和无机盐为北京化工厂购买。
核磁共振使用Varian 400MHz进行测试,质谱采用 KYKYZHP-5型快原子轰击质谱仪和BEFLEXIII激光飞行质谱进行测试,元素分析采用Flash EA 1112型元素分析仪,紫外-可见吸收光谱HP8452A进行采集,紫外光源为 Mejiro precision SHG-200,可见光光源为北京光电仪器全波长氙灯。凝胶渗透色谱(GPC)采用Water 2410型仪器(采用10.3、10.4和10.5 nm μ-Styragel串联柱,以DMF为流动相,工作温度35℃,流速1.0 ml·min-1。以线性聚苯乙烯为标准物计算聚合物分子量。)
1.2合成路线
聚合物1的合成路线见图1。
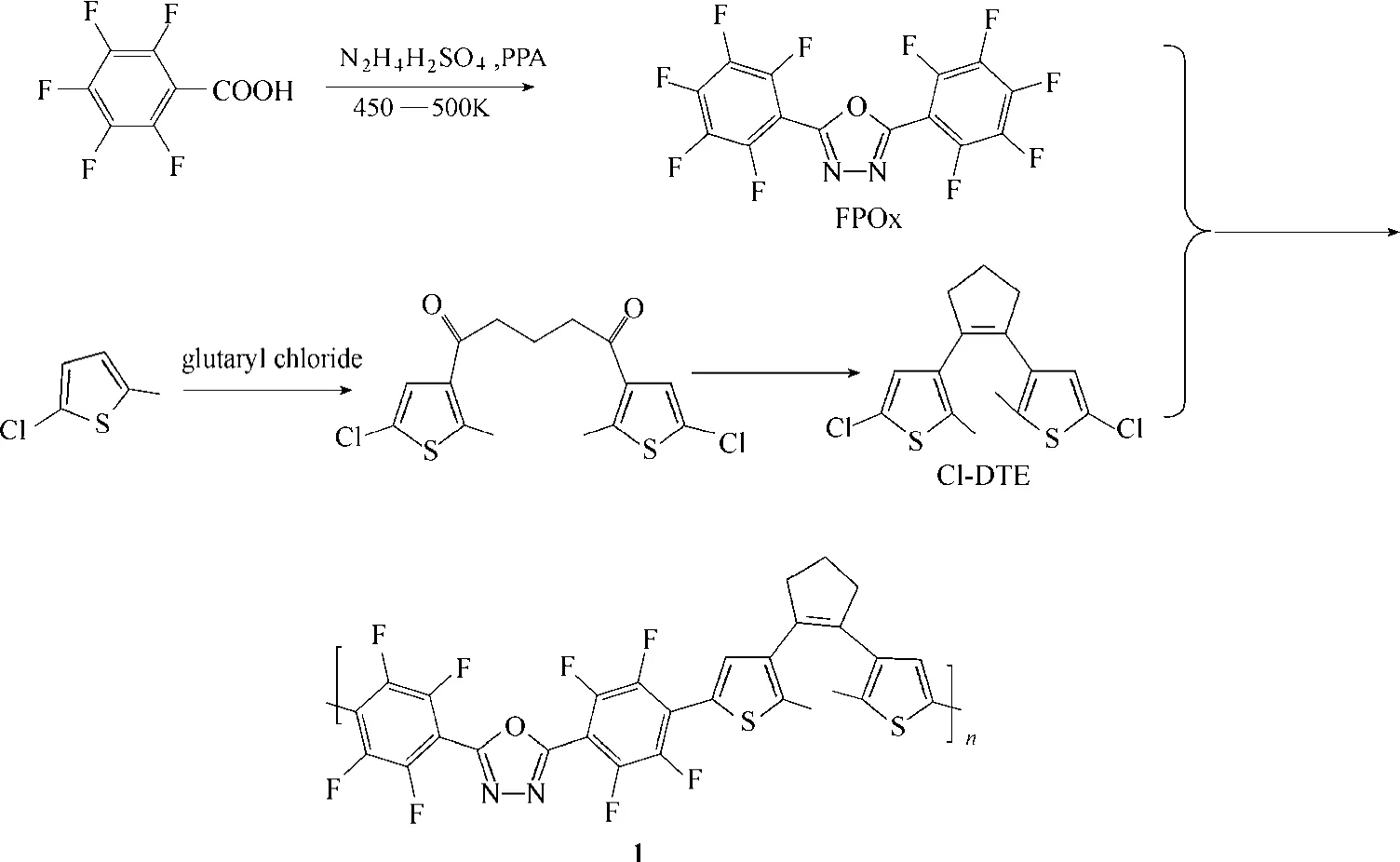
图1 骨架型二芳烯聚合物聚合物1合成路线Fig.1 Synthesis route of backbone polymer 1
Cl-DTE合成[20]:在氩气保护下,将16 g(94 mmol)戊二酰氯溶于200 ml CH2Cl2中,加入无水AlCl330 g(225.6 mmol),缓慢滴加含有25 g(188 mmol)的5-氯-2-甲基噻吩的CH2Cl2溶液100 ml,继续反应8 h。加入50 ml水终止反应,95%乙醇水溶液重结晶。
在氩气保护下,取锌粉34.65 g放入精制后的四氢呋喃(THF)200 ml中,注射TiCl417.16 ml, 搅拌均匀后,加热回流1 h。避光情况下把含11 g上步产物的 THF溶液200 ml在24 h内滴加到烧瓶内,继续反应12 h。加入饱和K2CO3溶液50 ml终止反应。反应液用乙酸乙酯萃取,有机相用无水MgSO4干燥过夜。粗产品用95%乙醇水溶液重结晶。
Cl-DTE:1H NMR (400 MHz, CDCl3) δ=1.88 (s, 6 H), 1.92~2.10 (m, 2 H), 2.69 (t, J=7.5 Hz, 4 H), 6.58 (s, 2 H)。13C NMR (400 MHz, CDCl3) δ=15.1, 23.8, 39.1, 126.0, 127.2, 134.0, 135.3, 135.7。MS: m/z=328 [M+]。IR: 2953 cm-1, 2916 cm-1, 2841 cm-1, 1640 cm-1, 1551 cm-1, 1455 cm-1, 1437 cm-1, 1311cm-1, 1197 cm-1, 1159 cm-1, 1140 cm-1, 991 cm-1, 830 cm-1, 822 cm-1, 746 cm-1, 666 cm-1, 481 cm-1。C15H14Cl2S2: calcd. C 54.71, H 4.29; found C 54.63, H 4.30。
FPOx的合成:用多聚磷酸为溶剂和催化剂,将摩尔比3:2的五氟苯甲酸与硫酸肼在200℃反应5 h,得到棕红色溶液。冷却至室温,然后将反应液倒入大量去离子水中,得到白色沉淀。此白色沉淀用异丙醇与甲苯(体积比1:3)混合溶液进行重结晶,得到白色针状晶体,产率为88%。
19F NMR: δ=-135 (m, 4F, ortho to Ox);-146 (m, 2F, para to Ox);-159 (m, 4F, meta to Ox)。MS: m/z=402 [M+]。IR: 1653 cm-1, 1556 cm-1, 1526 cm-1, 1496 cm-1, 1422 cm-1, 1366 cm-1, 1321 cm-1, 121 cm-1, 1092 cm-1, 1042 cm-1, 993 cm-1, 978 cm-1, 844 cm-1, 812 cm-1, 751 cm-1。元素分析C:41.75;N:6.95;O:4.00(理论值C:41.81;F:47.24;N:6.97;O:3.98)。
聚合物1的合成:0.2 g(0.6 mmol)Cl-DTE,溶于20 ml THF中,氮气保护下,搅匀,缓慢滴入丁基锂0.5 ml(2.4 mol·L-1正己烷溶液) 。滴完反应3 h,加入5 ml含0.245 g FPOx的四氢呋喃溶液。继续反应5 h,将反应液倒入200 ml去离子水中,得到黄色沉淀,抽滤,固体用甲醇洗三遍,真空干燥得聚合物1为 0.27 g,产率71%。
19F NMR: δ=-130~-132, -135~-137;-148.49 (s);-152~-154;-155.67 (s); -156.44 (s)。GPC:Mn=184000,PDI=1.57。
聚合物2的合成路线见图2。

图2 聚合物2的合成路线Fig.2 Synthesis route of backbone polymer 2
OH-DTE的合成:按照文献所述方法合成OH-DTE[21],0.72 g(2.2 mmol)Cl-DTE,0.6 g(4.4 mmol)对羟基苯硼酸溶于30 ml THF中,加入碳酸钠(3.04 g)水溶液20 ml。加热回流,加入Pd(PPh3)40.2 g(0.17 mmol),回流15 h。所得粗产品用柱色谱分离OH-DTE 130 mg。二芳烯Cl-DTE转化率45%。
OH-DTE:1H NMR (400 MHz, CDCl3) δ=7.33 (d, J=8.0 Hz, 4H), 6.85 (d, J=8.0 Hz, 4H), 6.92 (s, 2H), 2.00 (s, 6H); 2.81 (t, J=7.5 Hz, 4H), 1.82~2.04 (m, 2H);13C NMR (400 MHz, CDCl3) δ=23.01, 38.21, 115.69, 123.12, 126.86, 127.68, 133.43, 134.66, 136.72, 139.56; MS: m/z =444.0 [M+]。
聚合物2的合成:将OH-DTE 389 mg(0.87 mmol)和FPOx 0.35 g(0.87 mmol)溶于DMAc 30 ml中,搅拌均匀后,加入K2CO30.36 g(2.6 mmol),在冰水浴下搅拌 8 h,停止搅拌。将反应液倾倒入300 ml甲醇与去离子水(体积比1:1)的混合溶液中,得浅黄色沉淀,抽滤。固体用甲醇冲洗3遍,抽滤,烘干,得产物聚合物2,产率为92%。
1H NMR (400 MHz, CDCl3): δ=2.01 (s, 6H); 2.04~2.11 (m, 2H); 2.82~2.86 (m, 4H); 6.93~7.02 (m, 4H); 7.46~7.50 (m, 4H); 7.02 (s, 2H);19F NMR: δ=-136 (s, 4F); -152 (s, 4F); GPC: Mn=7400, Mw=8000; IR: 3434 cm-1, 2925 cm-1, 2850 cm-1,1676 cm-1, 1650 cm-1, 1512 cm-1, 1479 cm-1, 1215 cm-1, 1166 cm-1, 991 cm-1, 850 cm-1, 816 cm-1。
2 实验结果与讨论
2.1聚合物分子量
表1总结了两个聚合物的分子量及分子量分布情况,可以看出,聚合物1的分子量高达18万多,而聚合物2分子量仅为7400,并且聚合物1的分子量分布比聚合物2分布更宽。聚合物1采用的是强烈的聚合条件,以丁基锂为脱卤试剂,得到反应活性强的锂盐,再用锂盐和芳香F原子发生取代反应,在如此强的条件下,聚合反应几乎是无法控制的,一旦丁基锂反应完,加入FPOx之后立即会生成大量聚合物。而聚合物2采用的是温和的聚合条件,在常温下利用酚羟基和芳香 F原子的亲核取代反应,反应速率较慢,中间体活性也不如锂盐,所以得到的聚合物分子量较小。

表1 二芳烯聚合物分子量Table 1 Molecular weight of polymers
2.2聚合物溶解性
表 2总结了两个聚合物、单体 Cl-DTE、单体FPOx的溶解性。Cl-DTE分子量比较小,在大部分有机溶剂里面都具有良好的溶解性,而FPOx作为具有大共轭体系的芳香类化合物,在醇类、烷烃类溶剂中溶解性都不好,在非质子极性溶剂如DMF、DMSO、氯仿等中溶解能力都很好。聚合物1 和聚合物2都和FPOx的溶解性类似,只在部分强溶剂中可溶,在醇类溶剂溶解性不好。相比聚合物 1,聚合物2的溶解能力显著增强,原因一是由于聚合物1分子量比聚合物2大20多倍,分子量的增加使得溶解度下降,另外一个原因在于聚合物1的二芳烯单元和FPOx单元之间相连,整个聚合物是一个刚性较强的结构,所以溶解能力相比具有苯氧基桥连的聚合物2也会有所下降。

表2 二芳烯聚合物溶解性表Table 2 Solubility of two polymers
2.3聚合物的光谱性质
聚合物1在溶液中的光谱图如图3所示。光照前,溶液为无色透明溶液,在可见光区域没有吸收,用254 nm的紫外线照射后,溶液变成浅红色,紫外可见吸收光谱在400~600 nm出现吸收带,可见区最大吸收位于512 nm处。此时用大于500 nm的可见光照射,溶液会在2 min内完全褪色,吸收光谱也回到光照前状态。由此证明,聚合物1 在溶液中具有可逆光致变色的特点。
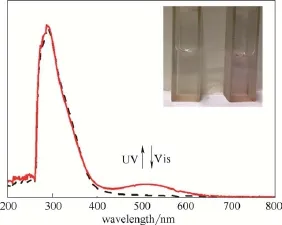
图3 聚合物1在DMF溶液中吸收光谱图Fig.3 UV-Vis spectra of polymer 1 in DMF
将聚合物2 溶于DMF中,测定其在溶液中的光谱性质,光谱图如图4所示。紫外光照前,溶液为无色透明溶液,吸收光谱在可见区没有吸收;用254 nm的紫外线照射后,溶液变成紫红色,其吸收光谱在400~600 nm出现吸收带,其中可见区最大吸收峰在528 nm处。当用大于500 nm的可见光照射后,溶液变回无色,吸收光谱也回到光照前状态,证明聚合物 2在溶液中同样具有可逆的光致变色特点。
图4 聚合物2 在DMF溶液中紫外可见吸收光谱Fig.4 UV-Vis spectra of polymer 2 in DMF
将聚合物 1和 2分别与聚合前单体二芳烯相比,聚合物1 的闭环态最大吸收峰比Cl-DTE红移了60 nm,聚合物2与二芳烯单体OH-DTE类似,可见区最大吸收在520 nm左右。从结构上分析,聚合物1聚合后氯原子被共轭的全氟苯二唑结构取代,共轭程度的增加使得分子光谱发生了红移。在聚合物2 中,二芳烯单元与FPOx是间接相连,二芳烯共轭范围没有显著提高, 所以其闭环态吸收保持了单体的特点。由此可以看出,二芳烯和侧基的不同连接方式对二芳烯性质有不同的影响,从单体的吸收位置可以预测形成聚合物后的吸收范围。
抗疲劳性对光致变色化合物尤为重要,图5为聚合物1和聚合物2在DMF溶液中的抗疲劳性。图中纵坐标为反复光照时,闭环态最大吸收吸光度Ai和第一次达到闭环态光稳态时此处吸光度 Ao的比值。
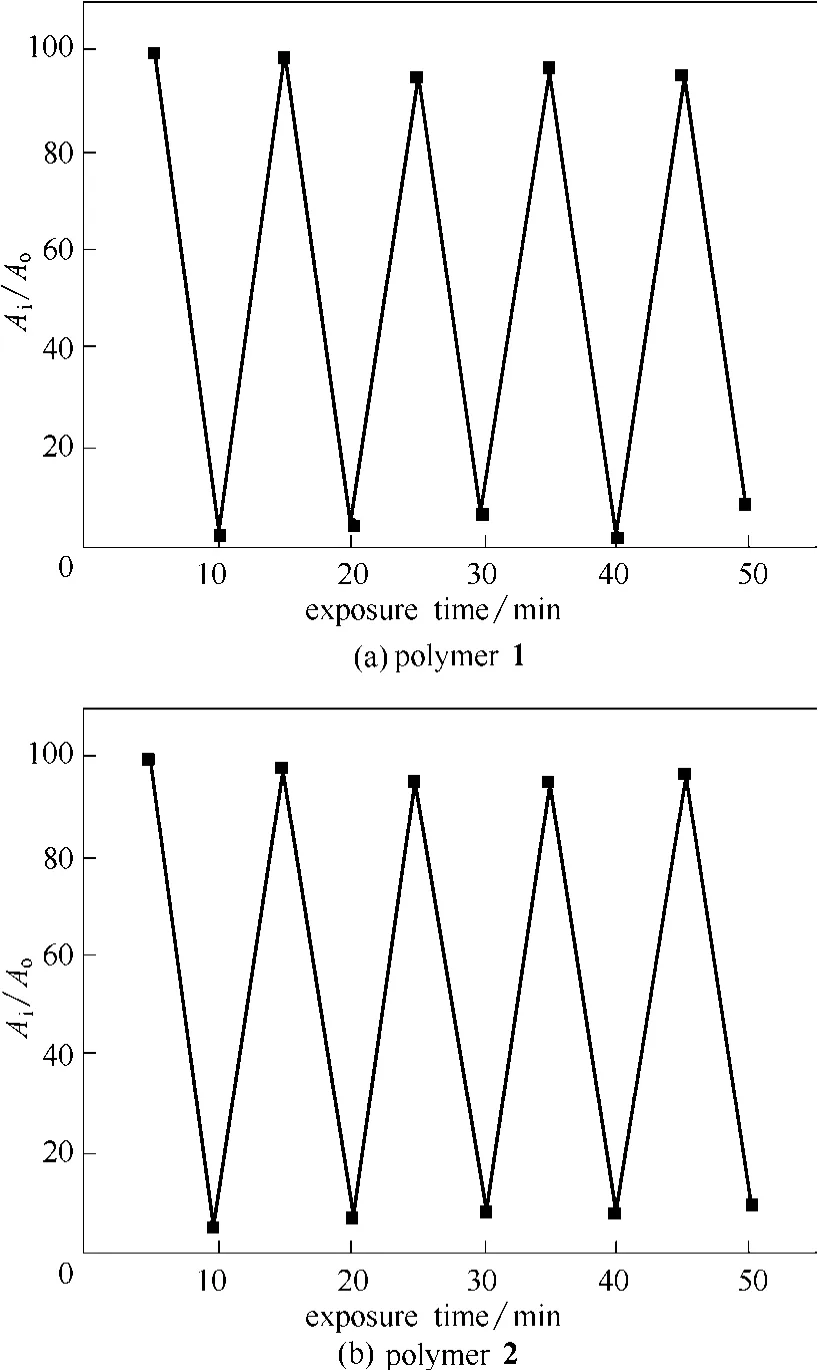
图5 聚合物1和聚合物2在DMF溶液中的抗疲劳Fig.5 Fatigue resistance of polymer 1 and polymer 2 in DMF
从图中可以看出,在紫外线和可见光交替照射下,吸收光谱能可逆地变化,经过50 min的连续曝光后,两个聚合物的闭环态吸收还能达到第一个循环的95%。由此,两个聚合物均具有良好的抗疲劳性,能够在紫外光和可见光的反复刺激下反复开关环,具有良好的实用前景。
3 结 论
(1)采用不同的反应机理和条件,合成了两个骨架型光致变色二芳烯聚合物,所得到的两个聚合物在溶解能力和分子量等方面具有不同的特点。
(2)聚合物的光谱性质表明两个聚合物均具有良好的光致变色性能和抗疲劳性。两个聚合物结构上差异在于每个单元差一个醚键,细微结构上的差异可以调控分子的性质。在闭环态吸收峰上,直接键连的方式FPOx基团对于最大吸收峰有明显的影响,而以醚氧键连接的聚合物由于氧原子破坏了共轭性,侧基对于吸收光谱并没有显著的影响。
References
[1]Li B, Wang J Y, Wen H M, Shi L X, Chen Z N. Redox-modulated stepwise photochromism in a ruthenium complex with dual dithienylethene-acetylides [J]. Journal of the American Chemical Society, 2012, 134: 16059-16067.
[2]Massaad J, Micheau J C, Coudret C, Serpentini C L, Guirado G. Proton catalysis in the redox responsivity of a mini-sized photochromic diarylethene [J]. Chemistry-A European Journal, 2013, 19: 12435-12445.
[3]Liu C G. Redox and photoisomerisation switching the second-order nonlinear optical properties of a tetrathiafulvalene derivative across ten stable states: a DFT study [J]. Molecular Physics, 2014, 112: 199-205.
[4]Browne W R, de Jong J J D, Kudernac T, Walko M, Lucas L N, Uchida K, van Esch J H, Feringa B L. Oxidative electrochemical switching in dithienylcyclopentenes (Ⅱ): Effect of substitution and asymmetry on the efficiency and direction of molecular switching and redox stability [J]. Chemistry-A European Journal, 2005, 11: 6430-6441.
[5]Bianco A, Pariani G, Zanutta A, Castagna R, Bertarelli C. Photochromic materials for holography: issues and constraints [J]. Practical Holography Xxvi: Materials and Applications, 2012, 8281: 1-10.
[6]Boiko Y. Volume hologram recording in diarylethene doped polymer [J]. Optical Memory & Neural Networks (Information Optics), 2009, 17: 30-36.
[7]Peters A, Branda N R. Electrochromism in photochromic dithienylcyclopentenes [J]. Journal of the American Chemical Society, 2003, 125: 3404-3405.
[8]Browne W R, de Jong J J D, Kudernac T, Walko M, Lucas L N, Uchida K, van Esch J H, Feringa B L. Oxidative electrochemicalswitching in dithienylcyclopentenes (Ⅰ): Effect of electronic perturbation on the efficiency and direction of molecular switching [J]. Chemistry-A European Journal, 2005, 11: 6414-6429.
[9]Finden J, Kunz T K, Branda N R, Wolf M O. Reversible and amplified fluorescence quenching of a photochromic polythiophene [J]. Advanced Materials, 2008, 20: 1998-2002.
[10]Ordronneau L, Boixel J, Aubert V, Vidal M S, Moya S, Aguirre P, Toupet L, Williams J A G, Le Bozec H, Guerchais V. New fluorescent bis-dithienylethene (DTE)-based bipyridines as reverse interrupters: single vs. double photochromism [J]. Organic & Biomolecular Chemistry, 2014, 12: 979-992.
[11]Cui S, Liu G, Pu S, Chen B. A highly selective fluorescent probe for Zn2+based on a new photochromic diarylethene with a di-2-picolylamine unit [J]. Dyes and Pigments, 2013, 99: 950-956.
[12]Jung H Y, You S, Lee C, You S, Kim Y. One-pot synthesis of monodispersed silica nanoparticles for diarylethene-based reversible fluorescence photoswitching in living cells [J]. Chemical Communications, 2013, 49: 7528-7530.
[13]Irie M, Mohri M. Thermally irreversible photochromic systemsreversible photocyclization of diarylethene derivatives [J]. Journal of Organic Chemistry, 1988, 53: 803-808.
[14]Stellacci F, Toscano F, Gallazzi M C, Zerbi G. From a photochromic diarylethene monomer to a dopable photochromic polymer: optical properties [J]. Synthetic Metals, 1999, 102: 979-980.
[15]Stellacci F, Bertarelli C, Toscano F, Gallazzi M C, Zotti G, Zerbi G. A high quantum yield diarylethene-backbone photochromic polymer [J]. Advanced Materials, 1999, 11: 292-295.
[16]Kawai T, Kunitake T, Irie M. Novel photochromic conducting polymer having diarylethene derivative in the main chain [J]. Chemistry Letters, 1999, 905-906.
[17]Yang Songjie (杨松杰), Tian He (田禾). Progress in research of organic photochromic materials [J]. Journal of Chemical Industry and Engineering (China) (化工学报), 2003, 54 (4): 497-507.
[18]Zhang Shiman, Li Cunpu, Xie Xiaofeng, Zhang Fushi. Novel cross-linked anion exchange membranes with diamines as ionic exchange functional groups and crosslinking groups [J]. International Journal of Hydrogen Energy, 2014, 39 (25): 13718-13724.
[19]Li Cunpu, Zhang Shiman, Wang Shubo, Xie Xiaofeng, Deng Changsheng, Pei Pucheng. A novel cross-linked anion exchange membrane with conjugated and non-conjugated pyridine groups [J]. International Journal of Hydrogen Energy, 2014, 39 (26): 14362-9.
[20]Lucas L N, de Jong J J D, van Esch J H, Kellogg R M, Feringa B L. Syntheses of dithienylcyclopentene optical molecular switches [J]. European Journal of Organic Chemistry, 2003, 155-166.
[21]Hermes S, Dassa G, Toso G, Bianco A, Bertarelli C, Zerbi G. New fast synthesis route for symmetric and asymmetric phenyl-substituted photochromic dithienylethenes bearing functional groups such as alcohols, carboxylic acids, or amines [J]. Tetrahedron Letters, 2009, 50: 1614-1617.
Backbone diarylethene polymers with rigid and flexible structures
ZHANG Shiman1,2, ZHANG Fushi2, DENG Aiming1
(1Southwest Technology and Engineering Research Institute, Chongqing 400039, China;2Department of Chemistry, Tsinghua University, Beijing 100084, China)
With diarylethene as one co-monomer, two backbone diarylethene polymers were synthesized through convenient routes. The solubility, photochromism and fatigue resistant property were studied. The two obtained polymers showed the reversible photochromic ability and excellent fatigue resistance. In the synthesis process of the two polymers, diarylethene and copolymer units were connected using rigid and flexible connections, respectively, and thus obtained diarylethene polymers with different spectral properties and molecular weight.
photochemistry; photochromism; polymers; synthesis; fatigue resistance
date: 2015-03-30.
ZHANG Shiman, zhangsm04@163.com
supported by the National Natural Science Foundation of China (21273127) and the National Natural Science Foundation of China & China Academy of Engineering Physics (U1230129).
10.11949/j.issn.0438-1157.20150400
O 644.11
A
0438—1157(2015)11—4716—06
2015-03-30收到初稿,2015-07-22收到修改稿。
联系人及第一作者:张诗曼(1986—),女,博士,工程师。
国家自然科学基金项目(21273127);国家自然科学基金委员会-中国工程物理研究院联合基金项目(U1230129)。
