胆红素对小胶质细胞BV-2表面分子Toll样受体4mRNA 表达的影响*
2015-09-05关小勇李雪丽陈华干
关小勇,李雪丽,陈华干,高 干
(柳州市妇幼保健院检验科,广西柳州545001)
新生儿高胆红素血症以非结合胆红素为主,可引起胆红素脑病,遗留神经系统后遗症[1]。小胶质细胞是神经胶质细胞的一种,约占全部胶质细胞的5%,起到类似巨噬细胞的作用,是中枢神经系统中的第一道,也是最主要的一道免疫防线[2]。Toll样受体(TLRs)是机体重要的天然免疫受体分子之一,主要表达于单核巨噬细胞,可识别革兰阴性细菌细胞壁成分脂多糖(LPS),启动信号传导,介导天然免疫[3]。有研究对新生儿黄疸的原因进行调查发现,母婴同室前引起新生儿高胆红素血症的主要原因是感染[4]。新生儿感染性疾病如肺炎、脐炎、眼结膜炎、脓疱疹等,其内毒素即LPS,以及产生的细胞因子可以抑制肝脏功能,使红细胞破坏产生溶血,加重新生儿黄疸的程度[4]。因此,本研究拟通过观察经胆红素孵育后小胶质细胞系在LPS刺激后BV-2表面分子TLR4 mRNA 的表达情况,探讨胆红素对小胶质细胞免疫功能的影响。
1 材料与方法
1.1 实验材料 小鼠小胶质细胞系购自上海桥社生物科技公司,二甲基亚砜(DMSO)购自美国Sigma公司,胎牛血清购自杭州四季青生物工程有限公司,RPMI1640基础培养基为Gibco公司产品,胆红素为Fluka公司生产脂溶性的非结合胆红素(UBC),清蛋白为Sigma公司产品,RNAisoPlus总RNA 提取试剂盒、SYBR Green Real-time PCR试剂盒为TaKara公司产品,逆转录试剂盒购自Fermentas公司,引物合成由Invitrogen公司完成。其余所用试剂为国产分析纯。
1.2 主要仪器 低温高速离心机为美国Beckman公司生产的AvantiTM30,CO2恒温培养箱为Thermo公司产品,PCR 分析仪为美国ABI生产,型号为Veriti96。
1.3 实验方法
1.3.1 细胞培养 实验用小鼠小胶质细胞株BV-2为贴壁细胞,复苏BV-2细胞,置于RPMI-1640培养液(含10%胎牛血清,100U/mL青霉素和链霉素)中,于37 ℃、5%CO2培养箱中培养,根据细胞代谢情况,1~2d换液,至指数生长期收集细胞悬液,细胞计数板计算细胞数,以RPMI-1640培养液调整成1×105/mL细胞悬液备用。
1.3.2 实验分组 制备好的细胞悬液接种于24孔塑料培养板,分为6个组。空白对照组和LPS对照组只加调整好的细胞液使反应体系为1mL;4个不同浓度的胆红素干预组加入UBC,调整其反应体系中UBC 的浓度分别为25、50、100、200 μmol/L,整个反应体系为1mL。6个组避光孵育1h,弃掉上清液,加入LPS溶液(1 000μg/mL),其中空白对照组只加入完全培养基2mL,其余组均加入1.98mL 培养基和0.02mL LPS溶液,反应体系为2mL,LPS终浓度为10μg/mL,混匀。在37 ℃、5%CO2条件下培养24h。
1.3.3 细胞总RNA 的提取 按照RNAisoPlus总RNA 提取试剂盒的操作说明进行[5]。
1.3.4 逆转录 在冰上分别加入1μg的RNA 模板和1μL oligo(dT)18primer,用水补至12μL,65 ℃,5min。于冰上冷却后,分别加入4μL 5XReaction Buffer、1μL RNase Inhibitor、2mL 10mmol/L dNTP Mix和1μL M-MuLV Reverse Transcriptase,轻轻混匀稍稍离心后,置于PCR 仪中42 ℃60min,然后70 ℃5min终止反应。
1.3.5 Real-time PCR 在25μL反应体系中,分别加入12.5 μL SYBR Green PCR Mix、10.5μL灭菌水、0.5μL P1、0.5μL P2和1μL cDNA 模板,参照文献[5]加入TLR4引物(506bp)上游:5′-TGG ATA CCG TTT CCT TAT AAG-3′,下 游:5′-GAA ATG GAG GCA CCC CTT C-3′,内 参GAPDH(220 bp)。混匀并稍稍离心后,置于Rotor-Gene 3000 荧光定量PCR 仪中,按如下 条 件 进 行Real-time PCR:94 ℃,10 min,40个循环(94 ℃,30s;57 ℃,30s;72 ℃,60s)。扩增产物用Rotor-Gene6000software1.7系统分析结果。
1.4 统计学处理 各项实验重复3 次,所得数据采用SPSS17.0统计软件进行统计学处理。两组间比较使用t检验,多个样本间的两两比较使用One-way ANOVA,P<0.05为差异有统计学意义。
2 结 果
图1 的结果显示,LPS 对照组与空白对照组比较TLR4 mRNA 的表达虽然略低,但两者差异无统计学意义(P>0.05);而两者与4个不同浓度的胆红素干预组比较差异均有统计学意义(P<0.05),且胆红素浓度越高差异就越显著。4个不同浓度的胆红素干预组两两比较小胶质细胞系BV-2表面分子TLR4mRNA 的表达随着胆红素浓度的增高呈逐渐降低趋势,可见胆红素可对小胶质细胞系BV-2表面分子TLR4 mRNA 的表达起抑制作用,且抑制作用的强弱与胆红素的浓度呈正相关。
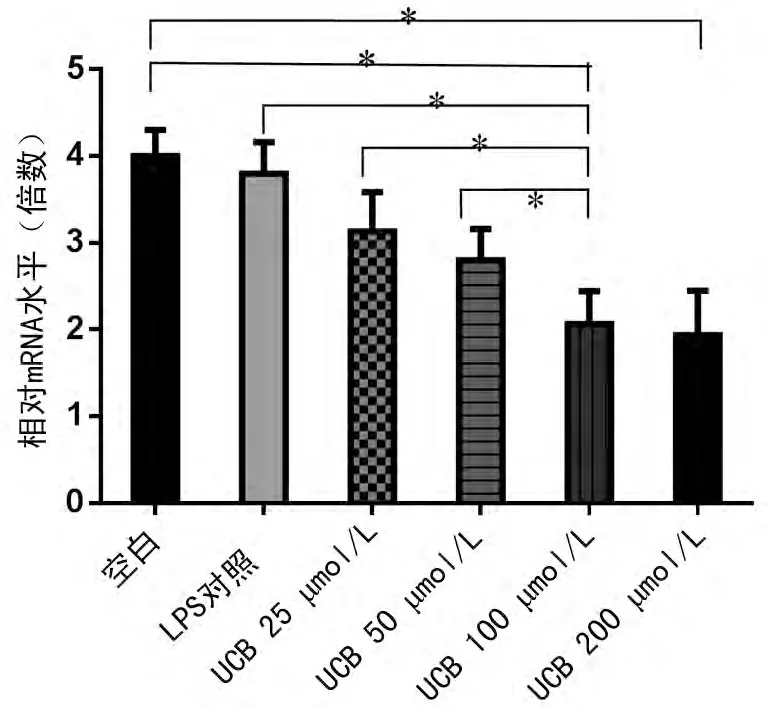
图1 不同浓度胆红素作用后TLR4mRNA 的表达情况
3 讨 论
中枢神经系统是机体免疫机制的特殊区域,缺乏淋巴系统,并有血脑屏障的保护。小胶质细胞是脑内的驻留型巨噬细胞。一些神经病理学研究表明激活的小胶质细胞在神经退化类疾病的发病机制中起着重要作用。许多生理或病理因素如血压的突然变化、免疫刺激和外伤、非结合胆红素的侵入等均可导致血脑屏障破坏、通透性升高,使血循环中的物质渗入引起中枢神经系统的病理性改变[6]。TLR4是模式识别受体的一个重要成员,随着研究的深入,发现TLR4在促进细胞因子的合成与释放,引发炎症反应,促进免疫细胞的成熟和分化,以及抗感染、调节免疫应答等方面起到重要的作用[7]。
新生儿黄疸多为生理性黄疸,呈良性经过,如病理性黄疸胆红素浓度过高会产生细胞毒作用,早产儿由于血脑屏障及免疫功能不全更易发生高胆红素血症及胆红素脑病[1]。胆红素不仅有神经毒性,对免疫系统亦有明显的抑制作用[8]。本研究结果显示,没加入UBC 孵育的LPS 对照组与空白对照组比较,LPS对照组TLR4mRNA 的表达虽然略低,但两者没有显著差异。而小鼠小胶质BV-2细胞在不同浓度的胆红素孵育后再经LPS刺激,TLR4的表达明显受到抑制,且浓度越高抑制作用就越明显,可见在感染和高胆红素的共同作用下,中枢神经系统的免疫功可能会受到更大的抑制,从而导致黄疸患儿的免疫力低下更易并发感染。脓毒症、严重的高胆红素血症、细菌感染可以看作核黄疸的高危因素[4]。胆红素在LPS协同下抑制TLR4表达的机制可能是:胆红素首先损伤小鼠小胶质细胞细胞膜,致TLR4受体结构破坏、数量减少和功能丧失,识别LPS的能力下降[9];接着胆红素破坏线粒体,使细胞氧化磷酸化过程受阻,从而干扰能量代谢,氨基酸合成蛋白质减少[10];然后胆红素破坏细胞核,最终影响TLR4 的转录与合成。
综上所述,高浓度胆红素对小胶质细胞BV-2 表面分子TLR4的表达有明显抑制作用,在临床上对严重高胆红素血症患儿应早期进行干预,改善患儿的免疫功能,并发感染患儿及早产儿由于血脑屏障破坏、通透性升高更易发生胆红素毒性损伤,治疗更应积极。
[1]马琳,江莲.新生儿黄疸与免疫功能的研究进展[J].河北医药,2011,33(18):2831-2833.
[2]Yao L,Kan EM,Lu J,et al.Toll-like receptor 4mediates microglial activation and production of inflammatory mediators in neonatal rat brain following hypoxia:role of TLR4in hypoxic microglia[J].J Neuroinflammation,2013,10(1):23.
[3]刘会领,陈敏,陈昌辉.Toll样受体4介导的革兰阴性细菌免疫应答研究进展[J].实用儿科临床杂志,2008,23(10):790-793.
[4]老白杨,饶斯清,汪李虎.新生儿高胆红素血症的病因分析[J].华南预防医学,2006,12(3):65-66.
[5]Yang D,Liu B,Hou X,et al.Pre-treatment with Mycobacterium avium-derived lipids reduces the macrophage response to interferonγin BCG-vaccinated mice[J].J Med Microbiol,2013,62(Pt 7):980-987.
[6]Brites D.The evolving landscape of neurotoxicity by unconjugated bilirubin:role of glial cells and inflammation[J].Front Pharmacol,2012,3(1):88.
[7]张宇,孙瑞利,胡锦跃.Toll样受体4信号转导研究进展[J].国际病理科学与临床杂志,2009,29(1):32-36.
[8]Watchko JF.Hyperbilirubinemia and bilirubin toxicity in the late preterm infant[J].Clin Perinatol,2006,33(4):839-852.
[9]Alexandra Brito M,Silva RF,Brites D.Bilirubin toxicity to human erythrocytes:a review[J].Clin Chim Acta,2006,374(1/2):46-56.
[10]裴雪梅,陈昌辉,牛会琴,等.不同浓度胆红素对新生儿脐血单核细胞形态结构的影响[J].医学研究生学报,2009,22(5):496-499.
