疏水性Fe3O4磁性纳米粒子的表面改性修饰
2015-09-02解矛盾德州学院医药与护理学院山东德州253023
解矛盾 闫 瑾(德州学院医药与护理学院,山东 德州 253023)
疏水性Fe3O4磁性纳米粒子的表面改性修饰
解矛盾 闫 瑾
(德州学院医药与护理学院,山东 德州 253023)
通过在 Fe3O4磁性纳米粒子表面包覆一些生物分子(如:多巴胺、RGD环肽等)来改变粒子表面的性质,制得了一系列复合磁性纳米粒子。在原有的疏水性Fe3O4磁性纳米粒子(MNPs)表面包覆多巴胺(Dopamine,DA),利用多巴胺的邻苯二酚羟基和氨基基团可通过共价键和非共价键等形式键合在一起的性质使其表面氨基化,产物与水的接触角的测试结果表明,粒子由疏水性的MNPs转变为了亲水性的DA-MNPs,实现了MNPs表面的改性修饰。将DA-MNP用c(RGDyk)肽包覆,最终可得到能与肿瘤细胞整合素相结合的,可实现磁性纳米粒子的靶向给药作用的RGD-DA-MNPs。
RGD环肽;多巴胺;疏水性;氨基化;靶向
随着纳米技术的飞速发展,有关 Fe3O4性质的研究越来越受到重视。磁性纳米Fe3O4由于磁性吸引和范德华力的协同作用使其易于团聚,且由于其表面的官能团很少,所以应用范围有限。为了有效地稳定Fe3O4粒子,同时也为了更多的引入特殊官能团,扩大其应用范围,通常要在其表面引入其他分子作为稳定剂对其进行修饰[1-4]。多巴胺含有邻苯二酚羟基和氨基基团,研究表明,邻苯二酚羟基和氨基都有很高的活性,能与各种材料以共价键和非共价键的形式形成很强的作用力。在有氧潮湿的条件下,多巴胺易发生自聚合反应形成具有很强亲水性的聚多巴胺,含有的邻苯二酚和氨基基团可以和羟基、氨基、硫醇、羧基和酯基等官能团发生接枝反应[5-8]。自1984年Pierschbacher和Ruosluherici首次报道纤维蛋白原中含有的RGD序列可作为细胞的识别位点以来,RGD肽即作为潜在的示踪剂成为研究热点。RGD肽是一类含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp)的环肽,是整合素 αvβ3的受体拮抗多肽。研究表明,整合素 αvβ3通过调节内皮细胞的黏附、迁移及调往等功能抑制肿瘤血管的生成。外源性RGD肽与肿瘤细胞表面整合素结合后,可从多个环节发挥对肿瘤细胞的抑制作用[9-13]。
南昌博士王进华等人[1]曾将人血清白蛋白和多巴胺用于修饰 Fe3O4纳米粒子,但人血清白蛋白原料昂贵,成本较高;乔瑞瑞等[14]将 RGD修饰到四氧化三铁上,但其制备方法太繁杂,不适用于工业化生产。本文先将多巴胺有效修饰到Fe3O4上,使多巴胺上的两个羟基与Fe结合,生成两个Fe-O键,达到多巴胺修饰的效果,然后再根据曼尼希反应将C(RGDYK)肽结合到多巴胺-Fe3O4粒子上,成本低廉,操作简单。具体反应如图1所示。

图1 曼尼希反应原理图
1.实验部分
1.1 试剂
Fe3O4(阿拉丁试剂 99%),上海晶纯试剂有限公司;c(RGDyk)(95%),上海强耀生物技术有限公司;HCl(分析纯),烟台市双双化工有限公司;甲醛(分析纯)莱阳经济技术开发区精细化工厂;二甲基甲酰胺(DMF,99.5%),二甲基亚砜(DMSO,99%),天津市富宇精细化工有限公司。
1.2 DA对MNPs的表面改性修饰
Fe3O4相互之间由于磁性吸引和范德华力作用易产生聚沉现象,故先将油性MNPs于氯仿内超声分散4-5 min,测其粒径、电位及接触角。为了探寻多巴胺与Fe3O4纳米粒子结合的最佳比例,我们做了四组实验进行分别探讨,其中,MNPs与 DA质量比分别为 5:2、5:1、10: 1、20:1。取一定质量的 DA分别溶解在DMSO中并加入到油性MNPs的氯仿溶液内,通过机械搅拌形成均质溶液,均匀加热至 70℃水浴恒温振荡 1h,反应结束后,冷却至室温,得DA-MNPs粒子。过滤洗涤后测其粒径及电位并比较,得最佳实验条件为 m(MNPs):m(DA)=5:1组,并将该组用于后续研究。
取上述溶液,以正己烷:DA-MNPs溶液体积比为 1: 1的比例混合,以12000r/min的转速离心 15min后收集DA-MNPs,用真空干燥箱干燥,得粉状 DA-MNPs纳米磁性粒子,测定与水的接触角,将其质量浓度稀释至1‰左右,测其粒径及zeta电位。
1.3 RGD肽对DA-MNPs的表面改性修饰
将6mgDA-MNPs粉末用2ml二甲基甲酰胺溶解,按顺序依次加入1ml的 RGD(M.W.=619.7,2mg/ml)溶液,200μl的甲醛溶液(37%)和100μl 1M HCl溶液,室温下搅拌反应3h。将产物用离心机在9000r/min条件下离心30min,倒出上清液,用蒸馏水洗涤3次以回收底部的粒子,得RGD-DA-MNPs,用声波降解法将粒子均匀分散于2ml的去离子水中,取出部分进行检测,测其粒径及电位,烘干,测其红外光谱。
1.4 产物的表征
使用英国Malvern公司的Nano-ZS纳米粒径仪测定各种反应前后物质的粒径并使用 zeta电位仪测定各种反应后物质稳定性变化;使用昆山市超声仪器有限公司的KQ-200 VDE型双频数控超声波清洗器对粒子进行超声分散处理;包裹DA并离心后,使用上海精宏实验设备有限公司的真空干燥箱通过测定上清液中DA的含量来测定DA-MNPs的多巴胺包覆率;使用东莞市晟鼎精密仪器有限公司的自动型接触角测量仪测定粒子与水接触角;使用德国 Bruber公司的的傅里叶变换红外光谱测试仪测定对MNPs进行不同程度的修饰后的红外光谱图,并通过比较光谱图中吸收峰位置的变化来探讨RGD肽是否接枝成功。
2.结果与讨论
2.1 粒径电位的比较
为了探讨经不同程度修饰后粒子的稳定性,将溶液稀释至1/1000浓度,放于超声仪中超声 5min,使形成均质溶液,放入马尔文Zetasizer Nano ZS仪器测量仪的样品池中进行测试,测试温度为25℃,入射激光波长为633nm,其偏振光与散射光检测平面垂直,测定各步经修饰前后的 Fe3O4磁性纳米粒子的平均粒径和粒径分布。结果如图2-3。

图2 从左到右依次是MNPs、DA-MNPs、RGD-DA-MNPs的粒径图

图3 从左到右依次是MNPs、DA-MNPs、RGD-DA-MNPs的电位图
如图2、图3所示,MNPs、DA-MNPs、RGD-DAMNPs的粒径值分别为为 87、245.9、471.5nm;电位绝对值大小分别是0、21.6、25.8 mV。
由图2可见,MNPs、DA-MNPs、RGD-DA-MNPs的粒径明显增大。虽然分散系数与粒径大小略有增大,粒径分布图仍然尖锐,但粒子分布比较集中,颗粒大小也比较均匀。接枝RGD后分散系数增大,粒径略有增大,但平均值均控制在470nm左右。
一般来说,颗粒表面电位愈高,颗粒的分散体系愈稳定。水相中颗粒分散稳定性的分界线一般认为在+ 30mV或-30mV处,如果所有颗粒均带有高于+30mV或低于-30mV的zeta电位,则该分散体系就比较稳定。粒子在水溶液中的分散性主要取决于颗粒表面的 zeta电位,当磁性纳米粒子表面电荷足够大从而能够在粒子间产生足够强的静电排斥力时,静电排斥力足以对抗纳米粒子之间的团聚,磁性纳米粒子则能够成为稳定的分散体系。
由图3可见,未经修饰的Fe3O4的zeta电位为 0或近于0,此时的磁性粒子倾向于快速凝结或凝聚。将其超声分散后,再用多巴胺对其包覆,所得磁性粒子的电位绝对值虽未超过30mV,但较修饰前的电位明显升高,一定程度上提高了磁粒的分散性,zeta电位的分析结果有力地证明了多巴胺成功包覆在Fe3O4磁性纳米粒子表面。当RGD成功接枝到粒子表面后,电位值由正变为负,且绝对值进一步升高,不但证明成功接枝了RGD,且接枝RGD后的分散体系更加趋于稳定。
2.2 红外光谱图的比较
本实验采用磁力吸附洗涤和真空干燥法对DAMNPs、RGD-DAMNPs进行纯化后,分别对接枝RGD前的DA-MNPs和接枝RGD后的RGDDA-MNPs进行傅立叶红外光谱分析,将扫描范围设置为4000~0cm-1,扫描次数16次得图4。

图4 MNPs、DA-MNPs、RGD-DA-MNPs的红外光谱图
如图4所示,在波长为550cm 左右处有Fe-O键的吸收峰,当粒子尺寸减小到纳米级,会引起粒子表面键力常数增大,大量原子暴露在外面,非局域电子发生重排,因此粒子的红外光谱会左移,从而使本来580cm-1处的吸收峰会移动到波数550cm-1左右。
DA-MNPs和接枝RGD后的RGD-DA-MNPs除了在3500~3300cm-1处有-NH2的中等吸收峰外,在3000~2800cm-1还有饱和-C-H键的特征吸收峰,但MNPs在代表多巴胺的-NH2基的 3500~33000cm-1以及代表-CH键3000~2800cm-1处均未有吸收峰出现。因此可以判断多巴胺已成功包覆多巴胺。MNPs、DA-MNPs、RGDDA-MNPs在 1600cm-1处均存在-C=O基团的吸收峰,比较MNPs及RGD-DA-MNPs谱线可见,RGD-DAMNPs峰高高于MNPs,因此RGD-DA-MNPs所含-C=O基团的数目高于MNPs,可得出RGD已成功接枝到粒子表面。
2.3 包裹DA前后接触角的变化

图5 MNPs(左)与DA-MNPs(右)与水接触角的变化图
表面张力是固体表面重要的物理化学参数之一,其大小与相接触面的两相物质的性质有关。表面张力与接触角呈反比。用自动型接触角测定仪分别测定MNPs 和DA-MNPs与水的接触角,结果如图5所示,MNPs及DA-MNPs的角度分别为127.97°、56.48°。疏水性Fe3O4的表面张力较小,与水接触角比较大,包覆DA后,表面张力增加,其表面能升高,故水在DA-MNPs上的接触角就会由127.97°变为56.48°,润湿性变好。
2.4 测RGD的接枝率
RGD最有特征性的吸收波长是肽键,为 214nm。因此,通过紫外分光光度计测试溶液中肽的含量是计算RGD接枝率的最佳方法。首先配制一系列的RGD的标准溶液,在214nm的波长下对其进行紫外测试,并绘制曲线如下图。
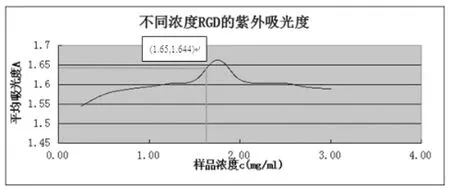
取100mgRGD与相对应量的DA-MNPs根据接枝RGD的实验步骤进行反应,得到 13ml的 RGD-DAMNPs,洗涤数次至无游离RGD并制成13ml溶液。取上述溶液2ml稀释到6ml作为样品测得其在波长为214nm的紫外吸光度为 1.644,相对应的 RGD浓度为1.65。则RGD的接枝率£可以表示为
£=1.65×6÷2×13÷100×100%=64.35%
因此可得RGD的接枝率为64.35%。
[1]代明珠,李俊,康斌,任超,戴耀东,董宇.四氧化三铁/碳纳米管复合材料的制备及对放射性废水中铜离子的吸附[J].材料导报 B(研究篇),2013,27(5):83-86.
[2]周莅霖,况锦铭,袁金颖.四氧化三铁纳米粒子表面接枝聚合制备磁性聚合物微球 [J].化学进展,2009,21(9):1880-1887.
[3]王伟,吴尧,顾忠伟.磁性纳米粒子的表面改性及其在生物医学领域的应用[J].中国材料进展,2009,28(1):43-48.
[4]李绍霞.磁性纳米粒子的表面功能化修饰[D].烟台:烟台大学,2009.
[5]许春花.多巴胺表面修饰制备SiO2-Ag纤维复合材料的研究[D].北京:北京化工大学,2012.
[6]徐又一,等.多巴胺的自聚-附着行为与膜表面功能化[J].膜科学与技术,2011,31(3):32-38.
[7]王进华.HSA-Dopamine-Fe3O4纳米颗粒的磁特性及相关分子影像学的实验研究[D].南昌:南昌大学,2009.
[8]朱丽君,王文才.多巴胺对炭黑/CNTs表面功能化修饰的研究[D].北京:北京化工大学,2012.
[9]陈中亚,赵雁,陶涛.RGD肽介导的脑胶质瘤靶向治疗和显像的研究进展 [J].中国医药工业杂志,2013,44(3):290-295.
[10]张丽,张春丽,王荣福.RGD肽类肿瘤靶向受体显像的研究现状及前景[J].中国医学影像技术,2010,26(6):1176-1178.
[11]安莲效,李慧,顾月清.RGD肽作为药物靶向配体的研究进展[J].中国生化药物杂志,2010,31(1):66-69.
[12]Jin Xie,Kai Chen,Ha-Young Lee,Chenjie Xu,Andrew R. Hsu,Sheng Peng,Xiaoyuan Chen,Shouheng Sun.Ultrasmall c (RGDyK)-Coated Fe3O4 Nanoparticles and Their Specific Targeting to Integrin rv3-Rich Tumor Cells,J.AM.CHEM. SOC.2008,130,7542-7543.
[13]曹馨,于卫强,张富强.RGD肽修饰TiO2纳米管对成骨细胞黏附的影响[R].口腔医学研究,2012:522-530.
[14]乔瑞瑞,贾巧娟,曾剑峰,高明远.磁性氧化铁纳米颗粒及其磁共振成像应用 [J].生物物理学报,2011,27(4):272-288.
(责任编辑 张 蓓)
O61
A
1008-7257(2015)04-0077-03
2015-03-31
解矛盾(1992-),女,山东东平人,德州学院制药工程专业,研究方向:肿瘤分子靶向。
