IL-18的毕赤酵母表达及其激活NF-κB和p38途径促进 BRL-3A细胞增殖
2015-09-01张继红许晓亚杨刚刚马诚凯徐存拴新乡医学院基础医学院组织学与胚胎学教研室河南新乡453007河南省科技部共建细胞分化调控重点实验室河南新乡453007
张继红, 许晓亚, 杨刚刚, 马诚凯, 徐存拴(1.新乡医学院 基础医学院 组织学与胚胎学教研室,河南 新乡453007;.河南省科技部共建细胞分化调控重点实验室,河南 新乡 453007)
IL-18的毕赤酵母表达及其激活NF-κB和p38途径促进BRL-3A细胞增殖
张继红1,2,许晓亚2,杨刚刚2,马诚凯2,徐存拴2
(1.新乡医学院基础医学院组织学与胚胎学教研室,河南新乡453007;2.河南省科技部共建细胞分化调控重点实验室,河南新乡453007)
目的:探讨白细胞介素18(IL-18)在毕赤酵母中的表达条件及其对BRL-3A细胞的增殖作用和作用机制.方法:构建表达载体pPIC9K-IL-18,电转化至毕赤酵母GS115,PCR、Western blotting和SDS-PAGE方法鉴定表达产物的正确性,并对发酵条件进行优化,再经双水相萃取偶联DEAE离子交换层析分离纯化表达产物.然后,MTT法检测重组大鼠IL-18(rrIL-18)对BRL-3A细胞的增殖作用,RT-PCR和Western blotting方法检测IL-18信号通路相关基因的表达变化.结果:在3 L发酵罐规模下600的菌体密度、pH=6.0、诱导温度23℃、体积分数分别为20% DO和0.25%甲醇浓度条件下表达质量浓度最高约为280 mg/L,经分离纯化后纯度可达95%.此外,质量浓度为15 ~20 ng/mL rrIL-18孵育48 h,能明显促进BRL-3A细胞增殖(P<0.5),且IL18R、MyD88、NF-κB及其下游靶蛋白cyclin B1和cyclin B2的表达量均显著高于对照组(P<0.5).同时,p38途径的ATF2及其下游靶蛋白cyclin A2和Bcl-2的表达量也随之升高(P<0.5).结论:成功构建大鼠IL-18表达载体,优化在毕赤酵母中的发酵条件和纯化工艺,并首次证实IL-18能通过NF-κB和p38/ATF2途径激活细胞增殖相关靶蛋白cyclin B1、cyclin B2、cyclin A2和Bcl-2,进而促进BRL-3A大鼠肝细胞增殖.
白细胞介素18;毕赤酵母;双水相萃取;细胞增殖;信号通路
白介素18(interleukin 18,IL-18)是1995年由Okamura等[1]从中毒性休克小鼠的干细胞中分离出来.由于这种细胞具有较强的γ-干扰素诱生能力,因此,最初被命名为γ-干扰素诱生因子(interferon-γ-inducing factor,IGIF).1996年,Ushio等[2]以小鼠IGIF为探针,从正常人肝脏cDNA文库中克隆出人IGIF cDNA,并在大肠杆菌(E.coli)中表达.大鼠IL-18前体蛋白由194个氨基酸组成,与人的IL-18在氨基酸和核苷酸水平上均有65%的同源性,含有一段由36个氨基酸组成的引导序列,其中不含N端糖基化位点和疏水性信号肽.成熟的IL-18为切除前导序列的多肽,由157个氨基酸残基组成,分子量约为18~19 ku[1-3].
研究表明,IL-18是一个多效性的细胞因子,具有多种生物学作用.除能诱导 Th1、NK细胞产生IFN-γ外,在抗病原微生物感染、抗肿瘤免疫、介导炎症反应等方面均具有潜在的应用前景[4].本研究用毕赤酵母表达系统表达重组大鼠IL-18(recombi-nant rat IL-18,rrIL-18),利用酵母偏好密码子优化基因序列和优化发酵条件来提高目的蛋白表达量.同时采用双水相萃取偶联DEAE层析技术进行纯化,操作简便且能高效率地获得高纯度和高收率的目的蛋白.
IL-18主要由活化的单核巨噬细胞产生,在其他细胞、组织中也广泛表达,如肝脏、小肠上皮、脾脏、神经胶质细胞和星形细胞、肾上腺皮质等[5-6].研究表明,IL-18作为一个细胞分裂原,能促进多种类型的细胞增殖,如T细胞、软骨和成骨细胞、生殖细胞、人黑色素细胞等[7-10].本研究小组的前期研究结果也表明,IL-18在大鼠肝再生中促进肝细胞增殖[11],然而,其作用机制尚不清楚.因此,本研究以大鼠肝细胞株BRL-3A为材料,对IL-18促进肝细胞增殖的机制进行探索性研究,为寻找有效的细胞因子加速肝切除术和肝移植后的肝再生、促进肝病患者的肝功能恢复提供靶点的实验依据.
1 材料与方法
1.1材料
E.coli DH5α菌株购自武汉晶赛生物工程技术有限公司;毕赤酵母GS115、pPIC9K载体、胎牛血清、DMEM高糖培养基、胰蛋白酶、Trizol购自In-vitrogen公司;大鼠肝细胞株BRL-3A购自北京医学科学院基础医学研究所;反转录试剂盒购自Pro-mega公司;噻唑蓝(3-(4,5)-dimethylthiahiazo(-z-yl)-3,5-diphenytetrazoliumromide,MTT)、二甲基亚砜(dimethylsulphoxide,DMSO)购自 Sigma公司;一抗购自Cell Signaling Technology公司;电化学发光液(electrochemiluminescence,ECL)购自南京凯基生物公司;重组大鼠IL-18购自R&D system公司.
1.2方法
(1)基因合成与载体构建根据大鼠IL-18基因序列(NM001562.3)和毕赤酵母密码子偏好性,利用在线序列优化工具对其核苷酸序列进行设计(http://www.evolvingcode.net),去除酵母通用信号肽α交配因子末端EAEA框,依据毕赤酵母密码子的碱基使用频率优化密码子组成并提高GC含量,优化的序列全长为749 bp,由上海捷瑞生物工程有限公司合成.
(2)重组质粒鉴定合成的IL-18经BamHI和EcoRI双酶切连接至pPIC9K载体,转化DH5α感受态细胞.重组质粒pPIC9K-IL-18经SacI线性化后,电转化至毕赤酵母GS115感受态细胞中,在组氨酸缺陷型(MD)平板上进行筛选.28℃培养3 d,挑取单克隆扩大培养,提取酵母基因组DNA,进行PCR鉴定,并回收目的产物送上海捷瑞生物工程有限公司测序.
挑选鉴定正确的菌株接种至10 mL YPG培养基,于28℃、250 r/min离心振荡培养18~24 h,当△A600为10时,按1∶100接种至100 mL BMGY培养基,于280 r/min离心继续培养24 h后,加入终体积分数为1%(v/v)的甲醇于23℃、200 r/min条件下进行诱导.每12 h补加体积分数1%发酵液体积(v/v)的甲醇.诱导5 d后,取1 mL发酵液于12 000 r/min离心10 min,上清液用TCA浓缩后进行SDS-PAGE.
(3)发酵条件优化在1L摇瓶规模下,将筛选出的高表达菌株(△A600为10),按1∶100分别接种至不同pH(5.5、6.0、6.5)的100 mL BMGY培养基中,于300 r/min离心继续培养24 h,加入终体积分数为1%(v/v)的甲醇开始诱导.同时,设置不同的诱导温度(20、23和26℃),期间,每12 h补加1次甲醇,转速为200 r/min离心.诱导5 d后,取500 μL上清TCA后进行SDS-PAGE.
在3 L发酵罐规模下,取△A600为10的表达菌株,按1∶100接种至200 mL YPG培养基中培养至△A600为20时,取200 mL菌液和1.5 mL PTM1加入含1.5 L BSM基础培养基的3.0 L发酵罐中,按摇瓶优化的最佳pH和诱导温度进行,流加氨水和磷酸控制pH为6.0,调节通气量控制溶氧(DO),按发酵罐初始培养条件培养,当初始培养基甘油耗尽时按DO关联进行甘油补加,当达到预定菌体密度时,饥饿1 h后开始甲醇诱导,每升甲醇含20 mL PTM2培养基,诱导温度为 23℃.以rrIL-18表达量为指标,对不同菌体密度、溶氧控制策略和甲醇浓度等条件进行优化.诱导5 d后,取上清进行SDS-PAGE.
(4)蛋白的分离纯化取诱导5 d的发酵液,于4℃、4 000 g离心30 min,收集上清,每升上清中加入308 g K2HPO4,待完全溶解后再取247 mL无水乙醇缓慢加入搅拌体系中,将混合体系置于分液漏斗中-20℃过夜,形成上、中、下3层,上层分别经0.22 μm滤膜过滤和10 ku膜包超滤后进行DEAE Sepharose Fast Flow离子交换层析柱进行纯化.用浓度为10 mmol/L Na2HPO4(pH8.0)平衡柱子,取10 mg的样品加入50 mL浓度为20 mmol/L的Tris溶液(pH=8.8),以1 mL/min的流速流穿离子交换树脂,然后分别用缓冲液(pH 8.8的浓度为20 mmol/L Tris-HCl)、洗脱液(浓度分别为20 mmol/L Tris+25 mmol/L NaCl溶液)和高盐(浓度分别为20 mmol/L Tris+1 mol/L NaCl溶液)进行梯度洗脱,紫外检测仪监控,收集各洗脱峰进行SDS-PAGE.
(5)MTT法检测细胞增殖大鼠肝细胞株BRL-3A于37℃、体积分数为5%CO2条件下培养于含体积分数为10%胎牛血清的DMEM培养基中.质量分数为0.25%胰酶消化分散细胞后,按3.0× 103个/孔接种于96孔板,培养24 h后,分别加入200 μL含质量浓度分别为2.5、5、10、15、20、40、80 ng/mL rrIL-18的培养基,质量浓度为5 ng/mL标准品rrIL-18(R&D system公司)为阳性对照.继续培养48 h,每孔中加入MTT使其终质量浓度为0.5 mg/mL,于37℃避光孵育4 h,彻底弃去培养基,每孔加入100 μL DMSO,轻轻震荡10 min,用Biotek reader酶标仪检测490 nm处各孔的吸光值.每个浓度设置3个复孔,实验重复3次.
(6)实时荧光定量聚合酶链式反应检测基因的表达变化细胞总RNA抽提按Trizol试剂操作说明书进行,分光光度计检测其纯度(A260/280吸光值),变性琼脂糖凝胶电泳(70 V,20 min)检测其完整性.然后,以2 μg RNA为模板,按照AMV反转录试剂盒操作说明进行反转录,得到第1链cDNA.最后,取1 μL cDNA,加入10 μL SyBr GreenⅠMix、0.4 μL引物、8.6 μL无核酸酶纯水.混匀后,放入Rotor-Gene 3000中扩增基因,检测基因的扩增产物荧光信号值,并以β-actin(NM_031144)为内参计算基因的相对表达量(Ratio值).每个样品做3个复孔,实验重复3次.根据基因在GenBank登录的序列号,用primer express 2.0软件设计其相应引物,并由上海捷瑞生物工程有限公司合成(表1).

表1 引物序列和扩增条件Table 1 The primer sequence and PCR condition
(7)免疫印迹法检测蛋白的表达变化蛋白免疫印迹按文献[12]进行.rrIL-18处理细胞后继续培养48 h,收集细胞,PBS洗2次,加入细胞裂解液于冰上裂解30 min,12 000 g离心15 min,收集上清,经蛋白浓度测定后,取20 μg进行SDS-PAGE,然后,用电转仪转至PVDF膜上,将膜置于含质量分数为5%脱脂奶粉的TBS-T缓冲液中37℃封闭1 h,一抗孵育过夜,再与辣根过氧化物酶标记的二抗室温孵育1 h,ECL底物发光法进行显色.最后,用图像分析软件Image QuantTMTL进行灰度扫描和蛋白含量分析.
(8)统计学分析所有数据用平均数±标准差表示,用SPSS 13.0统计学软件的单因素方差分析法分析组间差异,P<0.05表示有统计学差异.
2 结果
2.1rrIL-18的毕赤酵母表达
pPIC9K-IL-18重组质粒经SacI单酶切后的条带大小约10 kb,经BamHI和EcoRI双酶切后得到的目的片段为749 bp,与预期结果相一致.用载体通用引物进行PCR扩增得到约900 bp的目的条带.重组质粒的测序结果进一步证实IL-18序列定向插入到表达载体中,且未改变读码框架(图1Ⅰ).
将线性质粒转化GS115感受态细胞,经涂板、培养、筛选等过程获得单克隆菌株,扩大培养后提取酵母基因组DNA,琼脂糖凝胶电泳分析 PCR产物,挑取的转化子能扩增出900 bp左右的特异性目的条带(图1Ⅱ),表明IL-18已成功整合至毕赤酵母基因组中.挑取鉴定正确的单克隆菌株进行诱导表达,5 d时取发酵液上清进行SDS-PAGE和Western blotting,均在18.3 ku处检测出目的条带(图1Ⅲ和Ⅳ).
2.2rrIL-18的发酵条件优化
1.0 L摇瓶中诱导5 d,检测不同pH和诱导度对rrIL-18的表达影响,结果显示,在pH6.0和诱导温度23℃条件下达到最高峰,表达质量浓度约为25 mg/L(图2Ⅰ).3L发酵罐规模下,在溶氧为30%、甲醇体积分数为0.25%的条件下,起始诱导菌体的A600达到600时表达质量浓度达到最高,约为255 mg/L(图2Ⅱ).在起始诱导密度相同、甲醇体积分数为0.25%的条件下,溶氧水平由5%逐渐提高至20%时,表达量逐渐提高,最高质量浓度约为270 mg/L(图2Ⅲ).并且,在诱导过程中体积分数为0.25%的甲醇下表达量最高,质量浓度达到280 mg/L.随着甲醇体积分数的增加,菌体的生长也逐渐受到抑制,甲醇体积分数为1%时,蛋白质量浓度表达量低至130 mg/L(图2Ⅳ).
2.3rrIL-18的分离纯化
取诱导5 d发酵液,离心收集上清,用双水相系统对发酵液中的表达产物进行萃取,结果表明,rrIL-18主要集中在上层,而菌体和杂蛋白主要分布在中下层.取10 ku浓缩液进行DEAE离子交换层析,收集各洗脱峰,rrIL-18主要分布在浓度分别为20 mmol/L Tris+25 mmol/L NaCl洗脱液里,凝胶染色扫描后进行半定量,其纯度约为95%(图3).
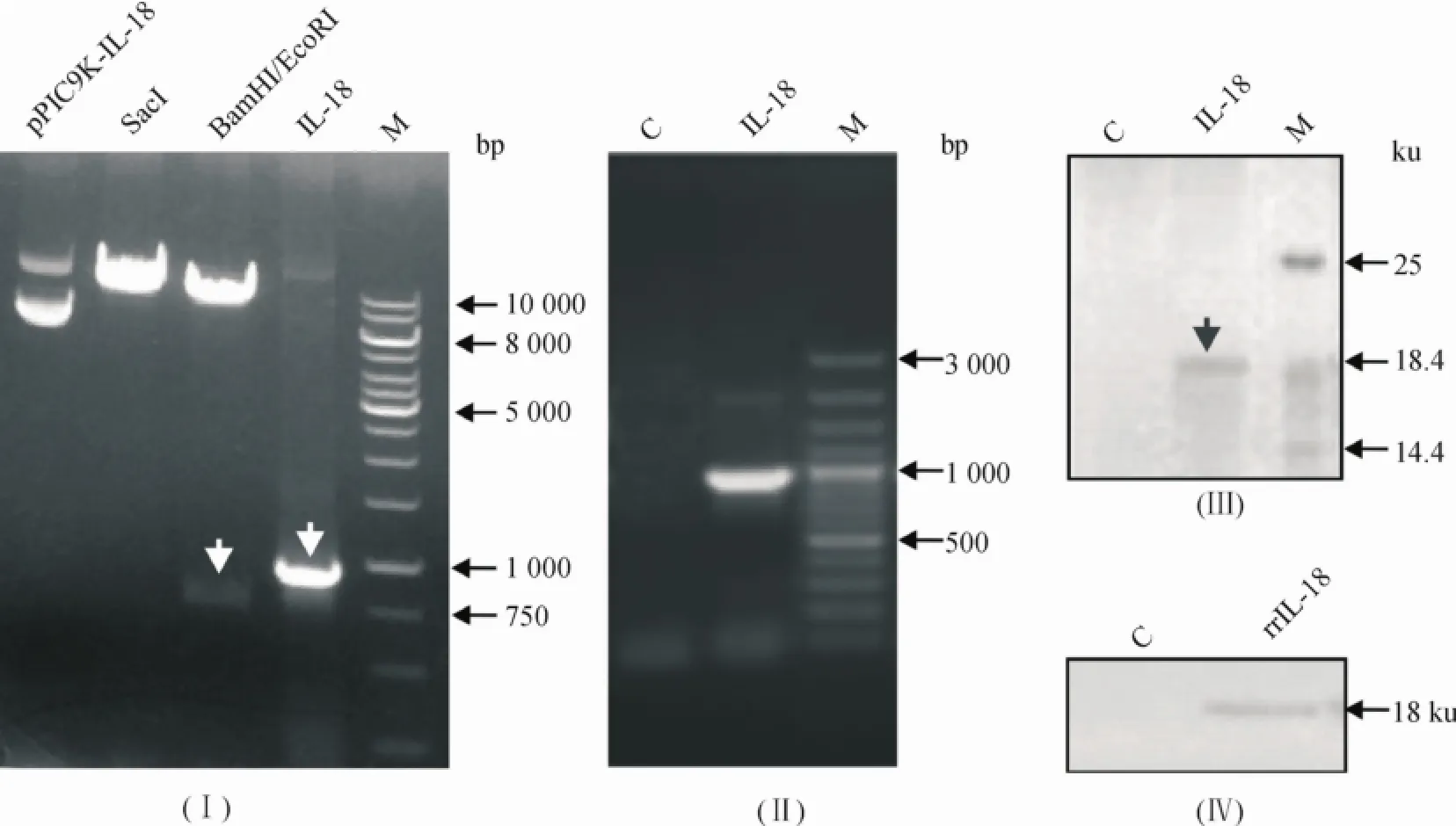
图1 重组质粒 pPIC9K-IL-18和表达产物的鉴定Fig.1 Identification of recombinant plasmid pPIC9K-IL-18 and the expression product
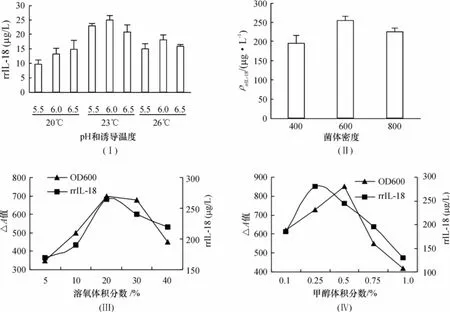
图2 不同发酵条件对 rrIL-18表达量的影响Fig.2 The affect of different fermentation conditions on the expression of rrIL-18
2.4rrIL-18对BRL-3A细胞的增殖作用
不同浓度的rrIL-18处理BRL-3A细胞后48 h,MTT法检测细胞的增殖情况,结果表明,浓度为10 ~20 ng/mL的rrIL-18处理组细胞活力显著高于正常对照组(0 ng/mL)(P<0.05),其中,浓度分别为15和20 ng/mL处理组与对正常对照组相比差异极显著(P<0.01,图4).

图3 SDS-PAGE分析分离纯化的rrIL-18Fig.3 The detection of rrIL-18 after isolation and purification

图4 不同质量浓度的 rrIL-18对 BRL-3A细胞的增殖影响Fig.4 The effect on proliferation of BRL-3A cells by treatment with different concentration of rrIL-18
2.5IL-18信号通路相关基因和通路调节的细胞增殖相关靶基因的表达
15ng/mL rrIL-18处理细胞后48 h,IL18R1的mRNA表达量增加,其蛋白水平也随之明显增加.NF-κB途径的NF-κB1、MyD88和CCNB2的mRNA水平显著高于正常对照组(P<0.05).Western blot-ting结果表明,NF-κB表达上调,其上游的募集蛋白MyD88和其调节的靶蛋白cyclin B1、cyclin B2的表达量也明显高于正常对照组(P<0.05).此外,p38/ATF途径中,CCNA2和BCL-2在转录水平显著高于正常对照组,其蛋白含量亦明显升高(P<0.05,图5).

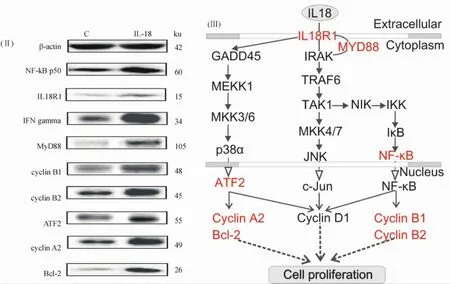
图5 IL-18信号通路相关基因/蛋白的表达变化Fig.5 The expression change of genes/proteins associated with IL-18 signaling pathway
3 讨论
毕赤酵母真核表达系统操作简单、培养成本低,又具有真核生物的折叠和分泌机制,能实现蛋白酶解、折叠、糖基化等翻译后修饰过程等优点,且发酵工艺成熟,易放大生产规模.徐跃飞等[13]研究表明毕赤酵母系统可正确表达人IL-18,随后,杨莉莉等[14]利用毕赤酵母表达出具有生物学活性的重组人IL-18,表达质量浓度为202 mg/L.本研究构建pPIC9K-IL-18载体并在毕赤酵母中成功表达出目的蛋白,进一步对高表达菌株的发酵条件进行优化,3L发酵罐的rrIL-18质量浓度可达280 mg/L,为摇瓶表达水平的11.2倍,比文献[14]报道的表达量提高38.6%.随后,本研究用双水相系统对表达产物进行萃取,又经DEAE离子交换层析进一步纯化,纯度达95%,为深入研究IL-18的生物学功能提供了条件.
研究表明,多效性的细胞因子IL-18能刺激体外培养的多种细胞增殖.Okamura等[15]发现,在有抗CD3分子单克隆抗体、刀豆蛋白A、IL-12的条件下,IL-18能刺激小鼠T细胞增殖.此外,IL-18作为一种细胞分裂原能促进原代培养的大鼠软骨细胞和狗成骨细胞增殖[8].另有研究发现,大鼠睾丸中表达IL-18,且能促进生殖细胞增殖[9].Zhou等[10]研究表明,质量浓度为20 ng/mL的 IL-18能增强原代人黑色素细胞的增殖能力.Fix等[16]研究表明,质量浓度100 ng/mL IL-18重组蛋白能促进体外培养的原代大鼠心肌成纤维细胞增殖.本研究小组以前的研究结果也显示,4 μg的注射剂量能促进大鼠再生肝的肝细胞增殖[11].本研究结果表明,rrIL-18在10 ~20 ng/mL质量浓度下能促进BRL-3A细胞增殖,与以前的研究结果相一致.
IL-18的分子结构和胞内信号转导途径类似于IL-1家族,通过其受体招募适配分子MyD88聚集IL-1相关激酶(IRAK)和肿瘤坏死因子相关因子(TRAF-6),从而激活 NF-κB[17-18].MyD88在IL-18信号通路中起着至关重要的作用.在MyD88缺陷的Th1细胞中,IL-18诱导的NF-κB和JNK途径也随之被阻断[19].转录因子NF-κB在机体内普遍存在,能通过cyclin D1调节细胞周期G1-S期转化;还能通过G2-M期的特异性基因CCNB1和CCNB2调节细胞的 G2-M期转化[20-21].本研究结果表明,rrIL-18处理BRL-3A细胞后,转录因子NF-κB及其上游的招募蛋白MyD88、其下游调节的靶蛋白cyclin B1 和cyclin B2的表达量均明显增加.因此,推论rrIL-18刺激BRL-3A细胞后NF-κB迅速被激活,并进入细胞核内调节其下游靶基因CCNB1和CCNB2的转录和表达,从而参与调节细胞增殖.
另一方面,研究表明IL-18能通过促分裂原活化蛋白激酶MAPK激活转录因子ATF2[10,22].Amin等[23]研究报道IL-18能增强人的滑膜成纤维细胞中ATF2的磷酸化.Breitwieser等[24]的研究结果显示,肝脏发育过程中ATF2的抗凋亡作用主要是通过对p38激酶转录激活调控.也有研究表明,ATF-2通过其细胞周期AMP效应元件(cyclin AMP response el-emen,CRE)激活cyclin A2和Bcl-2启动子,增强其在软骨细胞中的表达[25-26].Zhou等[10]研究表明,质量浓度为20 ng/mL IL-18孵育原代人黑色素细胞24 h时,Bcl-2发生了有意义的表达上调.本研究结果显示,rrIL-18处理BRL-3A细胞后,ATF2及其下游靶蛋白cyclin A2和抗凋亡蛋白Bcl-2的表达量均显著升高.由此,推测IL-18同时激活了 p38/ATF2途径,导致cyclin A2和Bcl-2的表达上调.
综上所述,本研究优化了IL-18在毕赤酵母中高效表达的发酵条件和纯化工艺,成功获得纯度较好的rrIL-18;并首次证实质量浓度为15 ng/mL rrIL-18孵育BRL-3A大鼠肝细胞后,激活NF-κB和p38/ATF2途径,并调节其下游细胞增殖相关靶基因CC-NB1、CCNB2、CCNA2和BCL-2的转录和表达,从而促进细胞增殖,其机制是否涉及蛋白磷酸化、siRNA干涉等方面,有待进一步研究.
[1]OKAMURA H,NAGATA K,KOMATSU T,et al.A no-vel costimulatory factor for gamma interferon induction found in the livers of mice causes endotoxic shock[J].Infect Immun,1995,63(10):3966-3972.
[2]USHIO S,NAMBA M,OKURA T.Cloning of the cDNA for human IFN-gamma-inducing factor,expression in E scherichia coli,and studies on the biologic activities of the protein[J].J Immunol,1996,156(11):4274-4279.
[3]BIET F,LOCHT C,KREMER L.Immunoregulatory functions of interleukin 18 and it’s role in defense against bacterial pathogens[J].J Mol Med,2002,80(3):147.
[4]TSUTSUI H,NAKANISHI K.Immunotherapeutic appli-cations of IL-18[J].Immunotherapy,2012,4(12):1883-1894.
[5]KIM H J,SONG S B,CHOI J M,et al.IL-18 downregu-lates collagen production in human dermal fibroblasts via the ERK pathway[J].J Invest Dermatol,2010,130 (3):706-715.
[6]SEKIYAMA A,UEDA H,KASHIWAMURA S,et al.A role of the adrenal gland in stress-induced up-regulation of cytokines in plasma[J].J Neuroimmunol,2006,171(1 -2):38-44.
[7]RAU?H P,BEADLING C,HAUN J,SLIFKA M K.Cytokine-mediated programmed proliferation of virus-spe-cific CD8(+)memory T cells.Immunity,2013,38 (1):131-139.
[8]CORNISH J,GILLESPIE M T,CALLON K E,et al.In-terleukin-18 is a novel mitogen of osteogenic and chondro-genic cells[J].Endocrinology,2003,144(4):1194-1201.
[9]STRAND M L,WAHLGREN A,SVECHNIKOV K,et al.Interleukin-18 is expressed in rat testis and may pro-mote germ cell growth[J].Mol Cell Endocrinol,2005,240(1/2):64-73.
[10]ZHOU J,SHANG J,SONG J,et al.Interleukin-18 aug-ments growth ability of primary human melanocytes by PTEN inactivation through the AKT/NF-κB pathway[J].Int J Biochem Cell Biol,2013,45(2):308-316.
[11]ZHANG J,MA C,LIU Y,et al.Interleukin 18 acceler-ates the hepatic cell proliferation in rat liver regeneration after partial hepatectomy[J].Gene,2014,537(2):230 -237.
[12]TOWBIN H.Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets:procedure and some applications[J].Biotechnology,1979,76 (9):4350-4354.
[13]徐跃飞,吴毓,张春鹏,等.人白细胞介素18在毕氏酵母细胞中的分泌表达[J].中国医学生物技术应用杂志,2004,(1):32-35.
[14]杨莉莉,魏枫,刘虹,等.重组人白介素18在毕赤酵母中的高效分泌表达[J].细胞与分子免疫学杂志,2008,24(11):1040-1043.
[15]OKAMURA H,TSUTSI H,KOMATSU T,et al.Cloning of a new cytokine that induces IFN-gamma production by T cells[J].Nature,1995,378(6552):88-91.
[16]FIX C,BINGHAM K,CARVER W.Effects of interleu-kin-18 on cardiac fibroblast function and gene expression.Cytokine,2011,53(1):19-28.
[17]BIET F,LOCHT C,KREMER L.Immunoregulatory functions of interleukin 18 and its role in defense against bacterial pathogens[J].J Mol Med,2002,80(3):147 -162.
[18]NAKANISHI K,YOSHIMOTO T,TSUTSUI H,et al.Interleukin-18 is a unique cytokine that stimulates both Th1 and Th2 responses depending on its cytokine milieu.Cytokine Growth Factor Rev,2001,12(1):53-72.
[19]ADACHI O,KAWAI T,TAKEDA K,et al.Targeted disruption of the MyD88 gene results in loss of IL-1-and IL-18-mediated function[J].Immunity,1998,9(1):143-150.
[20]CUDE K,WANG Y,CHOI H J,et al.Regulation of the G2-M cell cycle progression by the ERK5-NFkappaB sig-naling pathway[J].J Cell Biol,2007,177(2):253-264.
[21]HINATA K,GERVIN A M,JENNIFER ZHANG Y,et al.Divergent gene regulation and growth effects by NF- kappa B in epithelial and mesenchymal cells of human skin[J].Oncogene,2003,22(13):1955-1964.
[22]ALBONI S,MONTANARI C,BENATTI C,et al.Inter-leukin 18 activates MAPKs and STAT3 but not NF-κB in hippocampal HT-22 cells[J].Brain Behav Immun,2014,40:85-94.
[23]AMIN M A,MANSFIELD P J,PAKOZDI A,et al.In-terleukin-18 induces angiogenic factors in rheumatoid ar-thritis synovial tissue fibroblasts via distinct signaling pathways[J].Arthritis Rheum,2007,56(6):1787-1797.
[24]BREITWIESER W,LYONS S,FLENNIKEN A M,et al.Feedback regulation of p38 activity via ATF2 is essential for survival of embryonic liver cells[J].Genes Dev,2007,21(16):2069-2082.
[25]BEIER F,TAYLOR A C,LUVALLE P.Activating tran-scription factor 2 is necessary for maximal activity and se-rum induction of the cyclin A promoter in chondrocytes [J].J Biol Chem,2000,275(17):12948-12953.
[26]MA Q,LI X,VALE-CRUZ D,et al.Activating tran-scription factor 2 controls Bcl-2 promoter activity in growth plate chondrocytes[J].J Cell Biochem,2007,101(2):477-487.
[责任编辑:朱颖?]
Expression of interleukin-18 in Pichia pastoris and its effects on proliferation of BRL-3A cells via activation of NF-κB and p38 pathway
ZHANG Jihong1,2,XU Xiaoya2,YANG Ganggang2,MA Chengkai2,XU Cunshuan2
(1.Department of Histology and Embryology,School of Basic Medical Sciences,Xinxiang Medical University,Xinxiang,453007,China;2.State Key Laboratory Cultivation Base for Cell Differentiation Regulation,Xinxiang,453007,China)
Aim:To explore the expression conditions of rat interleukin-18(rIL-18)in Pichia pastoris and its effects and mechanism on proliferation of BRL-3A cells.Methods:pPIC9K-IL-18 expression vec-tor was constructed and then transformed to GS115 by electroporation.Expression level of the recombi-nant fusion protein was determined by PCR,SDS-PAGE and Western blotting.The induction conditions were optimized and the expression product was isolated and purified by the method of aqueous two-phase extraction coupled with DEAE ion exchange chromatography.The effect of the recombinant rat IL-18(rrIL-18)on rat liver cells was detected by MTT assay.The expression changes of IL-18-associated genes in the signaling pathway were determined by RT-PCR and Western blot.Results:Under the condi-tions of cell density at 600,pH=6.0,23?C,20%dissolved oxygen(DO)and 0.25%methanol in a 3L bioreactor,and after it was induced for 5d,the highest expression level of rrIL-18 reached 280 mg/L.The purity of rrIL-18 was 95%after purification.It was found that rrIL-18 promoted proliferation of BRL-3A cells at the concentration of 15-20 ng/mL(P<0.05).Furthermore,at 48 h after treatment,IL-18 receptor increased at both mRNA and protein levels.The expression levels of transcription factor NF-κB,MyD88,and the downstream targets cyclin B1 and cyclin B2 were found remarkably increased.The tran-scription factor ATF2 of the p38 pathway and its targets cyclin A2 and Bcl-2 were also remarkably in-creased.Conclusion:Rat IL-18 expression vector was successfully constructed and the expression condi-tions and purification method were optimized in Pichia pastoris system.It was demonstrated for the first time that IL-18 can promote proliferation of BRL-3A cells via NF-κB and p38/ATF2 pathways by targe-ting cyclin B1,cyclin B2,cyclin A2 and Bcl-2.
interleukin-18;Pichia pastoris;aqueous two-phase extraction;cell proliferation;signaling pathway
Q291
A
1000-9965(2015)06-0458-09
10.11778/j.jdxb.2015.06.004
2015-03-02
国家973计划前期研究专项基金项目(2012CB722304);河南省重大科技攻关项目(111100910600)
张继红(1976-),女,博士研究生,研究方向:真核基因的表达与调控
徐存拴(1958-),男,教授,博士生导师,Tel:0373-3328084;E-mail:cellkeylab@126.com
