连接酶检测反应技术应用于乙型肝炎病毒拉米夫定耐药和阿德福韦耐药突变的研究
2015-09-01单幼兰江培学重庆医科大学附属第二医院肝病实验室重庆400038复旦大学附属华山医院感染科上海0033
单幼兰, 江培学(.重庆医科大学 附属第二医院 肝病实验室,重庆 400038;.复旦大学 附属华山医院 感染科,上海 0033)
连接酶检测反应技术应用于乙型肝炎病毒拉米夫定耐药和阿德福韦耐药突变的研究
单幼兰1,江培学2
(1.重庆医科大学附属第二医院肝病实验室,重庆400038;2.复旦大学附属华山医院感染科,上海200233)
目的:研究高温连接酶检测反应技术(LDR)技术检测乙肝病毒拉米夫定耐药和阿德福韦耐药突变的可行性.方法:应用LDR技术和多聚酶链式反应(PCR)技术,在乙肝病毒基因相关区域设计引物和探针检测突变位点.结果:该方法能很好的区分野生型质粒和突变型质粒;90例临床样本的测序结果与LDR检测结果基本一致.结论:LDR技术可以应用于临床乙肝病毒样本的拉米夫定耐药和阿德福韦耐药的检测.
乙肝病毒;拉米夫定;阿德福韦;耐药突变
据估计,全球有3.5亿人患有慢性乙肝,2006年全国人群乙肝等有关疾病血清流行病学调查结果显示,中国人群乙肝表面抗原携带率为7.18%,大概有9 300万的乙肝感染者.2011年病毒性肝炎HBV(Hepatitis B Virus)报告发病例数中乙肝占到80%[1-4].HBV的反复感染,可能导致慢性肝炎、肝硬化甚至肝癌,积极的抗病毒治疗可以有效提高患者的生存质量.拉米夫定(Lamivudine,LMD)是迄今我国用于乙型肝炎治疗的主要首选药物之一;阿德福韦酯(Adefovir,ADV)是新一代抗乙型肝炎病毒新药,可以有效抑制HBV在肝细胞内的复制.然而,随着临床服药时间的延长,拉米夫定与阿德福韦酯的耐药率会显著提高.常见的拉米夫定耐药位点是L180M和M204I/V(YIDD/YVDD);常见的阿德福韦耐药位点是A181V/T和N236T.因此临床上急需一种灵敏性高、特异性好的方法检测拉米夫定与阿德福韦酯耐药[5-7].本研究建立了一种基于连接酶检测反应技术的拉米夫定与阿德福韦酯耐药突变检测方案,将为临床HBV耐药的诊断提供实验依据.
1 资料与方法
1.1资料与材料
(1)病例资料收集2009年至2012年在重庆医科大学附属第二医院进行抗病毒治疗的慢性乙型肝炎患者样本180例,其中90例患者服用拉米夫定治疗2年、90例患者用阿德福韦治疗3年.男97例,女83例,年龄39~58岁;HBeAg(e抗原)阳性患者145例,抗HBeAg阳性35例,平均丙氨酸氨基转移酶(ALT)水平为(79.8±53.1)IU/L,平均HBV DNA水平(log10拷贝数/mL)为5.75.上述研究病例获得医院伦理委员会批准;相关患者都签署了知情同意书.本研究中慢性乙型肝炎特征为:乙型肝炎表面抗原阳性,且至少6个月;血清HBV DNA>10 000 IU/mL;ALT水平升高或反复升高.患者血清分离后-70℃保存备用.
(2)仪器及试剂荧光定量PCR仪为Life Technology公司ABI7500,HBV DNA定量试剂盒和HBV cccDNA定量试剂盒均购自上海星耀医学科技发展有限公司(复星诊断).MJ-90 PCR购自美国伯乐公司,ABI3130测序仪购自美国ABI公司.
1.2方法
(1)HBV DNA定量检测采用ABI7500实时荧光定量PCR仪检测,试剂由上海星耀医学科技发展有限公司提供.按照HBV DNA定量试剂盒说明书进行.取血清100 μL加入等量DNA提取液A,混匀后143 00 g离心10 min,去除上清后加50μL DNA提取液B,混匀后100℃煮沸10 min,离心后取上清即为总HBV DNA.提取产物做实时荧光多聚酶链式反应(ploymerase chain reaction,PCR),由标准曲线计算出HBV DNA的定量浓度值.
(3)连接酶方法的引物和探针引物探针碱基序列及表度(表1).

表1 引物探针序列Table 1 Primers and Probes
(3)测序方法的引物和探针测序的引物提供给Invitrogen司合成并完成测序,测序引物如下:
5′-CATTTGTTCAGTGGTTCGTA-3′;
5′-CAAAAGAAAATTGGTAACAGCGGTA-3′
PCR条件为:94℃ 4 min,30个循环94℃ 10 sec;60℃45 sec;72℃ 1 min.PCR产物送Invitrogen做测序,测序结果在NCBI上分析比对.
(4)PCR扩增PCR扩增体系包括浓度为10 mmol/L三羟甲基氨基甲烷(Tris),HCl(pH=8.3)、浓度分别为50 mmol/L KCl、2.0 nmol/L MgCl2、200 tx mol/L dNTP、300 nmol/L引物、1.5 U热启动Taq酶、5 μL DNA模板,总反应体积为50 L.反应条件为:首先在95℃反应10 min以激活热启动酶,然后95℃ 30 s,54℃ 50 s,72℃ 60 s,扩增35个循环,最后72℃延伸10 min.
(5)LDR检测LDR缓冲溶液中加入2 μL PCR产物、浓度为0.1 mmol/L DNA连接酶,总反应体积为20 μL.反应条件为:95℃2 min,然后95℃15 s,50℃20 s,循环3O次.扩增完成后加入0.5 μL浓度为0.5 mmol/L的EDTA使反应终止.取2.5 μL反应产物与等体积上样缓冲液混合,然后在94℃变性2 min,迅速在冰上冷却,立即加入ABI Prism 3130测序仪变性凝胶进行电泳30 min.
1.3统计学方法
电泳结果采用Genemapper 4.0软件进行分析.
2 结果
2.1对照质粒检测结果
首先对含有HBV rtA181位点突变型及野生型的质粒分别进行检测,每个反应重复3次,均得到预期的检测结果,与野生型质粒没有交叉扩增.
将含有是L180M、M204I/V、A181V/T和N236T的质粒分别稀释成106、105、104、103及102拷贝/mL进行检测,每个检测反应重复3次.其中10拷贝/mL以上的质粒均能稳定地检出突变,但102拷贝/mL的质粒则至少有1次未能有检测结果,因此可以认为本方法检测的敏感性为103拷贝/mL.以甲型肝炎病毒(HAV)RNA、丙型肝炎病毒(HCV)RNA及人巨细胞病(HCMV)DNA为模板进行检测,未检测到阳性信号.
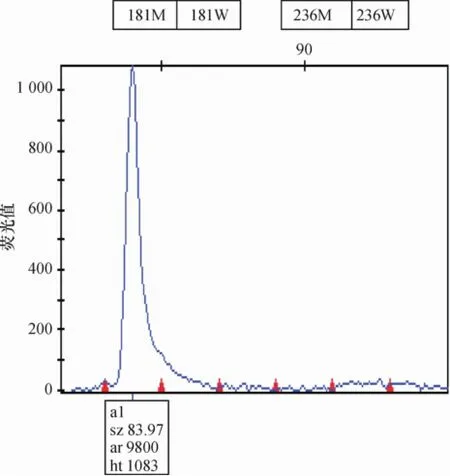
图1 181突变型质粒Fig.1 181mutation-type plasmid

图2 236突变型质粒Fig.2 236 mutation-type plasmid
2.2临床样本LDR检测
90例拉米夫定治疗的临床样本中LDR共检出43例突变样本,其中YIDD(204I)14例YVDD (204V)23例,L180M6例,其中又包括YIDD和L180M变异3例;YIDD和L180M变异4例;YIDD 和YMDD变异5例.90例阿德福韦治疗的临床样本中LDR共检出8例突变样本,其中A181V/T4例,N236T3例,A181V/T和N236T变异1例.

图3 YIDD变异和A181V/T变异Fig.3 YIDD mutation and A181V/T mutation

图4 A181V/T变异和N236T变异Fig.4 A181V/T mutation and N236T mutation
2.3Sanger法测序验证
LDR-PCR法对90例拉米夫定治疗的临床样本中共检出40例突变样本,其中YIDD(204I)13例,YVDD(204V)21例,L180M6例,其中又包括YIDD 和L180M变异3例;YVDD和L180M变异 3例;YIDD和YMDD变异5例.我们用测序法对90例阿德福韦治疗的临床样本中PCR-LDR法共检出的8例突变样本进行验证,其中A181V/T4例,N236T3例,LDR法中的A181V/T和N236T变异未检测到.最终两种方法的不一致的有4例,分别是YIDD1例、YVDD 2例以及阿德福韦混合变异1例.两种方法的符合率为92.16%.

表2 测序法验证Table 2 Sequencing verifcation
2.4对4例LDR与测序不一致的标本进行亚克隆测序确认.每例标本挑选20个亚克隆进行测序分析,分别发现有4个、3个、2个和5个亚克隆含有突变序列,与LDR的检测结果一致.
3 讨论
慢性乙型肝炎治疗的总体目标是最大限度地长期抑制HBV,减轻肝细胞炎症坏死及肝纤维化,延缓和减少肝功能失代偿、肝硬化、HCC及其并发症的发生,核苷(酸)类抗HBV药物长期治疗,可导致耐药的发生,进而出现肝炎复发,甚至肝功能衰竭死亡,或肝硬化/肝功能失代偿等严重并发症.因此,临床上需要灵敏的方法检测耐药突变,以便及早调整治疗方案.拉米夫定和阿德福韦是目前治疗慢性乙型肝炎的一线药物之一,但随着治疗时问的延长其耐药突变率也逐渐提高.拉米夫定治疗第1年、2年、3年、4年耐药比例为分别为14%、38%、49%、66%)[1].阿德福韦治疗2、3和5年的耐药率分别为2.0%、5.9%和29.0%[8-11].
尽管有多种方法可以用来监测拉米夫定和阿德福韦耐药突变,但临床上应用最多的还是测序法和线性探针反向杂交技术(Line probe assay,LiPA).测序法敏感性较低,只能检测到病毒群体中20%以上的突变株,不能进行高通量检测,且其结果判断需要对测序图谱进行认真细致的分析.LiPA由于价格昂贵,不适合在HBV高度流行的发展中国家大面积推广.LDR技术已经广泛应用于单核苷酸多态性分析,并且成功应用于低比例HBV拉米夫定耐药突变株的检测,可以检测到HBV群体中1%的YIDD变异株[11-14].
高温连接酶检测反应技术(ligase detection reac-tion,LDR)是一种新兴的单核苷酸多态性(single nu-cleotide polymorphism,SNP)分型检测方法.其原理是高温连接酶检测到模板DNA与两条探针DNA的接头处存在着碱基错配,则连接反应不能进行;即如果探针与模板有一个碱基不配对,连接反应不能进行,如果探针与模板完全互补,连接反应完成.与其它检测技术相比,LDR检测技术拥有准确度高、通用性强、通量大、操作简单、成本低等众多明显优势[15-18].
本研究检测的标本均来自接受拉米夫定和阿德福韦治疗3年以上且血清HBV DNA浓度大于103拷贝/mL的患者.90例拉米夫定治疗患者中共有43例(47.78%)检出拉米夫定耐药突变,且有32例出现临床耐药,90例阿德福韦治疗患者中共有8例(8.89%)检出阿德福韦耐药突变,且有5例出现临床耐药,结果表明长期接受拉米夫定和阿德福韦治疗仍然没有产生病毒学完全应答的患者发生耐药突变的比例比较高.本方法应用于拉米夫定和阿德福韦治疗的耐药监测,有助于早期发现耐药现象,合理确定治疗方案.
核苷(酸)类药物治疗期间耐药发生是不可完全避免的,选用适当的药物和优化治疗方案可以最大程度地预防和延缓耐药的发生.一旦发生耐药,如果不及时发现,将给治疗方案带来盲目性,因此,特异性好、灵敏度高的耐药检测方法对提高临床用药针对性具有很好的指导意义.
[1]中华医学会传染病与寄生虫病学分会、肝病分会.病毒性肝炎防治方案[J].中华肝脏病杂志,2000,8(6):324-329.
[2]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华传染病杂志,2011,29:65-80.
[3]张继明,刘芳,尹有宽,等.拉米夫定治疗前后 HBV全基因序列检测对比[J].中华传染病杂志,2003,21:260 264.
[4]刘传苗,张欣欣,陆志檬.拉米夫定治疗中乙型肝炎病毒YMDD野毒株和变异株的变化[J].肝脏,2004,9 (2):73-76.
[5]刘锦屏,刘友德,杨绍萍,等.烟台地区原发性肝癌患者乙肝病毒基因型分析[J].中华保健医学杂志,2010,(12):355-57.
[6]张智,张珍,李楠,等.185例广东人乙型肝炎病毒基因分型及耐药基因检测[J].广东医学,2008,29 (1):797-98.
[7]左兴,谢奇峰,杨林,等.广东地区HBV基因型在家庭集聚感染中的分布及意义[J].中山大学学报(医学版),2009,30(35):19-23.
[8]GHANY M,LIANG T J.Drug targets and molecular mechanisms of drug resistance in chronic hepatitis B[J].Gastroenterology,2007,132(4):1574-1585.
[9]HADZIYANNIS S J,TASSOPOULOS N C,HEATH-COTE E J,et al.Long-term therapy with adefovir dipivox-il for HBeAg-negative chronic hepatitis B[J].N Engl J Med,2005,352(26):2673-2681.
[10]HADZIYANNIS S J,TASSOPOULOS N C,HEATHEOTE E J,et al.Long-term therapy with adefovir dipivoxil for HBeAg-negative chronic hepatitis B for upto 5 years[J].Gastroenterology,2006,131(6):1743-1751.
[11]张欣欣,于德敏.乙型肝炎病毒耐药及检测[J].肝脏,2007,12:25-27.
[12]WESTLAND C E,YANG H,DELANEY W E,et al.Ac-tivity of adefovir dipivoxil against all patterns of lam ivudi-ne resistant hepatitis B virusesin patients[J].J Viral Hepat,2005,12(1):67-73.
[13]LOK A S,ZOULIM F,LOCARNINI S,et al.Antiviral drug-resistant HBV:standardization of nomenclature an-dass ys and recommendations for management[J].Hepa-tology,2007,46(1):254-265.
[14]KHANNA M,CAO W,ZIRVI M,et al.Ligase detectionre-action for identi6cation of low abundance mutations[J].Clin Biochem,1999,32(4):287 290
[15]XIAO Z,XIAO J,JIANG Y.A novel method based on lig-ase detection reaction for low abundant YIDD mutants det-edtion in hepatitis B virus[J].Hepatology Res,2006,34 (3):150-155.
[16]WANG Y Z,XIAO J H,RUAN L H,et al.Detection of the rtA181V/T and rt236T nutations associated with re-sistance to adefovir dipivoxil using a ligase detection reatction assay[J].Clin Chim Acta,2009,408(1/2):70 -74.
[17]MATETZKY S,SHARIR T,DOMINGOM,et al.Elevated troponin Ilevel on admission is associated with adverse outcome of prim ary angioplasty in acute myocardial in-farction[J].Circulation,2000,102(14):1617-1616.
[18]ORITO E,ICHIDA T,SAKUGAWA H,et al.Geograph-ic distribution of hepatitis B virus(HBV)genotype in pa-tients with chronic HBV infection in Japan[J].Hepatolo-gy,2001,34(3):590-594.
[19]KRUCOFF M W,JOHANSON P,BAEZA R,et al.Clinical utility of serial and continuous ST segment recovery as-sessment in patients with acute ST elevation m yocardial infarction:assessing the dynamics of epieardial and myo-cardial reperfusion[J].Circulation,2004,110(25):533 -539.
[20]SCHULTZ U,CHISARI F V.Recombinant duck interfer-on gamma inhibits duck hepatitis B virus replication in primary hepatocytes[J].J Viro1,1999,73(4):3162-3168.
[21]DANDRI M,BURDA M R,WILL H,et al.Increased hep-atocyte turnoxer and inhibition of woodchuck hepatitis B virus replication by adefo、ir in vitro do not lead to reduc-tion of the closed circular DNA[J].Hepatology,2000,32 (1):139-146.
[22]CHEN Y,SZE J,HE M L.HBV cccDNA in patientssera as an indicator for HBV reactivation and an early signal of 1iver damage[J].World J Gastroentero1,2004,10(1):82-85.
[责任编辑:朱颖?]
Application of ligase detection reaction(LDR)in detection of Lamivudine-resistant and Adefovir-resistant mutations
SHAN Youlan1,JIANG Peixue2
(1.Liver Disease Laboratory,Medical University,the Second Affiliated Hospital of Chongqing,Chongqing 400038,China;2.Department of Infectious Diseases,Huashan Hospital,Fudan University,Shanghai 200233,China)
Aim:To investigate the feasibility of LDR(ligase detection reaction)as a technique to de-tect HBV Lamivudine-resistant and Adefovir-resistant mutations.Methods:LDR and PCR techniques were used to detect the mutations in the region of hepatitis B virus gene with primers and probes.Re-sults:This method can well distinguish between wild-type and mutant plasmid vectors,and the sequen-cing results were well in agreement with LDR test results for the clinical samples of 90 cases.Conclu-sion:LDR method can be applied in the detection of Lamivudine-resistant hepatitis B virus and Adefovir resistance for clinical samples.
hepatitis B virus;Lamivudine;Adefovir;resistance mutations
R446.9
A
1000-9965(2015)06-0509-06
10.11778/j.jdxb.2015.06.012
2015-06-30
上海科委创新发展基金项目(11DZ1920403)
单幼兰(1967-)女,研究方向:传染病的临床分子诊断
江培学,男,复旦大学博士,Tel:021-60765836;E-mail:jiangpeixue@126.com
