肺癌细胞中miR-182启动子甲基化状态研究
2015-08-27李永文孙永林任凡李颖刘明辉刘红雨陈军
李永文 孙永林 任凡 李颖 刘明辉 刘红雨 陈军
肺癌是呼吸系统最常见的恶性肿瘤,其发病率和死亡率在世界范围内居高不下,特别是在我国大中城市呈现逐年上升的趋势。肺癌的发生发展是一个多步骤的复杂过程,涉及多个基因的异常调控[1]。近年来,随着肿瘤研究的深入,表观遗传学异常修饰在肺癌发生过程中的作用越来越受到重视,众多的证据显示,DNA异常甲基化与miRNA的异常调控对肿瘤发生发展起重要的作用[2]。
MiRNAs是一类保守的、非编码蛋白的单链小分子,在转录后水平调控靶基因表达,具有广泛的基因调节功能,可调节基因活动各个层面,如生长、分化、凋亡等[3]。研究[4]证明miRNAs参与生命过程中一系列重要进程,包括早期胚胎发育、细胞增殖、细胞凋亡、细胞死亡以及肿瘤发生、发展和侵袭转移等。据估计,人类中存在1,000余种miRNAs,约1/3基因表达受miRNAs调控。MiRNAs大多与其靶mRNA的3′非翻译区(untranslated region, UTR) 一定程度地互补配对,如果互补配对程度高 (大多数植物中), 则可导致靶基因mRNA降解;如果互补配对程度低 (大多数动物中) ,则可抑制靶基因mRNA的翻译。目前已研究证实,miRNAs在肿瘤发生发展过程中起着相当重要的作用,而成为近年来研究的热点。如研究发现miRNA-200家族[5]、miR-155[6]等多种miRNAs参与调控肿瘤的发生发展过程。此外,目前的研究还表明,许多miRNAs基因内部或邻近的CpG岛发生异常甲基化修饰导致的miRNAs异常表达,有可能对肿瘤的发生发展起重要的调控作用。
MiR-182是miR-183 家族(包括miR-183、miR-182、miR-96三种miRNA)的成员之一。miR-182位于人染色体7q31-34区,与人c-Met、BRAF等癌基因相邻[7]。研究[8-12]发现,miR-182是一种肿瘤特异性表达miRNA,其异常表达与肺癌、乳腺癌、肝癌、结直肠癌的发病机制相关。Segura等[7]报道miRNA-182可以促进黑色素瘤侵袭转移。他们的实验证实高表达miRNA-182在体内外均可促进黑色素瘤细胞侵袭转移,而下调miR-182可阻止细胞侵袭转移并引发细胞凋亡。进一步研究还证实miR-182通过直接抑制FOXO3和小眼球相关转录因子而促进侵袭转移,而增加FOXO3和小眼畸形相关转录因子(microphthalmiaassociated transcription factor, MiTF)的表达,还可抑制miR-182的促侵袭转移效果。Zhang等[13]发现,在人肺腺癌细胞株A549中,miR-182通过抑制人的皮肌动蛋白(cortactin,CTTN)基因,而抑制细胞的增殖和侵袭。
多项研究表明,肿瘤细胞中miR-182启动子区存在着异常甲基化修饰。如Liu等[14]报道在黑色素瘤细胞中miR-182启动子区的DNA存在异常甲基化。Xu等[15]也报道,miR-182启动子上游8 kb-10 kb区域存在CpG岛,5'-Aza-dC处理可提高肿瘤细胞中miR-182的表达,从而促进miR-182在肿瘤细胞中的作用。而miR-182在肺癌细胞中的甲基化情况尚未有报道。本研究首先在不同肺癌细胞系中初步研究miR-182 启动子调控区的甲基化状态,为进一步阐明miR-182在肺癌发生发展过程中的作用奠定基础。
1 材料与方法
1.1 主要试剂及仪器 人肺癌细胞系A549(购自美国ATCC)、95C、95D(由军事医学科学院陆应麟教授惠赠)、NL9980和L9981(由周清华教授构建)。以上细胞系由天津市肺癌研究所保存。RMPI 1640和DMEM培养基、胎牛血清及Trizol试剂购自Life Technologies公司(Carlsbad, CA, USA);实时荧光定量PCR试剂盒、Premix Ex Taq Hotstart Version购自Takara公司(Dalian,China);反转录试剂盒购自Promega公司(Madison, WI,USA);Bulge-LoopTMmiRNA qRT-PCR Primer Set购自广州锐博生物科技有限公司(Guangzhou, China);QIAamp DNA Mini Kit和EpiTect Bisulfite Kit购自Qiagen公司(Hilden,Germany);甲基转移酶抑制剂5'-氮杂-2'-脱氧胞苷(5'-Aza-dC)购自Sigma-Aldrich公司(Kansas, Missouri,USA);青霉素-链霉素溶液购于碧云天生物技术研究所(Haimen, China)。
1.2 细胞培养及DNA甲基转移酶抑制剂5'-Aza-dC处理A549、95C、95D、NL9980和L9981细胞培养于10 cm培养皿,37 ℃、5%CO2饱和湿度的培养箱中,培养基为含10%胎牛血清的RPMI 1640培养基或DMEM培养基。0.25%胰酶-EDTA消化传代,所有实验均采用对数生长期细胞。DNA甲基转移酶抑制剂5'-Aza-dC溶于DMSO溶液中,用10 μmol/L浓度处理6孔板中细胞(每孔2×105细胞),3个复孔,连续处理72 h,每24 h更换新鲜培养液。
1.3 MiR-182基因表达的real-time PCR检测 Trizol法常规提取细胞总RNA,根据广州锐博生物科技有限公司Bulge-LoopTMmiRNA qRT-PCR Primer Set产品说明书将2 μg RNA进行逆转录,合成cDNA,并置于实时荧光定量PCR仪Applied Biosystems 7900HT Fast Real-Time PCR System instrument and software(Applied Biosystems, USA)进行realtime PCR反应。反应条件:95 ℃ 20 s;40个PCR循环(95 ℃ 10 s;60 ℃ 20 s;72 ℃ 10 s)。以U6作为内参照,A549作为矫正因子,数据采用2-ΔΔCT法进行分析,ΔCT=CT(miR-182)-CT(U6),ΔΔCT=ΔCT(其他细胞)-ΔCT(A549)。
1.4 基因组DNA提取 收集细胞沉淀,按QIAamp DNA Mini Kit说明书步骤进行DNA提取,DNA提取后琼脂糖电泳检测DNA纯度,并用紫外分光光度计进行定量。
1.5 MiR-182启动子查找及甲基化特异性PCR(methylationspecific PCR, MSP)引物设计 运用UCSC数据库预测人miR-182启动子序列,提取启动子上游8 kb-10 kb区域。分别利用MethPrimer在线分析网站和Methyl Primer Express v1.0软件分析并预测人miR-182启动子甲基化CpG岛,并通过Methyl Primer Express v1.0软件设计甲基化特异性引物和非甲基化引物。
1.6 甲基化特异性PCR(methylation-specific PCR, MSP)检测 基因组DNA亚硫酸盐修饰:每个样本取800 ng为模板进行重亚硫酸盐处理。DNA的重亚硫酸盐修饰按照EpiTect Bisul fite Kit(QINGEN)的说明书,在PCR仪上进行,修饰条件:99 ℃ 5 min,60 ℃ 25 min,99 ℃ 5 min,60 ℃ 85 min,99 ℃ 5 min,60 ℃ 175 min,最后置20 ℃不超过24 h。修饰完成后按照试剂盒附带的纯化试剂说明书对DNA进行纯化,纯化后-20 ℃保存备用。修饰后目的片段PCR扩增和产物的凝胶纯化:基因组DNA重亚硫酸盐处理并纯化后,取1 μL DNA为模板进行扩增。MSP引物:M-forward: 5'-TAGGGGTCGTTCGATTTTAC-3',M-reverse: 5'-CTACCCCCGACGAATATTACTA-3' ,目的条带为103 bp;非甲基化引物:U-forward: 5'-GTTAGGGGT TGTTTGATTTTAT-3', M-reverse: 5'-CCTACCCCCAACAA ATATTACTAT-3',目的条带为103 bp,使用Takara热启动酶进行扩增。PCR循环条件为:95 ℃预变性3 min,98 ℃ 10 s,48 ℃ 30 s,72 ℃ 30 s,5个循环;95 ℃ 15 s,50 ℃ 30 s,72 ℃ 30 s,5个循环;95 ℃ 15 s,52 ℃ 30 s,72 ℃ 30 s,10个循环;95 ℃ 15 s,54 ℃ 30 s,72 ℃ 30 s,20个循环;72 ℃延伸5 min,4 ℃保存。扩增产物经2%琼脂糖电泳进行鉴定,阴性对照采用双蒸水为模板。上述PCR产物直接交由由北京六合华大基因公司测序,经NCBI Blast判定结果。
1.7 统计学方法 应用SPSS 21.0统计软件进行分析,高低转移细胞系中miR-182的表达水平比较、同一细胞系处理组与对照组间的miR-182的表达比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同肺癌细胞系中miR-182的表达 采用real-time PCR方法,检测不同肺癌细胞系中miR-182的表达。结果如图1所示,不同肺癌细胞系中miR-182的表达不同,其中,在人高转移大细胞肺癌细胞L9981的表达明显低于人低转移大细胞肺癌细胞NL9980(P<0.05),在人高转移肺腺癌细胞95D的表达明显低于人低转移肺腺癌细胞95C(P<0.01),而miR-182在高转移细胞系A549中的表达最低。
2.2 miR-182启动子区CpG岛的查找及MSP引物设计 应用UCSC数据库预测出人miR-182 DNA启动子序列,并获取启动子上游8 kb-10 kb区域共2,400 bp,再通过MethPrimer在线分析网站和Methyl Primer Express v1.0软件分析这段序列的CpG岛,采用标准:碱基对>300,GC%>50.0%,观察值/预测值>0.6。结果显示,miR-182 DNA启动子的CpG岛长度1,989 bp,位于miR-182上游148 bp-2,138 bp(图2)。通过Methyl Primer Express v1.0软件设计出7对MSP-PCR引物,并筛选出合适的引物。
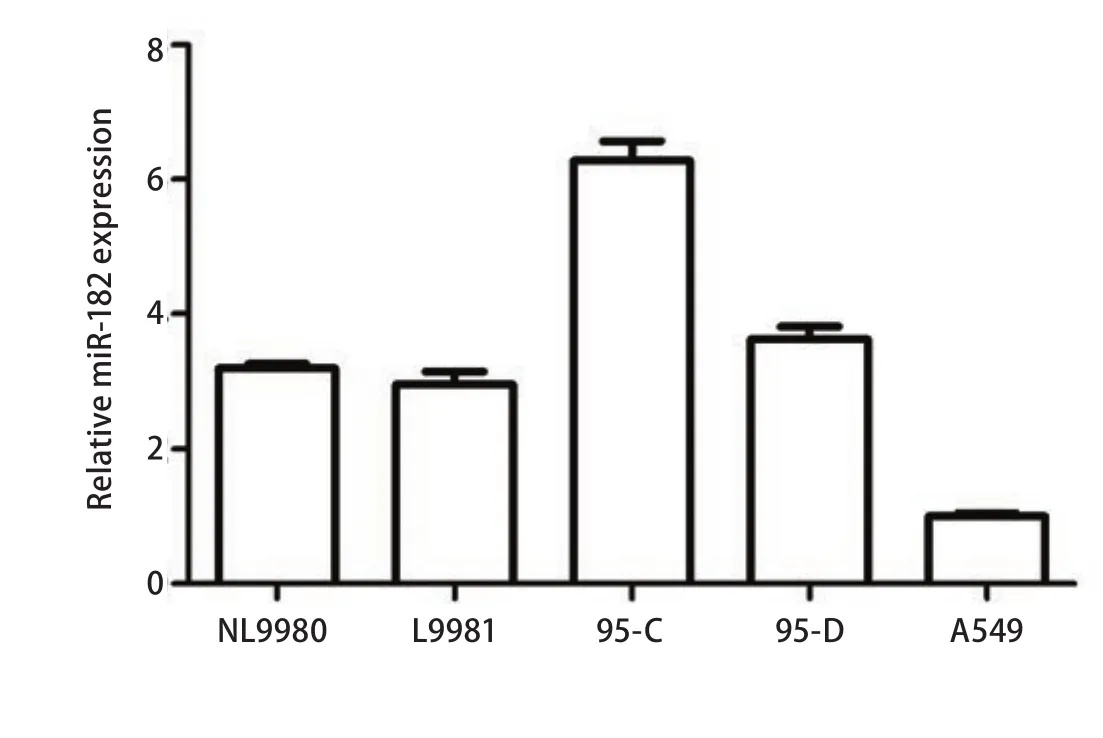
图1 不同肺癌细胞株中miR-182表达水平Fig1 The expression level of miR-182 in different lung cancer cell lines by real-time PCR

图2 miR-182启动子CpG岛的预测及MSP引物设计。A: MethPrimer数据库和MethyPrimer Express软件预测的miR-182CpG岛;B:MSP引物设计示意图。Fig2 The prediction of miR-182 promoter CpG island and MSP primers design.A: Prediction of miR-182 CPG island using MethPrimer database and MethyPrimer Express software; B: Schematic diagram of MSP primer design.MSP: methylation-specific PCR.
2.3 不同肺癌细胞株中miR-182启动子甲基化状态的检测提取不同肺癌细胞系的DNA,应用重亚硫酸盐处理,未甲基化的胞嘧啶(C)将转变为尿嘧啶(U),而甲基化的胞嘧啶(C)不变。然后将重亚硫酸盐处理后的DNA运用MSP-PCR来检测这些肺癌细胞系中miR-182启动子的甲基化情况。如图3所示:MSP结果显示5种肺癌细胞系中均存在不同程度的甲基化,其中,A549细胞中miR-182启动子区域甲基化程度最高,其余4株细胞系中miR-182也都存在不同程度的甲基化。PCR产物经DNA测序分析,证实扩增产物为存在甲基化的miR-182启动子区(图4)。
2.4 5'-Aza-dC处理后不同肺癌细胞株中miR-182表达变化为了进一步探讨DNA甲基化对miR-182表达的影响,我们应用甲基转移酶抑制剂5'-Aza-dC处理细胞72 h后,realtime PCR检测miR-182的表达水平,以DMSO处理作为对照组。结果显示:与对照组相比,在10 μM 5'-Aza-dC处理72 h后,A549、95C、95D、L9981和NL9980肺癌细胞株中miR-182的表达均提高(分别为P<0.001、P<0.01、P<0.01、P<0.05和P<0.001),其中A549细胞中miR-182的表达提高了406倍,最为明显(图5)。这些结果表明,启动子区的DNA甲基化可能抑制miR-182的表达,而DNA甲基转移酶抑制剂5'-Aza-dC处理则能提高miR-182的表达。
3 讨论
DNA甲基化是指生物体在DNA甲基转移酶(DNA methyltransferase, DNMT)的催化下,以S-腺苷甲硫氨酸(S-adenosyl methionine, SAM)为甲基供体,将甲基转移到特定的碱基上的过程,是哺乳动物遗传外修饰的重要的调控方式。研究[16]表明,DNA异常甲基化与肿瘤的发生、发展、细胞癌变有着密切的联系。启动子区域CpG岛的高甲基化是抑瘤基因沉默、促凋亡基因失活的主要方式之一。因此,改变DNA甲基化状态,可以诱导因甲基化失活的基因重新表达[17]。5'-Aza-dC是一种DNA甲基转移酶1(DNA methyltransferas 1, DNMT1)的抑制剂,通过与DNA甲基转移酶的共价结合,抑制DNA甲基转移酶的活性,从而实现去甲基化功能。应用5-Aza-dC可以使部分沉默的重要基因去甲基化而再激活,恢复其正常功能。因此,5'-Aza-dC已被用于III期临床试验,用于早期非小细胞肺癌及晚期三阴乳腺癌的临床治疗。

图3 不同肺癌细胞中miR-182启动子区甲基化的MSP检测Fig3 MSP assay for miR-182 promoter in different lung cancer cell lines

图4 A 5 4 9细胞中miR-182启动子MSP产物测序分析Fig4 The MSP result analysis of miR-182 promoter by DNA sequencing in A549 cells

图5 5’-Aza-dC影响肺癌细胞中miR-182表达Fig5 The analysis of miR-182 expression by real-time PCR in human lung cancer cell lines after 5’-Aza-dC treatment.*P<0.05, **P<0.01, ***P<0.001.
我们的研究结果证实,miR-182启动子区在肺癌细胞株中普遍存在异常的甲基化,特别是在高转移性肺癌细胞株A549中,存在高甲基化状态,经DNA甲基转移酶抑制剂5'-Aza-dC处理后,A549及其它肺癌细胞中miR-182的表达水平均提高,MSP及基因测序分析亦进一步证实这些细胞中存在异常甲基化修饰。因此,在肺癌细胞中,miR-182的表达受异常甲基化调控。
MiR-182在肿瘤的发生发展中起着重要作用,比如,在黑色素瘤细胞中,miR-182可能通过抑制FOXO3和MiTF,促进肿瘤细胞的侵袭和转移[5],而我们的研究发现,在高度转移性的肺癌细胞株A549中,miR-182为高度甲基化,从而提示在肺癌细胞中miR-182的功能可能有别于黑色素瘤细胞,可能与抑制肺癌侵袭和转移有关,这与Zhang等[13]的研究报道相一致。这些现象提示miR-182在不同肿瘤或细胞类型中由于其靶基因不同,其作用也不尽相同。miR-182在肺癌细胞株中的异常表达受到DNA甲基化的调控,其作用机制还有待进一步研究。
