罗布麻愈伤组织诱导和植株再生研究
2015-08-26李瑶黄国庆孙尧王雷吴琼黑龙江省科学院高技术研究院哈尔滨150090
李瑶,黄国庆,孙尧,王雷,吴琼(黑龙江省科学院高技术研究院,哈尔滨150090)
罗布麻愈伤组织诱导和植株再生研究
李瑶,黄国庆,孙尧,王雷,吴琼
(黑龙江省科学院高技术研究院,哈尔滨150090)
取罗布麻(Apocynum venetum L.)无菌苗中的叶、茎作为外植体,研究了不同激素组合对愈伤组织及不定芽分化的影响。结果表明:在多个激素浓度组合的培养基中,罗布麻的叶和茎的愈伤组织诱导率均能够达到100%;但进行不定芽分化时,茎来源的愈伤组织在不同激素配比的培养基中有不定芽分化,最高分化率可达到56.7%。因此,在构建罗布麻再生体系时,选择罗布麻茎段作为外植体,在培养基MS+6-BA 1.0m g/L+NAA 0.2m g/L中、光强2 500lx,每天光照时间12h、25±3℃的培养条件下诱导愈伤组织,并转接到同样的培养基中进行不定芽分化的诱导,最后在1/2MS培养基中加入适量的NAA进行生根培养。
罗布麻;愈伤组织;不定芽分化
罗布麻(Apocynum venetum L.),别称红麻、茶叶花、红柳子等,为夹竹桃科罗布麻属植物[1],在我国新疆、青海、甘肃、宁夏、内蒙古、山东等省区均有分布[2-3]。罗布麻是一种抗逆性极强的植物,适于多种气候和土质,可生长于河岸、海滨盐地、干旱内陆地等。罗布麻的纤维价值极高,它的茎秆纤维可供纺织、造纸[4-5]。除此之外,罗布麻还有很高的药用价值,它含有多种有效的化学成分,根、茎、花、叶均可入药,具有降血脂、降血压、抗炎、抗过敏等多种效用[6-7]。罗布麻是一种集盐碱地绿化、纤维价值、药用价值于一体的野生优良水土保持植物,对于荒漠化的治理具有积极意义[8]。
野生状态下的罗布麻种子繁殖成活率不高、生长迟缓、成林时间较长[9]。而且,野生罗布麻的质量不稳定[10]。在取材时,对其生长的土壤环境也会造成深层次的破坏[11]。目前,也曾有人工栽培的报道,但在实际操作中受到环境因素的限制,且种子繁殖技术出苗率低,生长周期长[12]。鉴于此,本研究以罗布麻幼苗的茎段、叶片作为外植体,探讨愈伤组织诱导、不定芽再生及生根诱导的最佳条件,为种苗的快速繁殖及进一步的转基因操作奠定基础。
1 材料与方法
1.1材料
1.1.1试验材料
吉林省采集的野生罗布麻种子,消毒后接种于MS培养基中,所得无菌苗的幼嫩茎段作为外植体。
1.1.2培养基
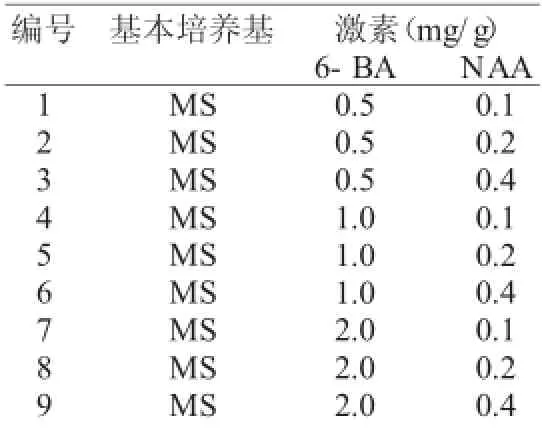
表1 用于罗布麻组织培养的培养基Tab.1 Tissue culture m edium s fo r apocynum
罗布麻为耐盐植物,选择高盐培养基MS培养基作为构建罗布麻再生体系的基本培养基[13]。添加生长素NAA(0.1~0.4mg/g)与细胞分裂素6-BA(0.5~2.0mg/g)配合诱导愈伤组织及不定芽的分化,具体激素组合见表1[14-15]。采用1/2MS培养基并添加生长素NAA(0.1~0.4mg/g)进行生根培养的诱导(见表2)[16-17]。
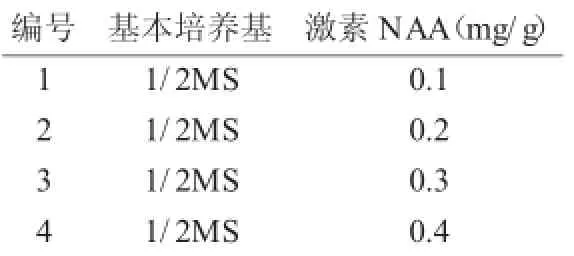
表2 生根诱导培养基Tab.2 Root induction cultu re medium
1.2方法
1.2.1无菌苗的获得
选取成熟饱满的罗布麻种子,放于10%的次氯酸钠溶液中浸泡消毒5m in,用无菌水冲洗5~6次,接种于MS培养基上,每瓶5个,置于光强2 500lx、光照时间16h,温度25±3℃的光照培养箱中进行培养,待无菌苗长至7cm左右时,取其茎段用于罗布麻再生体系的构建。
1.2.2愈伤组织诱导
取无菌苗的茎段及叶片,剪成一定大小(茎段0.5cm左右、叶片0.04cm2左右),接种于表1中相应的各培养基中进行愈伤组织的诱导。每瓶接种10个外植体,每个浓度接种3瓶共计30个,培养条件为光强2 500lx、光照时间12h,温度25±3℃[14]。
1.2.3不定芽的分化
待愈伤组织增殖至直径约0.5cm时,挑取新鲜、质地紧密的愈伤组织转接到表1的各培养基中,进一步进行不定芽的诱导。每瓶接种10个外植体,每个浓度接种3瓶共计30个,培养条件为光强2 500lx、光照时间12h,温度25±3℃[14]。
1.2.4不定根的诱导
待罗布麻分化出不定芽后,取芽丛中高约3~4cm的不定芽剪下,接种于生根培养基上进行生根诱导。每瓶接种7个或8个不定芽,每个浓度4瓶共计30个,培养条件为培养条件为光强2 500lx、光照时间12h,温度25±3℃[18]。
1.2.5结果统计
愈伤组织诱导率(%)=愈伤块数/接种个数× 100;不定芽分化率(%)=出芽愈伤块数/愈伤个数×100;不定根诱导率(%)=生根个数/不定芽个数× 100。
2 结果与分析
2.1愈伤组织诱导结果
MS培养基添加生长素NAA与细胞分裂素6-BA诱导愈伤组织。在激素施用的浓度范围内,罗布麻茎段及叶片均有愈伤组织发生。外植体接种3~4d后,叶片颜色变淡、拱起,茎段出现节状增粗、失绿;7d后,颗粒状愈伤组织从切面处长出,继而长满外植体表面,使茎段及叶片发生不同程度的膨大(见图1)。罗布麻茎段在9个不同激素组合梯度培养基中,有6种激素组合的诱导率达到了100%,具体结果如表3所示。罗布麻叶片尽在编号4的激素组合下诱导率达到100%,具体结果见表4。由此可知,罗布麻的茎和叶均可作为外植体材料诱导愈伤组织,其中,使用茎段诱导愈伤组织效果更佳。

图1 愈伤组织Fig.1 Callus

表3 罗布麻茎段诱导愈伤组织结果统计Tab.3 Apocynum stem callus statistical resu lts

表4 罗布麻叶片诱导愈伤组织结果统计Tab.4 Apocynum leaves callus sta tistical results
2.2不定芽分化结果
挑取愈伤组织进行不定芽分化诱导培养,10d后,有红色不定芽从茎段的愈伤组织上分化,而叶片的愈伤组织则未见不定芽分化。5d后,不定芽开始形成芽丛(见图2)。不定芽分化诱导的具体结果如表5所示。由此可知,茎段产生的愈伤组织,在培养基MS+6-BA 1.0mg/L+NAA 0.2mg/L中,分化率最高,可达到56.7%。

图2 茎愈伤组织上的不定芽Fig.2 Adventitious buds from callus o fstem
2.3生根诱导结果
不定芽生根培养是在1/2MS培养基上加入NAA进行诱导。在4个NAA供试浓度下,不定根的发生率均可达到100%。不定根健壮,长势较好。
根据试验结果可知,在构建罗布麻再生体系时,可选择罗布麻茎段作为外植体,在培养基MS+6-BA 1.0mg/L+NAA 0.2mg/L中、光强2 500lx,每天光照时间12h、25±3℃的培养条件下诱导愈伤组织,并转接到同样的培养基中进行不定芽分化的诱导,最后在1/2MS培养基中加入适量的NAA进行生根培养。
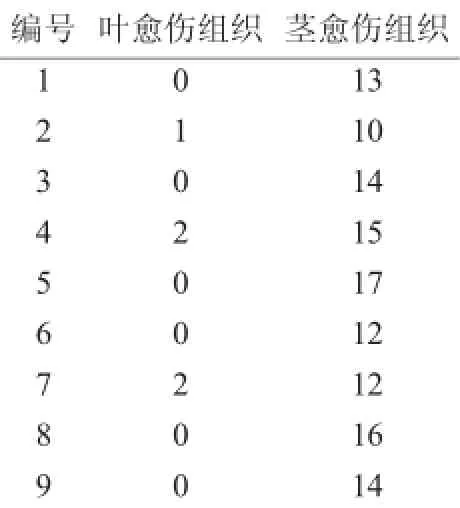
表5 罗布麻茎段诱导不定芽分化结果统计Tab.5 The statistical results of induced apocynum stem bud differentiation
3 结语
本试验采用罗布麻组织培养中较为常用的MS作为基础培养基,添加不同组合和配比的生长素NAA及细胞分裂素6-BA,以罗布麻无菌苗的茎段及叶片为外植体进行罗布麻植株再生的研究。根据罗布麻愈伤组织诱导、不定芽分化及不定根诱导的试验结果,可以得出构建罗布麻再生体系的最佳条件,即选择罗布麻茎段作为外植体,在培养基MS+6-BA 1.0mg/L+NAA 0.2mg/L中、光强2 500lx,每天光照时间12h、25±3℃的培养条件下诱导愈伤组织,并转接到同样的培养基中进行不定芽分化的诱导;生根培养可选择在1/2MS培养基中加入适量的NAA。在这一过程中,罗布麻愈伤组织诱导率可达到100%,不定芽分化率可达到56.7%,不定根的诱导率可达到100%。由此可知,罗布麻愈伤组织诱导及生根诱导相对较容易,提高不定芽分化率是建立高效再生体系的关键。
[1]喻春明.罗布麻的概况及开发利用前景[J].中国麻作,1996,18(3):46-47.
[2]张绍武.我国罗布麻分布区的地理区划[J].西北植物学报,2002,22(7): 1-5.
[3]张秀玲.山东罗布麻的分布及开发利用[J].中国野生植物资源,2004,(05):28-29.
[4]郑丽莎.罗布麻纤维抗菌机理研究[J].检验检疫学刊,2009,(03):13-16.
[5]张卫明,肖正春,顾龚平.新疆罗布麻生态类型及其纤维品质研究[J].中国野生植物资源,2006,25(4):33-37.
[6]侯晋军,韩利文,杨官娥,等.罗布麻叶化学成分和药理活性研究进展[J].中草药,2006,37(10):7-9.
[7]虞颖映,邵建忠,王海明.罗布麻茶对心血管系统的生物学效应研究[J].同济大学学报(医学版),2006,27(4):40-43.
[8]铁桂春,刘红献.野生罗布麻特性及利用价值[J].草叶科学,2006,23(6): 46-47.
[9]陈凤清,丛建民,林碧云,等.野生和人工种植罗布麻种子形态及解剖特征比较[J].湖北农业科学,2013,52(15):3559-3561.
[10]周裔彬.罗布麻叶的研究进展[J].安徽农业大学学报,2008,(04):619-622.
[11]马艳,闵义,陈小文,等.罗布麻愈伤组织诱导及植株再生[J].西北植物学报,2008,28(8):1580-1585.
[12]魏书琴.罗布麻种子的组织培养[J].湖北农业科学,2010,49(10): 2353-2355.
[13]刘晓晨,曹君迈,陈彦云,等.罗布麻外植体的筛选及愈伤组织诱导[J].黑龙江农业科学,2012,(09):24-26.
[14]陈敏敏,张卫明,赵金凤,等.资源植物罗布麻的愈伤组织诱导和植株再生研究[J].武汉植物学研究,2010,28(3):347-352.
[15]陈彦云,曹君迈,李国旗,等.罗布麻立体培养及快繁技术的研究[J].生物技术,2006,16(1):72-75.
[16]马淼,陆嘉惠,周玲玲,等.资源植物罗布麻的茎段组织培养与植株再生[J].中草药,2001,32(9):841-843.
[17]郝玉蓉,胡瑞林,李明世.罗布麻子叶、下胚轴的组织培养和植株再生[J].植物生理学通讯,1986,(03):39.
[18]刘小锐,计巧灵.罗布麻组织培养及发状根的诱导[J].中国麻业科学,2009,31(6):344-348.
Research on Apocynum Callus Induction and Plant Regeneration
LIYao,HUANGGuo-qing,SUNYao,WANGLei,WUQiong
(InstituteofAdvanced Technology,Heilongjiang Academy ofSciences,Harbin 150090,China)
Thispaper takes the leaves,stemsofapocynum ofno vaccine asexplants to study the effectof different hormones on callus and adventitious bud differentiation.The results showed that a combination of hormone concentrations inmultiplemedia,callus induction rateofapocynum leaves and stems could reach 100%;butwhen adventitious buds,stems sources callus bud differentiation in culture has different hormone combinations,the highestdifferentiation rate reached 56.7%.Therefore,when constructing apocynum regeneration system,apocynum stem segmentswere selected asexplants,in themedium MS+6-BA 1.0mg/L+NAA 0.2mg/L,the light intensity 2500lx,day light time 12h,25 callus culture conditions±3℃and transferred to the samemedium to induce differentiation ofadventitiousbuds.In themoderate NAA addition of1/2MSm medium,itwas cultured by rooting.
Apocynum;Callus;Adventitiousbuds.
S563.7
A
1674-8646(2015)05-0015-03
2015-03-09
李瑶(1987-),女,黑龙江哈尔滨人,硕士研究生,工程师,主要从事植物基因工程研究。
