适用于不同产地半夏药材的特异性引物PCR鉴定分析方法
2015-08-26陈蓉吴成丽邓赟卞金辉
陈蓉,吴成丽,邓赟,卞金辉
适用于不同产地半夏药材的特异性引物PCR鉴定分析方法
陈蓉1,吴成丽1,邓赟2,卞金辉2
目的:通过特异性引物PCR技术,建立不同产地半夏药材通用的聚合酶链式反应(PCR)鉴别法。方法:提取不同产地半夏药材的基因组DNA,利用特异性引物对基因组DNA进行扩增,通过琼脂糖凝胶电泳对扩增结果进行分析。结果:所设计的引物能够特异性地扩增出半夏的目的DNA,并适用于全国9个主要不同产地半夏药材的检测。结论:该方法具有较强的特异性和普适性,适用于半夏药材的真伪性鉴别。
半夏;特异性引物;PCR
半夏为天南星科植物半夏Pinellia ternata (Thumb.)Breit.的干燥块茎,中医认为半夏具有降逆止呕,燥湿化痰,消痞散结的功效,目前被应用于藿香正气水、藿香正气液等藿香正气系列产品中,具有良好的临床疗效[1,2]。由于商业需求量大,加之巨大经济利益的驱使,目前中药市场上充斥着大量半夏的混伪品如虎掌半夏、水半夏、天南星[3]等。由于天南星科植物缺乏特征的理化特性,利用传统的化学分析方法难以鉴别半夏药材及其混伪品。随着分子生物学技术的发展,李萍等利用RFLP技术成功地将川贝母和其他贝母类药材进行了鉴别[4,5],Peng Xiaoxiao等建立了PCR-RFLP鉴别金银花的DNA分子鉴定方法[6],《中国药典》也收录了乌梢蛇和蕲蛇的特异性引物聚合酶链式反应(PCR)鉴别法[7]。基于此,本文建立了半夏药材的特异性引物PCR鉴定法,并对来自全国各主要半夏产地的半夏药材进行了分析鉴定。
1 材料和方法
1.1材料
不同产地的半夏药材及其混伪品虎掌半夏、水半夏、天南星由太极集团提供并鉴定;半夏对照药材购自中国药品生物制品鉴定所;DNA聚合酶购自北京全式金生物技术有限公司,EasyTaq系列,目录号AP111; Roche dNTP 购自成都奥克生物技术有限公司;核酸染料购自北京百泰克公司,GELVIEW系列,目录号EP1501;引物由上海生工生物工程公司合成并纯化。
1.2 基因组DNA的提取
将半夏药材用一次性手术刀片,切去表面易被污染部分,刮取中间干净部分并碾成粉末,照CTAB法[8]提取,置4℃冰箱备用;同法提取半夏混伪品及半夏对照药材DNA作为聚合酶链式反应模板。
1.3引物设计
从genbank下载半夏、虎掌半夏、水半夏、天南星的ITS序列,序列号分别为:AF469036.1、AF469040.1、AM777883.1和JF975897.1同时利用Mega软件对序列进行比对分析,选取半夏特异性位点,按照引物设计黄金法则设计引物为BP:5’-GGGAGACTCCCGACGATCGCA,BRP:5-GCCGCACGGACGGATGGAT。
1.4聚合酶链式反应
将提取的DNA模板进行PCR扩增,扩增采用50 μL体系,其中包括10×Taq buffer 5μL; Taq酶2.5个单位;正向引物0.25μM; 反向引物0.25μM;dNTPs 0.2 mM;基因组DNA模板1μL;灭菌水补足50μL。PCR反应程序:95℃解链3分钟;94℃变性30秒,62℃复性30秒,72℃延伸30秒,循环30次;72℃延伸5分钟,得扩增样品。
1.5PCR扩增产物检测
取扩增产物5 μL加1μL 上样缓冲液于2%琼脂糖凝胶电泳7分钟后,在琼脂糖凝胶成像系统中检测。
2 实验结果
所设计的特异性引物只能扩增出半夏的特异性条带,而其混伪品种在相同位置均没有扩增条带,见图1。

图1 引物特异性考察
半夏引物对全国9个半夏产地的半夏药材均能扩增出目标条带,并与半夏对照药材在相同位置具有相同的条带,见图2。
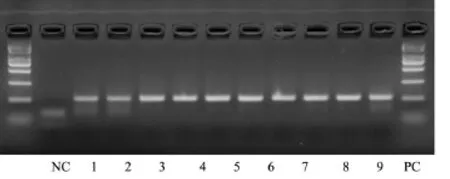
图2 不同产地药材扩增结果
3 讨论
实验结果表明所设计的半夏引物能且仅能扩增出半夏特异性目的条带,说明该引物具有高度特异性,可以从半夏及其混伪品种中特异性的检测出半夏的存在。全国9个半夏产地的半夏药材均能扩增出目的DNA条带,说明该引物具有良好的普适性,对各地区所产的半夏药材均能成功检出。半夏药材作为大宗常用药材,由于其缺乏特征的理化性质,目前对其质量控制还没有特异性的方法,仅凭经验鉴别误差大,人力资源有限,本文提供了一种能够快速准确鉴定半夏药材真伪性的方法,如能加入药典,广泛应用,对保证中药临床用药的安全性和有效性,以及推进中药的现代化、国际化都具有非常重要的意义。
[1]卿玉玲,孙克宏,郑飞鸣,等.藿香正气液治疗胃肠型感冒临床观察[J].重庆医学,2006,35(06):548.
[2]伍韶容.藿香正气液治疗小儿胃肠型感冒的疗效观察[J].北方药学,2015,12(03):89.
[3]唐晓晶.DNA分子标记在中药材鉴定中的应用研究[D].北京:中国中医科学院,2006.
[4]Wang C. Z.,Li P.,Ding J. Y.,et al.Simultaneous identifi cation of Bulbus Fritillariae cirrhosae using PCR-RFLP analysis[J]. Phytomedicine,2007,14(9):628.
[5]徐传林,李会军,李萍,等.川贝母药材分子鉴定方法研究[J].中国药科大学学报,2010,41(03):226.
[6]Peng X.,Li W.,Wang W.,et al.Identification of Lonicera japonica by PCR-RFLP and allele-specific diagnostic PCR based on sequences of internal transcribed spacer regions[J]. Planta Med,2010,76(5):497.
[7]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2010:72,349.
[8]Chen Rong,Dong Juan,Cui Xin,et al.DNA based identification of medicinal materials in Chinese patent medicines[J].Sci. Rep.,2012,2.
(责任编辑:蒋淼)
A general detection method of Banxia from different habitats based on specifi c primers PCR
CHEN Rong1, WU Chengli1, DENG Yun2, BIAN Jin-hui2
(1. School ofEthnomedicine, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, Sichuan;2. School of Pharmacy, Chengdu University of Traditional Chinese Medicine; Key Laboratory of Standardization for Chinese Herbal Medicine, Ministry of Education; National Key Laboratory Breeding Base of Systematic Research, Development and Utilization of Chinese Medicine Resources, Chengdu 611137, Sichuan)
Objective: Establish a general detection method of Banxia from different habitats based on specifi c primers PCR. Method: Genetic DNA of Banxia from different habitats was extracted and amplified by specific primers. The PCR products were analyzed by agarose gel electrophoresis. Result: The target DNA of Banxia was successfully detected in the samples from 9 habitats. Conclusion: This method is specifi c and can be generally used in the identifi cation of Banxia.
Banxia; specifi c primers; PCR
R 284.1
A
1674-926X(2015)06-005-02
四川省教育厅理工科一般项目(14ZB0077);成都中医药大学科技发展基金(ZRQN1434);四川省科技厅项目(2014SZ0071-4)
1.成都中医药大学民族医药学院,四川 成都611137 2.成都中医药大学药学院 中药材标准化教育部重点实验室 四川省中药资源系统研究与开发利用重点实验室省部共建国家重点实验室培育基地,四川成都 611137
陈蓉(1987-),女,硕士,助教,主要从事中药DNA分子鉴定研究Tel:028-61800094Email:CDTCM_CR@163.com
卞金辉(1975-),男,副教授,主要从事中药药效物质基础及质量标准研究Tel:028-61800127Email:bianjinhui1975@126.com
2015-09-12
