巴马小型猪T2DM模型胰岛素抵抗与同型半胱氨酸的关系
2015-08-25邹迪莎黄漓莉刘晓玲莫如芬何永玲
于 健,邹迪莎,叶 瑶,黄漓莉,刘晓玲,莫如芬,杨 帆,胡 璟,何永玲
(1.桂林医学院附属医院 内分泌科; 2.桂林医学院研究生院; 3.桂林医学院附属医院 检验科,广西 桂林 541001)
巴马小型猪T2DM模型胰岛素抵抗与同型半胱氨酸的关系
于 健1,邹迪莎2,叶 瑶2,黄漓莉1,刘晓玲1,莫如芬1,杨 帆1,胡 璟1,何永玲3
(1.桂林医学院附属医院 内分泌科; 2.桂林医学院研究生院; 3.桂林医学院附属医院 检验科,广西 桂林 541001)
目的 应用高脂高糖饮食联合链脲佐菌素(STZ)构建巴马小型猪2型糖尿病(T2DM)模型,并探讨T2DM小型猪胰岛素抵抗(IR)与同型半胱氨酸(homocysteine,Hcy)的关系。方法 选用健康雄性巴马小型猪10只,随机分为两组:对照组(n=5),喂养普通饲料;糖尿病模型组(n=5),喂养高脂高糖饲料,上述两组共喂养10个月。11个月初糖尿病模型组腹腔注射STZ 100 mg/kg,1周后重复1次;对照组腹腔注射等剂量柠檬酸-柠檬酸钠缓冲液。观察两组小型猪体重、空腹血糖(FPG)、空腹胰岛素(FINS)及血浆Hcy水平,同时计算胰岛素抵抗指数(HOMA-IR)。结果 高脂高糖饲料喂养10个月后,模型组小型猪体重、FPG、FINS及HOMA-IR高于对照组(P<0.01);与对照组相比STZ给药后(12个月末实验结束时),模型组的FPG进一步升高,FINS水平明显下降(P<0.01)。模型组Hcy高于对照组(P<0.01),且HOMA-IR与Hcy呈正相关(r=0.906,P<0.05)。结论 T2DM小型猪Hcy升高与IR密切相关。
高脂高糖饮食;链脲佐菌素;2型糖尿病;巴马小型猪;同型半胱氨酸
目前2型糖尿病(T2DM)确切的发病机制仍未明确,其中胰岛素抵抗(IR)是其发病特征,近年来研究认为,高同型半胱氨酸(Hcy)血症是心脑及外周血管病变的独立危险因素,Hcy水平与糖尿病、IR密切相关[1-2]。链脲佐菌素(streptozotocin, STZ)能够选择性地破坏某些种属动物胰岛的β细胞,导致糖尿病的发生。膳食诱导联合小剂量STZ构建的糖尿病模型已被广泛应用[3-4]。本研究通过高脂高糖饮食联合STZ构建巴马小型猪T2DM模型,并检测其Hcy水平,旨在探讨巴马小型猪T2DM模型IR与Hcy的关系。
1 材料和方法
1.1 主要药品和仪器
STZ购自美国Sigma公司;Hcy试剂盒购自北京九强生物技术股份有限公司(批内变异系数CV≤5.0%,批间变异系数CV≤10%);胰岛素放射免疫分析试剂盒购自北京北方生物技术研究所(批内变异系数CV<10%,批间变异系数CV<15%);胰岛素单克隆抗体购自福州迈新生物技术开发有限公司;猪油、蔗糖、普通饲料均购自桂林市漓源粮油饲料有限责任公司;蛋黄粉购自南通康德生物制品有限公司。瑞士罗氏公司7600 型全自动生化分析仪。
1.2 实验动物
选择健康雄性广西巴马小型猪10头,2~3月龄,体重10~20 kg。所有小型猪均给予常规饮水,每日投食3次,饲养条件为室温18~25 ℃,每日光照约12 h,相对湿度50%~80%,有持续空气交换。小型猪适应性喂养1周后,随机分为两组:对照组(n=5),普通饲料喂养;糖尿病模型组(n=5),高脂高糖饲料喂养(高脂高糖饲料配方为:蔗糖37%、猪油10%、胆固醇2%、普通饲料51%)。实验为期12个月,实验过程中对动物的处置均符合动物伦理学标准。
1.3 实验方法
1.3.1 T2DM模型的构建:根据动物体重称取适量STZ溶于0.1 mol/L柠檬酸-柠檬酸钠缓冲液(pH 4.2~4.5)中,浓度为10 g/L,禁食空腹注射STZ溶液:11个月初给予模型组小型猪腹腔注射STZ 100 mg/kg,1周后,重复上述剂量1次。对照组小型猪腹腔注射等剂量柠檬酸-柠檬酸钠缓冲液。成模标准:参照1999年世界卫生组织(WHO)糖尿病诊断标准:具有糖尿病典型症状(多尿、多饮、多食及消瘦),且空腹血糖≥7.0 mmol/L或随机血糖≥11.1 mmol/L。如无糖尿病症状,则需空腹和餐后血糖同时达到上述标准时,才可诊断糖尿病。
1.3.2 空腹血糖、胰岛素、Hcy水平检测:禁食过夜的小型猪前腔静脉抽血,血糖采用葡萄糖氧化酶法检测;血浆Hcy水平采用同型半胱氨酸测定试剂盒(酶法)检测;胰岛素放射免疫分析试剂盒检测胰岛素(INS)水平。胰岛素抵抗指数(HOMA-IR)的计算:HOMA-IR =空腹血糖(FPG)×空腹胰岛素(FINS)/22.5。
1.3.3 胰腺组织HE染色及胰岛β细胞免疫组化染色:实验结束时(12个月末),将禁食过夜的小型猪采用速眠新(0.2~0.25 mL/kg)肌肉注射,联合10%水合氯醛(2 mL/kg)腹腔注射麻醉,股动脉放血处死,取胰腺组织,常规固定、脱水、石蜡包埋、切片, HE 染色,光镜下观察。并取胰腺组织石蜡切片,胰岛素单克隆抗体作免疫组化染色(按试剂盒操作步骤进行)。
1.4 统计学方法
2 结 果
2.1 两组小型猪一般情况比较及体重变化比较
对照组小型猪精神状况良好,毛发光泽,生长良好。糖尿病模型组均成模,成模小型猪毛发粗糙无光泽,精神萎靡,并出现多尿、多饮、多食及体重下降等糖尿病症状。高脂高糖饲料喂养10个月后,模型组小型猪的体重(86.32±5.86)kg较对照组小型猪的体重(41.54±4.54)kg明显升高,差异有显著性意义(t=15.672,P<0.01)。
2.2 高脂高糖饮食对小型猪FBG、FINS及HOMA-IR的影响
高脂高糖饲料喂养10个月后,模型组小型猪的FBG、FINS及HOMA-IR较对照组均明显升高,差异有显著性意义(P<0.01),见表1。

表1 高脂高糖饮食对小型猪FPG、FINS及HOMA-IR的影响Tab 1 Time course of FPG, FINS and HOMA-IR in high fat/high carbohydrate and normal diet fed minipigs ±s)
2.3 STZ对小型猪FPG、FINS的影响
11个月初模型组小型猪腹腔注射不同剂量STZ后,实验结束时(12个月末)与对照组比较,模型组小型猪FPG水平明显升高,FINS水平明显降低,差异有显著性意义(P<0.01),且模型组小型猪FPG稳定维持在9.8~15.6 mmol/L水平,见表2。

表2 STZ注射不同时间点两组小型猪FPG及FINS水平比较Tab 2 Comparison of FPG and FINS at different time of STZ injection between the control group and model group ±s)
2.4 两组小型猪胰腺组织HE染色结果比较
模型组镜下可见胰岛整体形态萎缩,边缘不规整,细胞排列紊乱,胰岛及胰岛内细胞数目均减少,部分细胞核形状不规则,胞浆内呈空泡变性(如图1A箭头所示)。对照组胰岛呈圆形或椭圆形,边缘规整,与腺体紧密结合在一起,胰岛及胰岛内细胞数目多,胞核清晰且胞浆丰富,整个胰腺组织结构基本正常(图1B)。
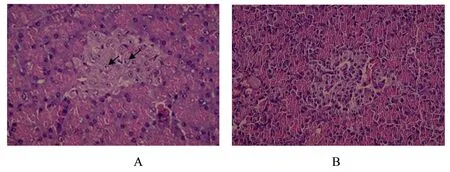
图1 小型猪胰腺组织HE染色结果(HE ×400)Fig 1 Hematoxylin eosin staining of pancreas in two groups (HE ×400)
2.5 两组小型猪胰岛β细胞免疫组化染色结果比较
T2DM成模组每视野下(×200)可见散在数个胰岛细胞团,细胞排列紊乱(图2A),高倍镜下(×400)胰岛β细胞团整体形态结构破坏,胞质内棕黄色颗粒明显减少。对照组每视野下(×200)可见多个胰岛细胞团,细胞排列整齐(图2B),高倍镜下(×400)胰岛β细胞团整体形态完整,占胰岛细胞绝大部分,胞质内棕黄色颗粒着色深且含量丰富。
2.6 T2DM小型猪Hcy水平变化及与HOMA-IR相关性分析
实验结束时,模型组Hcy(16.40±2.73)μmol/L高于对照组(9.68±2.99)μmol/L(t=3.712,P=0.006)。Pearson相关分析显示,模型组HOMA-IR与Hcy呈正相关(r=0.906,P=0.034)。

图2 小型猪胰岛β细胞免疫组化染色比较 (×200)Fig 2 Immunostaining of pancreatic islet β cells in two groups (×200)
3 讨 论
目前糖尿病的研究所采用的动物多选用大鼠、小鼠、兔等动物,它们的功能器官和人类有一定差距。猪是最接近人类的模式动物,猪在解剖结构、生理、代谢、肥胖倾向性及种类习性方面,其表现型与人类高度相似,而且它与人类在遗传学上也具有高度相似性,特别是遗传决定的代谢相似性,这使得猪成为研究人类肥胖、糖尿病及其并发症等疾病的最佳模式动物。其中小型猪动物模型已广泛运用于心血管系统、呼吸系统、消化系统、糖尿病、器官移植、皮肤烧伤整形、口腔疾病及手术外科等医学领域的研究[5-7]。
本实验首先采用高糖高脂饲料喂养小型猪,结果发现,模型组小型猪出现明显肥胖,胰岛素水平逐渐升高,并产生IR,表现T2DM的病理特征,与Torres等[8]研究结果一致。为进一步诱导典型T2DM模型,11个月初腹腔注射STZ,结果发现:模型组在高糖高脂饮食基础上联合多次STZ注射(STZ 100 mg/kg×2)可以成功构建T2DM模型,成模小型猪均表现出典型“三多一少”DM症状,且FPG水平显著上升,胰岛素水平下降。胰腺病理切片及免疫组化均提示,成模组胰岛β细胞破坏,数目明显减少。结果提示,应用高脂高糖喂养联合STZ注射可以成功构建小型猪T2DM模型,与既往研究结果一致[9]。
研究发现,糖尿病患者血浆Hcy水平升高[1],Gallistl 等[10]研究发现,肥胖受试者血浆Hcy与体重指数、脂肪含量、内脏脂肪比例、胰岛素水平呈正相关,进一步多元回归分析发现IR是影响Hcy的主要因素。Fonseca等[11]应用葡萄糖钳夹试验研究了胰岛素对T2DM患者和正常人血Hcy水平的影响, 输注胰岛素后, 正常人血Hcy显著下降, 而伴IR的T2DM患者,无论给予大、小剂量的胰岛素, 血Hcy都无变化,且高Hcy与IR独立正相关。还有研究显示, 高同型半胱氨酸血症模型小鼠造模4周后,可以观察到任意血糖明显升高和胰岛素敏感性显著下降;同型半胱氨酸处理的脂肪细胞,对胰岛素刺激下的葡萄糖摄取能力亦明显降低[12]。高脂诱导的IR与大鼠血浆Hcy水平升高有关,吡格列酮可以降低血浆Hcy浓度,减轻IR[13]。本文结果表明,与对照组比较,模型组小型猪存在明显IR,Hcy水平升高,且Hcy与IR呈正相关,与其他研究相一致[2]。提示T2DM模型组小型猪IR可能是Hcy水平升高的重要原因。胰岛素作为参与合成代谢的激素,对Hcy代谢具有重要调节作用,IR导致Hcy的机制尚不明确,可能的机制是T2DM存在外围组织胰岛素作用障碍,对Hcy 调节作用下降,引起继发性的Hcy代谢障碍;还有研究发现,IR导致了Hcy转硫和甲基化通路的两个关键酶胱硫醚B合成酶和亚甲基四氢叶酸还原酶活性降低,进而抑制肝细胞和肾小管上皮细胞胱硫醚β合成酶的表达[14-15],由于上述Hcy的表达[14-15],Hcy 代谢过程中相关酶合成减少,Hcy 在体内堆积,形成高Hcy 血症。
综上所述,采用高脂高糖饲料联合STZ可以成功诱导巴马小型猪T2DM动物模型,该模型具有与人类T2DM相似的生化及病理特征,该方法操作简便、易于掌握,且具有较好的安全性。模型组小型猪Hcy水平升高与IR有关。因此, 在以IR为主要病理生理机制的T2DM患者中应重视检测血浆Hcy水平,关于Hcy在T2DM IR发病机制中作用,还需进一步深入的研究。
[1] Liu YN, Jung JH, Park H, et al. Olive leaf extract suppresses messenger RNA expression of proinflammatory cytokines and enhances insulin receptor substrate 1 expression in the rats with streptozotocin and high-fat diet-induced diabetes[J]. Nutr Res,2014,34(5):450-457.
[2] Feigh M, Hjuler ST, Andreassen KV, et al. Oral salmon calcitonin enhances insulin action and glucose metabolism in diet-induced obese streptozotocin-diabetic rats[J]. Eur J Pharmacol,2014,737C:91-96.
[3] 秦怀波,陈云,俞丽萍,等.糖尿病患者血糖和血脂水平改善与血浆同型半胱氨酸水平的相关性[J].中国糖尿病杂志,2011,19(2):123-125.
[4] 王庭俊,王中心,杨芳,等.糖尿病患者肥胖及胰岛素抵抗与血浆同型半胱氨酸的关系[J].齐齐哈尔医学院学报,2010,31(2):180-181.
[5] He B, Musk GC, Mou L,et al.Laparoscopic surgery for kidney orthotopic transplant in the pig model[J].JSLS, 2013,17(1):126-131.
[6] Wolf E, Braun-Reichhart C, Streckel E, et al. Genetically engineered pig models for diabetes research[J].Transgenic Res, 2014, 23(1):27-38.
[7] Sheu SY, Wang WL, Fu YT, et al. The pig as an experimental model for mid-dermal burns research[J]. Burns, 2014,9(14):164-168.
[8] Torres-Rovira L, Astiz S, Caro A, et al. Diet-induced swine model with obesity/leptin resistance for the study of metabolic syndrome and type 2 diabetes[J].Scientific World J, 2012, 5(2): 1-8.
[9] 肖国华,张素君,余坚,等.高糖高脂联合低剂量STZ诱导版纳微型猪2型糖尿病模型的建立[J].中南医学科学杂志,2012,40(4):351-356.
[10] Gallistl S, Sudi K, Mangge H, et al.Insulin is an independent correlate of plasma homocysteine levels in obese children and adolescents[J].Diabetes Care,2000,23(9):1348-1352.
[11] Fonseca VA, Fink LM, Kern PA. Insulin sensitivity and plasma homocysteine concentrations in non-diabetic obese and normal weight subjects[J]. Atherosclerosis, 2003,167(1):105-109.
[12] Li Y, Jiang C, Xu G, et al. Homocysteine upregulates resistin production from adipocytes in vivo and in vitro[J]. Diabetes, 2008,57(4):817-827.
[13] 王文英,高爱滨,张健.吡格列酮对老年2型糖尿病患者C反应蛋白及同型半胱氨酸的影响[J].中国老年学杂志,2013,33(8):1895-1897.
[14] Dicker-Brown A, Fonseca VA, Fink LM,et al.The effect of glucose and insulin on the activity of methylene tetrahydrofolate reductase and cystathionine-beta-synthase: studies in hepatocytes[J]. Atherosclerosis, 2001,158(2):297-301.
[15] Fonseca V, Keebler M, Dicker-Brown A,et al.The effect of troglitazone on plasma homocysteine, hepatic and red blood cell S-adenosyl methionine, and S-adenosyl homocysteine and enzymes in homocysteine metabolism in Zucker rats[J]. Metabolism, 2002,51(6):783-786.
Relationship between serum homocysteine concentration and insulin resistance in the Bama miniature pig type 2 diabetes mellitus animal model
YU Jian1, ZOU Di-sha2, YE Yao2, HUANG Li-li1, LIU Xiao-ling1, MO Ru-fen1, YANG Fan1, HU Jing1, HE Yong-ling3
(1.DepartmentofEndocrinology,AffiliatedHospitalofGuilinMedicalCollege,Guilin541001,China; 2.GraduateSchool,GuilinMedicalCollege,Guilin541004,China; 3.DepartmentofClinicalLaboratory,AffiliatedHospitalofGuilinMedicalCollege,Guilin541001,China)
Objective To establish a Bama miniature pig type 2 diabetes mellitus (T2DM) animal model by high fat and high sugar diet and intraperitoneal (ip) injection of streptozotocin (STZ) and to investigate the relationship between serum insulin resistance and homocysteine(Hcy)concentration in the Bama miniature pig T2DM model. Methods Ten healthy male Bama miniature pigs were equally and randomly divided into control group and diabetic group (model group). The control group was fed with normal diet, while the model group was fed with high fat and high carbohydrate diet. After 10 months, the model group was injected with STZ 100 mg/kg. The injection was repeated a week later. While the control group was injected with the same amount of sodium citrate solution. Parameters including weight, FPG, FINS, and Hcy were measured. Meanwhile, the insulin resistance index (HOMA-IR) was calculated. Results (1) At the early stage of experiment, the values of weight, FPG, FINS, HOMA-IR increased significantly in the model group compared to the control group (P<0.01). (2) After administration of STZ, The serum level of FPG increased significantly, and the level of FINS was lower in the model group compared to the control group (P<0.01); (3) The level of Hcy was higher in the model group compared to the control group (P<0.01) and correlation analysis showed that HOMA-IR was positively cor-
high fat and high sugar diet; streptozotocin; type 2 diabetes mellitus; Bama miniature pig; homocystein
论 著
10.11724/jdmu.2015.01.05
广西科学研究与技术开发计划项目 (桂科攻1347003-5);广西壮族自治区卫生厅科研课题(Z2014301)
于 健(1965-),女,广西桂林人,主任医师,硕士生导师。E-mail:duduyu1623@qq.com
R587.1
A
1671-7295(2015)01-0020-04
于健,邹迪莎,叶瑶,等. 巴马小型猪T2DM模型胰岛素抵抗与同型半胱氨酸的关系[J].大连医科大学学报,2015,37(1):20-24.
related with the level of Hcy in the model group (r=0.906,P<0.05).Conclusion The level of Hcy is associated with insulin resistance in T2DM miniature pig.
2014-08-16;
2014-12-12)
