miR-125b、miR-29a和miR-155-5p作为诊断结核性脑膜炎生物标志的研究
2015-08-24柴璐璐田宋新袁俐王宏
柴璐璐,田宋新,袁俐,王宏△
诊断技术
miR-125b、miR-29a和miR-155-5p作为诊断结核性脑膜炎生物标志的研究
柴璐璐1,田宋新1,袁俐2,王宏1△
目的 探讨结核性脑膜炎患者脑脊液及血浆中microRNA(miR)-125b、miR-29a和miR-155-5p的表达水平及其临床意义。方法 收集20例结核性脑膜炎患者(结脑组)和20例原发性头痛患者(对照组)的脑脊液和血浆,分别提取总RNA,使用实时定量PCR方法分别检测脑脊液和血浆中miR-125b、miR-29a及miR-155-5p的表达水平。结果 与对照组相比,结脑组脑脊液、血浆中miR-29a、miR-125b表达水平明显上调,结脑组血浆中miR-155-5p表达水平明显上调,差异均有统计学意义(均P<0.01),而2组脑脊液中miR-155-5p表达水平比较差异无统计学意义。结论 miR-125b、miR-29a和miR-155-5p可能参与了调节结核性脑膜炎的发生、发展过程,miR-125b 和miR-29a有可能作为潜在的诊断结核性脑膜炎的生物学标志。
结核,脑膜;血浆;脑脊髓液;微RNAs;实时定量PCR;miR-125b;miR-29a;miR-155-5p
结核性脑膜炎简称结脑(tuberculous meningitis,TBM),起病多隐匿、病程长,临床表现及实验室检查缺乏特异性,由于抗菌药物滥用,导致不典型病例日益增多,诊治时机延误,造成较高的致死率及致残率。目前TBM的诊断主要依赖病原体检测,存在周期长、灵敏度及特异度低等问题,探索TBM的新型、快速诊断方法尤为重要。近年来体液中的微RNAs(microRNAs,miRNAs)作为一种新型的疾病诊断标志物已有大量研究报道,并显示出良好的应用前景[1]。肺结核患者血清[2]、血浆[3]、痰液[4]及细胞内[5]miRNAs表达的研究多见报道,结核性脑膜炎患者脑脊液和血浆中相关miRNAs是否存在表达差异尚少见报道。本研究通过检测miR-125b、miR-29a和miR-155-5p在结核性脑膜炎患者与对照者的脑脊液和血浆中的表达水平,探讨其是否存在差异,及其作为结核性脑膜炎诊断标志物的可能性。
1 对象与方法
1.1 研究对象 患者来自于2013年10月—2014年6月就诊于新疆石河子大学医学院第一附属医院神经内科、石河子市人民医院神经内科及伊犁哈萨克族自治州奎屯医院神经内科住院的患者。(1)结脑组:符合结脑临床诊断标准[6],均经结核DNA检测或结核感染T细胞检测试剂盒(T-SPOT.TB)检测阳性,诊断明确的患者20例,有结核病史4例,其中2例空洞性肺结核和2例脊柱结核;排除结核病外有其他合并症者。(2)对照组:原发性头痛患者20例,体格检查未发现神经系统阳性体征,脑脊液及相关辅助检查各项指标均于正常值范围的住院患者。本研究方案经伦理委员会批准通过,所有患者均签署知情同意书。2组一般情况比较见表1。

Tab.1 Comparison of general data between two groups表1 2组一般资料比较 (n=20)
1.2 主要材料和仪器 7500Fast荧光定量检测仪(AB公司),TC3000PCR仪(英国Techne公司),GelDoc2000凝胶成像系统(美国 Bio-RAD公司),紫外分光光度计 Nanodrop2000,miRNA提取试剂盒、逆转录试剂盒、荧光定量试剂盒、miRNA引物(均为Tiangen公司)。氯仿、核酸染料、PBS、无Rnase酶枪头及离心管购自上海生物工程有限公司,无水乙醇购自天津市登科化学试剂有限公司。
1.3 方法
1.3.1 样本的收集和处理 抽取研究对象外周静脉血3 mL,EDTAK2抗凝,无菌腰穿收集脑脊液3 mL,样本采集后4 h内离心,取上清液至无酶冻存管,于-80℃保存备用。
1.3.2 血浆和脑脊液RNA提取 按照miRcute miRNA提取试剂盒说明书提取血浆和脑脊液总RNA。
1.3.3 逆转录 按照Tiangen miRcute miRNA cDNA第1链合成试剂盒,先采用miRNA3′末端加多聚A尾poly(A)的方法进行miRNA修饰,反应体系为20 μL,总RNA4.6 μL,E.coli Poly(A)Polymerase 0.4 μL,10×Poly(A)Polymerase Buffer 2 μL,5×rATP Solution 4 μL,RNase-Free ddH2O 9 μL,短暂离心后在37℃反应60 min。然后使用Oligo(dT)-Universal Tag通用逆转录引物进行逆转录反应,反应液的配制(20 μL):Poly (A)反应液2 μL,10×RT Primer 2 μL,10×RT Buffer 2 μL,Super Pure dNTP 1 μL,RNasin(40 U/μL)1 μL,Quant RTase 0.5 μL,RNase-Free ddH2O 11.5 μL。短暂离心后37℃反应60 min;最终生成miRNA对应的cDNA第1链,置-20℃备用。
1.3.4 荧光定量PCR检测 按照Tiangen公司的荧光定量检测试剂盒说明书进行操作;以U6为内参,hsa-miR-125b、hsa-miR-29a、hsa-miR-155-5p及内参引物均为Tiangen公司专利;下游引物为通用引物,来自试剂盒。实时定量PCR 在AB公司的7500Fast荧光定量检测仪上进行。PCR的结果采用相对定量法2-△△ct值进行比较。
1.4 统计学方法 采用SPSS 17.0统计学软件处理。计量资料均进行正态性检验,符合正态分布的用均数±标准差(±s)描述,组间比较用两独立样本t检验,不符合正态分布用M(P25,P75)描述,组间比较用两独立样本比较的Wilcoxon秩和检验,计数资料组间比较用χ2检验。P<0.05差异有统计学意义。
2 结果
2.1 2组血浆miR-125b、miR-29a和miR-155-5p表达水平比较 结脑组血浆miR-125b、miR-29a和miR-155-5p表达水平明显高于对照组,差异有统计学意义(P<0.01),见表2。

Tab.2 Expression levels of plasma miR-125b,miR-29a and miR-155-5p in two groups表2 2组血浆miR-125b、miR-29a和miR-155-5p表达水平比较 [n=20,M(P25,P75)]
2.2 2组脑脊液miR-125b、miR-29a和miR-155-5p表达水平比较 结脑组脑脊液中miR-125b和miR-29a的表达明显高于对照组,差异有统计学意义(P<0.01),2组脑脊液中miR-155-5p的表达差异无统计学意义,见表3。
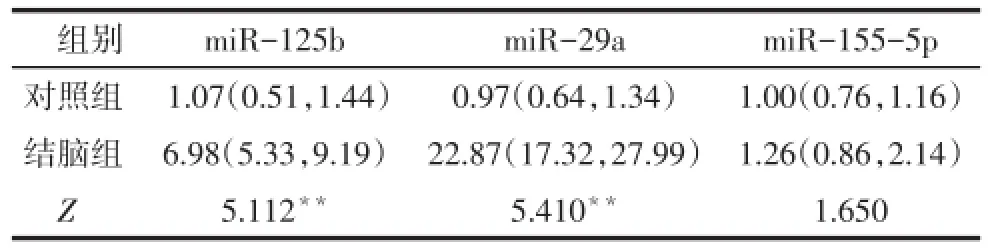
Tab.3 Expression levels of CSF miR-125b,miR-29a and miR-155-5p in two groups表3 2组脑脊液miR-125b、miR-29a和miR-155-5p表达水平比较 [n=20,M(P25,P75)]
3 讨论
结核性脑膜炎是肺外结核中危害最大的类型,随着结核病发病率的升高,结核性脑膜炎的发病率也明显升高,其病死率较高,常遗留永久性中枢神经系统后遗症[7]。当机体处于疾病状态下(如感染性疾病)时 miRNAs表达谱会发生特征性的改变。Creemers等[8]研究表明,miRNAs能够游离于细胞之外,稳定存在于体液(如血清、血浆和脑脊液等)中,循环miRNAs具有组织特异性、稳定性良好,检测方便等优势。
miRNA是一类由小分子非编码的RNA,能诱导mRNA的降解或抑制其编码蛋白的翻译,从而调节特异性蛋白的表达水平[9]。miRNAs在抗结核感染免疫中发挥着重要的调控作用[3,10]。有研究表明,miR-29a,miR-125b和miR-155可能是肺结核病新型诊断标志物[11]。其可能的机制如下:(1)miR-125b通过抑制Toll样受体2(TLR2)介导的p38丝裂原活化蛋白激酶(MAPK-p38)/3-磷脂酰肌醇激酶(PI3K)/蛋白激酶B(PKB)等信号通路减少肿瘤坏死因子(TNF)-α的合成[12];同时TNF-α是miR-125b的靶基因之一,miR-125b直接靶向TNF-α mRNA 的3′UTR,抑制mRNA转录,高表达的miR-125b抑制了TNF-α的合成[13];这均有利于结核分枝杆菌的生存。(2)miR-29a是Wnt信号通路中T细胞因子(T-cell factor,TCF)的负调控分子,miR-29a通过靶向降解干扰素(IFN)-γ,高表达的miR-29a下调了IFN-γ的合成,抑制机体对胞内病原体的免疫反应[14];miR-29a还可以通过抑制巨噬细胞凋亡相关的半胱天冬酶-3(caspase-3),抑制巨噬细胞的凋亡过程。(3)Wu等[5]研究证实感染结核分枝杆菌的巨噬细胞内存在miR-155的高表达;Ghorpade等[15]研究证明,敲除小鼠巨噬细胞的miR-155基因可导致与巨噬细胞凋亡相关的caspase-3和BRI相关激酶1(BAK1)表达下降,从而增加巨噬细胞的凋亡,有力地证明了miR-155在结核分枝杆菌诱导巨噬细胞凋亡的过程中起着重要作用。本研究荧光定量PCR结果显示:(1)结脑组血浆中miR-125b、miR-29a和miR-155-5p表达上调,与Yi等[4,10]和Fu等[3]在活动性肺结核患者的痰液、血清标本中miR-29a上调的趋势一致,分别与Rajaram等[13]和Wu等[5]在结核分枝杆菌感染巨噬细胞和单个核细胞的研究中miR-125b和miR-155的高表达一致;推测miR-125b、miR-29a和miR-155-5p可能参与调节结核性脑膜炎的感染过程。(2)结核性脑膜炎患者脑脊液中miR-125b和miR-29a表达上调,脑脊液中miR-155-5p的表达差异无统计学意义;因此推测miR-29a和miR-125b可能作为潜在的结核性脑膜炎诊断标志物。miR-29a和miR-125b能否真正作为结核性脑膜炎的诊断标志物,血浆中miR-29a,miR-125b和miR-155-5p的诊断价值能否等同脑脊液中的诊断价值,还需扩大样本量进一步的研究。
综上,miR-125b、miR-29a和miR-155-5p可能参与调节了结核性脑膜炎的发生、发展过程,miR-29a和miR-125b可能是潜在的结核性脑膜炎的生物学标志。然而目前miRNAs在结核的诊断中尚处于研究阶段,其在结核性脑膜炎的感染过程中的作用机制及诊断价值有待于进一步的研究。
[1]Bai HX,Pan J.Diagnosis progress on detection of the microRNAs in body fluids[J].International Journal of Laboratory Medicine,2012,33 (7):836-839.[拜红霞,潘杰.体液中微小RNA检测用于疾病诊断的进展[J].国际检验学杂志,2012,33(7):836-839].doi:10.3969/j.issn.1673-4130.2012.07.030.
[2]Qi Y,Cui L,Ge Y,et al.Altered serum microRNAs as biomarkers for the early diagnosis of pulmonary tuberculosis infection[J].BMC Infect Dis,2012,12:384.doi:1186/1471-2334-12-384.
[3]Fu Y,Yi Z,Wu X,et al.Circulating microRNAs in patients with active pulmonary tuberculosisinfection[J].J Clin Microbiol,2011,49 (12):4246-4251.doi:10.1128/JCM.05459-11.
[4]Yi Z,Fu Y,Ji R,et al.Altered microRNA signatures in sputum of patients with active pulmonary tuberculosis[J].PLoS One,2012,7(8): e43184.doi:10.1371/journal.pone.0043184.
[5]Wu J,Lu C,Diao N,et al.Analysis of microRNA expression profiling identifies miR-155 and miR-155*as potential diagnostic markers for active tuberculosis:a preliminary study[J].Hum Immunol,2012,73 (1):31-37.doi:10.1016/j.humimm.2011.10.003.
[6]Thwaites GE,van Toorn R,Schoeman J.Tuberculous meningitis: more questions,still too few answers[J].Lancet Neurol,2013,12(10): 999-1010.doi:10.1016/S1474-4422(13)70168-6.
[7]Joosten AA,Van Der Valk P,Geelen JAG,et al.Tuberculous meningitis:pitfallsin diagnosis[J].Acta Neurol Scand,2000,102(6):388-394.doi:10.1034/j.1600-0404.2000.102006388.x.
[8]Creemers EE Tijsen AJ,Pinto YM.Circulating microRNAs novel biomarkers and extracellular communicators in cardiovascular disease[J].Circ Res,2012,110(3):483-495.doi:10.1161/CIRCRESAHA.111.247452.
[9]Bartel DP.microRNAs:genomics,biogenesis,mechanism and function [J].Cell,2004,116(2):281-297.doi:10.1016/S0092-8674(04)00045-5.
[10]Zhang YZ,Yi ZJ,Fu YR.Research progress on microRNAs and pulmonary infection[J].Chin J Mol Immunol,2012,28(11):1223-1224.[张玉芝,伊正君,付玉荣.microRNA与肺部感染的研究进展[J].细胞与分子免疫学杂志,2012,28(11):1223-1224].
[11]Singh PK,Singh AV,Chauhan DS.Current understanding on microRNAs and its regulation in response to mycobacterial infection[J].J Biomed Sci,2013,20(1):14.doi:10.1186/1423-0127-20-14.
[12]Brook M,Tchen CR,Santalucia T,et al.Posttranslational regulation of tristetraprolin subcellularlocalization and protein stability by p38 mitogen-activated protein kinase and extracellular signalregulated kinase pathways[J].Mol CellBiol,2006,26(6):2408- 2418.doi: 10.1128/MCB.26.6.2408-2418.2006.
[13]Rajaram MVS,Ni B,Morris JD,et al.Mycobaterium tuberculosis lipomannan blocks TNF biosynthesis by regulating macrophage MAPK-activated protein kinase 2(MK2)and microRNA-125b[J].Proc Natl Acad,2011,108(42):17408-17413.doi:10.1073/pnas.1112660108.
[14]Ma F,Xu S,Liu X,et al.The microRNA miR-29 controls innate andadaptive immune responses to intracellular bacterial infection by targeting interferon-γ[J].NatImmunol,2011,12(9):861-869.doi: 10.1038/ni.2073.
[15]Ghorpade DS,Leyland R,Kurowska-Stolarska M,et al.MicroRNA-155 is required for Mycobaterium bovis BCG-mediated apoptosis of marcrophages[J].Mol Cell Bio,2012,32(12):2239-2253.doi:10.1128/ MCB.06597-11.
(2014-11-28收稿 2015-01-21修回)
(本文编辑 李国琪)
Study of miR-125b,miR-29a and miR-155-5p as biomarkers of tuberculous meningitis
CHAI Lulu1,TIAN Songxin1,YUAN Li2,WANG Hong1△
1 Department of Neurology,the First Affiliated Hospital,Medicine School of Shihezi University,Shihezi 832000,China;
2 Department of Pathogenic Microbiology and Immunology,Medicine School of Shihezi University
△Corresponding Author E-mail:wang832000@sina.com
Objective To investigate the expression levels of microRNA(miR)-125b,miR-29a and miR-155-5p in cerebrospinal fluid(CSF)and plasma from the patients with tuberculous meningitis and their clinic significance.Methods Cerebrospinal fluid and plasma samples were collected from 20 patients with tuberculous meningitis(tuberculous meningitis group)and 20 patients suffered from primary headache(control group).The total RNAs were extracted.The levels of miR-125b,miR-29a and miR-155-5p were determined by real-time quantitative PCR(q-PCR).Results Levels of miR-29a and miR-125b in both CSF and plasma of patients in tuberculous meningitis group were significantly higher than those in patients from control group with statistical significance(P<0.01).Mean time,the level of miR-155-5p in plasma but not in CSF of patients in tuberculous meningitis group was higher than those in control group with statistical significance(P<0.01).Conclusion Expression of miR-125b,miR-29a and miR-155-5p may participate in regulating the occurrence and development of tuberculous meningitis.And miR-125b and miR-29a may be used as potential biomarkers for diagnosing tuberculous meningitis.
tuberculosis,meningeal;plasma;cerebrospinal fluid;microRNAs;real-time quantitative PCR;miR-125b;miR-29a;miR-155-5p
R529.3
A DOI:10.11958/j.issn.0253-9896.2015.06.026
国家“十二五”计划重大传染病防治专项结核病专项(2013ZX10003003-002-002)
1新疆石河子大学医学院第一附属医院神经内科(邮编832000);2新疆石河子大学医学院病原微生物与免疫学教研室
柴璐璐(1988),女,在读硕士,主要从事中枢系统感染研究
△E-mail:wang832000@sina.com
