黄芩苷体外抗流感病毒作用的研究*
2015-08-23刘晓婷顾立刚邱泽计王玥琦
刘晓婷,张 沂,顾立刚,吴 珺,邱泽计,王玥琦
·中药研究·
黄芩苷体外抗流感病毒作用的研究*
刘晓婷1,张沂1,顾立刚1,吴珺1,邱泽计1,王玥琦2
(1.北京中医药大学基础医学院中医药防治病毒性疾病实验室,北京100029;2.北京中医药大学基础医学关键技术中心,北京100029)
[目的]通过观察黄芩苷对甲型流感病毒(H1N1)感染人肺癌细胞株(A549细胞株)的作用,探讨其在体外抗甲型流感病毒的作用。[方法]通过细胞病变效应(CPE)观察黄芩苷对病毒致细胞病变作用的影响,采用四甲基偶氮唑蓝(MTT)比色法检测药物对人肺癌细胞株A549的最大无毒浓度(TC0)和半数中毒浓度(TC50)。检测药物不同给药方式和作用时间的吸光度,比较各组抗病毒有效率,找出黄芩苷最佳抗病毒作用方式。采用Probit回归计算最佳作用方式时其对病毒感染的半数抑制浓度(IC50)以及治疗指数(TI)。[结果]在7.920~0.495 mg/L范围内的黄芩苷作用24~48 h,对流感病毒所致的细胞病变作用有明显的抑制作用,细胞存活率明显高于病毒感染组。其中,抗病毒生物合成组(Ⅲ)在给药后48 h,其抗病毒有效率最高,浓度为3.960 mg/L组的细胞存活率最高,抗病毒有效率达89.107%。计算该条件下黄芩苷IC50为1.399 mg/L,TI为22.608。[结论]黄芩苷在一定浓度下有抗病毒作用,主要是通过抑制病毒在感染的A459细胞内生物合成而发挥抗病毒作用。
黄芩苷;抗流感病毒;体外;A549;H1N1
DOI:10.11656/j.issn.1672-1519.2014.04.10
流感病毒引起的感冒是世界性呼吸道传染疾病,每年季节性流感感染5%~20%的人口,造成约25~50万人死亡[1],对人类生命安全造成了极大的威胁[2]。目前抗流感病毒药物主要是M2离子通道抑制剂(金刚烷胺和金刚乙胺)和病毒神经氨酸酶抑制剂(奥司他韦和扎那米韦)[3-4],但都由于药物毒副作用和耐药性,在临床应用受限明显[5]。
黄芩苷为黄酮类化合物,是黄芩有效成分之一,有多种药理活性。体内实验研究表明:黄芩苷通过降低炎性细胞因子的分泌水平,减缓流感病毒诱导小鼠肺部炎性病理损伤[6];还能通过影响细胞凋亡受体途径FAS/FASL,病毒感染小鼠肺组织细胞的凋亡系统[7],发挥抗流感病毒感染作用。本实验主要研究黄芩苷抗流感病毒H1N1感染A549作用,为进一步探讨其抗流感病毒作用机制研究奠定基础。
1 材料与方法
1.1实验材料
1.1.1病毒与细胞甲型H1N1流感病毒,A1/黔防/166/85株,使用时接种于9日龄鸡胚尿囊腔,37℃培养2 d,连续传代2次后,收集尿囊液,测血凝滴度为2-7。人肺癌细胞株(A549)购自中国协和医科大学基础医学细胞中心,培养基McCoy’s 5A中含10%胎牛血清、1%青霉素和1%链霉素。
1.1.2药物与试剂黄芩苷,黄色粉末,纯度98.2%,分子量446.35。阳性对照磷酸奥司他韦胶囊(达菲),瑞士巴塞尔豪夫·迈罗氏公司生产产品批B1354,分装批号SH0037。McCoy’s5A培养基和胎牛血清(Gibco公司,美国);0.25%胰酶-0.02%乙二胺四乙酸(EDTA,Thermo公司,美国);四甲基偶氮唑蓝(MTT)和二甲亚砜(DMSO)(Sigma公司,美国)。三联溶解液:SDS 10 g,异丁醇5 mL,10 mol/L氯化氢(HCl)0.1 mL。细胞培养液(含10%胎牛血清和1% 青-链霉素混合物的完全McCoy’s 5A培养基),细胞维持液(含2.0%胎牛血清的McCoy’s 5A培养基);1.5%鸡红细胞混悬液。
1.1.3实验仪器超净工作台(北京碧都净化设备有限公司)、酶标仪(北京普朗新技术有限公司DNM-9602)、细胞培养箱(BINDER WMK-02型)、光学显微镜(Olympus Co)和倒置光显微镜(Olympus Co)、水浴箱(北京市医疗设备厂小型三用水箱)、离心机(Heraeus Labofuge 400R)、Astell全自动高压灭菌器(北京东迅天地医疗仪器有限公司)、低温冰箱(Thermo model 702)。
1.2实验方法
1.2.1细胞常规培养复苏细胞A549加细胞培养液经3~4次传代后,细胞恢复正常生长周期。将生长状态良好的细胞加入0.25%胰酶-0.02%EDTA消化细胞,洗脱后加入细胞培养液调整细胞浓度为每毫升1.5×105个。吹打均匀,吸取细胞悬液加至96孔板中,每孔100 μL,在37℃,5%二氧化碳(CO2)培养箱中培养6~8 h,使得细胞呈单层贴于孔底。
1.2.2病毒感染性测定用无血清McCoy’s 5A培养基作为稀释液对流感病毒H1N1进行连续10倍递次稀释,将各稀释度的病毒液接种于A549细胞单层吸附的96孔板中,每孔100 μL,每个稀释度平行6个复孔,同时设正常细胞对照,正常细胞对照孔不加病毒,只加稀释液。置于37℃,5%CO2培养箱中吸附2 h,小心吸弃各孔病毒液换用细胞维持液,继续置于37℃,5%CO2培养箱中继续培养48 h。然后在倒置显微镜下观察细胞病变效应(CPE),记录病变程度和孔数,以细胞对照无明显退变,病毒感染细胞病变率达50%及以上的细胞孔为病变孔,细胞病变率小于50%的为非病变孔,按Reed-Muench法计算病毒的半数细胞培养物感染量(TCID50)。
1.2.3药物细胞毒性实验取A549细胞单层吸附的96孔板轻轻吸弃上清液,加入用细胞维持液倍比稀释的黄芩苷药液,每孔100 μL。药物每个稀释度平行6个复孔,同时设正常细胞对照。置于37℃,5%CO2培养箱培养48 h后,观察黄芩苷对A549细胞的CPE,根据Reed-Muench法计算药物最大无毒浓度(TC0)。加入MTT(终浓度0.5 g/L),继续培养4 h,再每孔加入100 μL SDS,轻轻混匀后再培养12 h,A1孔调零,用酶标仪在570 nm波长处测定细胞各实验组的吸光度值(A),计算细胞存活率。公式为:细胞存活率%=实验组吸光度值(A)/细胞对照组吸光度值(A)×100%。采用SPSS 20.0软件Probit回归计算药物半数中毒浓度(TC50)。
1.2.4药物抗病毒方式检测取已长成单层细胞的培养板,吸弃细胞培养液,加磷酸盐缓冲溶液(PBS)轻洗细胞面2次,根据病毒复制周期,设计3个药物抗病毒作用靶点[8]:药物预防组(Ⅰ)是先加入药24 h,再加终浓度100TCID50病毒作用2 h;抗病毒吸附组(Ⅱ)是病毒与药同时加入;抗病毒生物合成组(Ⅲ)是先加入终浓度100TCID50病毒作用2 h后再加入黄芩苷。分别加入最大无毒浓度以下对倍稀释的5个浓度黄芩苷药液,设磷酸奥司他韦为阳性对照组,同时设正常细胞对照组和病毒对照组,每浓度4个复孔,置37℃,5%CO2培养箱中继续培养48 h。再加入MTT(终浓度0.5 g/L)和SDS,用酶标仪测定吸光度A值。计算药物抑制病毒有效率,公式为抑制率%=(药物处理组平均A值-病毒对照组平均A值)/(细胞对照组平均A值-病毒对照组平均A值)×100%。
1.2.5药物抗病毒作用时间检测取已长成单层细胞的培养板,吸弃细胞培养液,加PBS液轻洗细胞面2次,接种100TCID50的病毒液,每孔100 μL,置37℃,5%CO2培养箱中吸附2 h。然后吸弃病毒液,加入TC0以下5个对倍稀释的黄芩苷药液,设磷酸奥司他韦为阳性对照组,同时设有正常细胞对照组和病毒对照组,每浓度6个复孔。置37℃,5%CO2培养箱中分别继续培养24、36、48、60、72 h。在相应时间分别取出培养板,加MTT(终浓度0.5 g/L),用酶标仪在570 nm波长下测定吸光度A值(A570),计算药物抑制病毒有效率。
1.2.6药物最佳抗病毒方案验证取已长成单层细胞的培养板,吸弃细胞培养液,加PBS液轻洗细胞面2次,按照“药物抗病毒方式检测”和“药物抗病毒作用时间检测”项下结果操作,设磷酸奥司他韦为阳性对照组,同时设正常细胞对照组和病毒对照组。再加入MTT(终浓度0.5 g/L)和SDS,用酶标仪测定A值。计算药物抑制病毒有效率,并用SPSS 20.0软件的Probit回归计算药物对病毒所致细胞的CPE的半数抑制浓度(IC50)和治疗指数(TI),TI= TC50/IC50。
1.2.7药物对流感病毒血凝素的影响取培养48 h后各组实验细胞,将其反复冻融3次,吹打细胞板底部使细胞脱落,静置5~10 min后,吸上清。取24孔血凝板每孔加生理盐水200 μL,分别加入各组细胞上清液200 μL,进行一系列浓度稀释,第1孔设为阴性对照(只加生理盐水和鸡血)。每孔加入1.5%鸡血200 μL,轻轻混匀置于37℃温箱,2 h后观察并记录实验结果。
1.3统计方法各项实验均重复3次以上,然后分别计算各数据平均值及标准差。数据采用SPSS 20.0软件统计分析。多组间差异采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD法进行。结果以均值±标准差(x±s)表示,P<0.05为有统计学差异。
2 结果
2.1病毒TCID50的测定观察病毒所致A549细胞病变情况,按Reed-Muench法计算流感病毒H1N1的TCID50=10-3.778/0.1 mL。
2.2药物抗流感病毒实验
2.2.1药物细胞毒性实验黄芩苷对A549细胞毒性作用表现为,细胞折光性增加、细胞变圆、破碎、脱落,且药物对细胞的毒性作用在一定范围内随着药物浓度的降低,细胞存活率增加。当浓度降低至7.920 mg/L时CPE轻微不明显,细胞形态、数量、折光率与正常细胞对照组差异无统计学意义,因此黄芩苷的TC0为7.920 mg/L。加入MTT测定A值后经SPSS软件Probit回归计算检测药物的半数毒性浓度TC50为31.624 mg/L。
2.2.2药物抗病毒方式实验以3种方式给予黄芩苷后,将各组细胞培养至48 h后加入MTT测定A值计算抑制病毒有效率。其中药物预防组(Ⅰ)黄芩苷各浓度的抑制病毒有效率较低,小于50%;抗病毒吸附组(Ⅱ)各浓度的抑制病毒有效率稍高于药物预防组,在40%~70%之间;抗病毒生物合成组(Ⅲ)各浓度的抑制病毒有效率较高,均达50%以上,最高抑制有效率可达89.107%(3.960 μg/mL)。见表1。
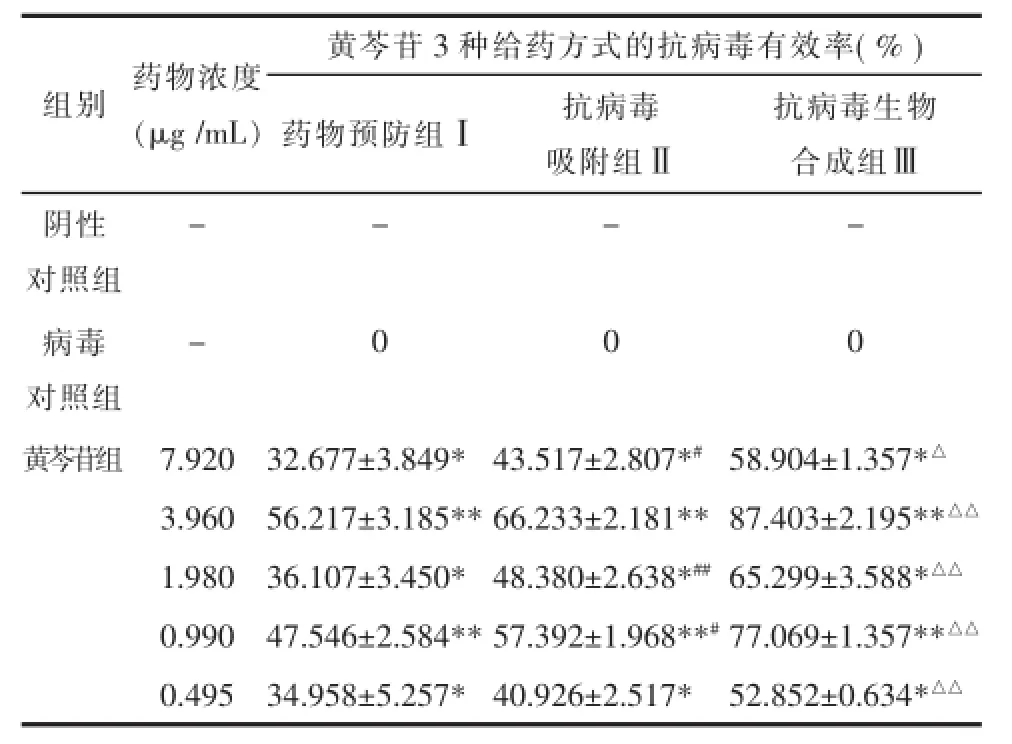
表1 黄芩苷不同给药方式抗病毒有效率结果Tab.1 Inhibitory rate of the baicalin on influenza virus A(H1N1)in different manners
2.2.3药物抗病毒有效率检测感染病毒后细胞A549加黄芩苷培养24、36、48、60、72 h,进行MTT测定A值计算抑制病毒有效率。结果表明黄芩苷在24~72 h内,有明显抗病毒作用,48 h抗病毒作用较高,此后60~72 h,抗病毒作用无明显变化。阳性药奥司他韦在36 h时达到较好的抗病毒有效率,并且与48h之后的抗病毒有效率无统计学差异。见表2。
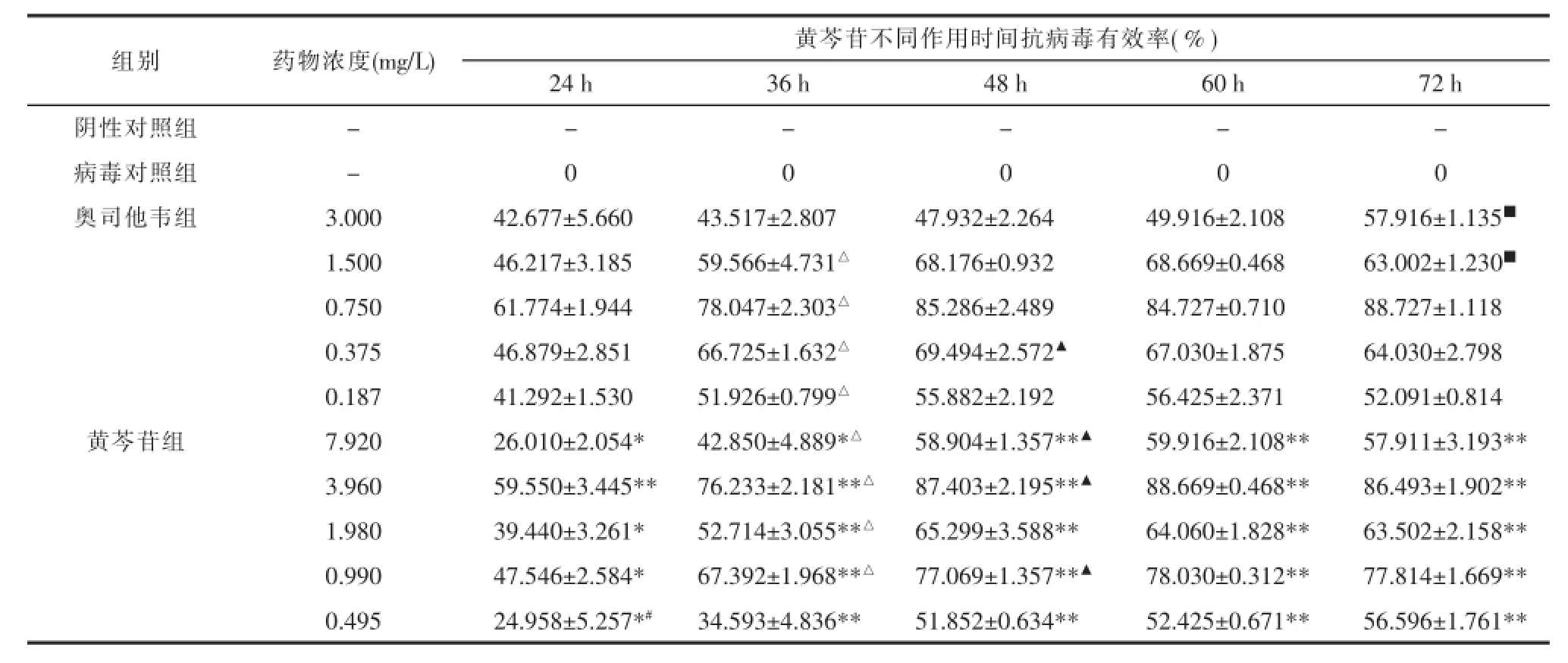
表2 黄芩苷不同作用时间抗病毒有效率结果Tab.2 Inhibitory rate of the baicalin on influenza virus A(H1N1)in different time
根据黄芩苷抗病毒作用方式和时间的实验结果,得出黄芩苷抗病毒最佳方案为,即接种100TCID50的病毒液,每孔100 μL,置37℃,5%CO2培养箱中吸附2 h,然后加入最大无毒浓度以下对倍稀释的5个浓度黄芩苷药液,置37℃,5%CO2培养箱中继续培养48 h。加入MTT测定A值,计算此方案下黄芩苷IC50为1.399 mg/L,TI为22.608。当黄芩苷浓度为3.960和0.990 mg/L时,抑制病毒率较高,分别为87.403%和77.069%。
2.2.4药物对流感病毒血凝素的影响收集实验各组细胞上清液,进行凝集实验,结果进行对数转化,病毒对照组血凝滴度为1.903,黄芩苷浓度由高到低血凝滴度分别为1.505,1.204,1.447,1.301,1.602,结果可见黄芩苷组比病毒对照组滴定终点均明显提前,且黄芩苷浓度在3.960和0.990 mg/L浓度时,与模型组比较有统计学差异(P<0.05),与阳性药组比较无统计学差异,见表3。

表3 黄芩苷对流感病毒血凝素的影响Tab.3 Inhibitory effect of baicalin to the hemagglutination titer of the influenza virus in vitro
3 讨论
人禽流行性感冒是由禽甲型流感病毒中某些亚型毒株突破种属屏障而感染人,临床表现以发热、肌痛、咽痛、咳嗽等呼吸道症状和恶心、腹痛、腹泻等消化道症状为主,少数患者可出现急性呼吸窘迫征、多脏器衰竭,病死率较高。任何年龄段均可患病,无性别差异,以12岁以下儿童发病率较高目前[9]。
药物抗流感病毒主要有3种:干扰素,M2离子通道抑制剂和病毒神经氨酸酶抑制剂。干扰素主要抑制病毒复制;金刚烷胺作用于流感病毒膜蛋白和血凝素蛋白,阻止病毒进入宿主细胞;奥司他韦抑制神经氨酸酶活性,阻止成熟的病毒离开宿主细胞。化药对流感病毒有一定的抗病毒作用,但是病毒很快适应来自药物的作用,并且出现逃避和耐药[10],或出现严重的不良反应如腹泻、精神狂乱(尤其对儿童)、幻觉甚至自杀身亡,临床应用受限。在中国,很早就开始研究中药制剂抗流感的作用[11],近年来也开始着手于对中药有效部位抗流感病毒作用的研究[12]。
黄芩苷是一种来源于植物的多羟基黄酮类化合物,具有抗病毒[13],抗氧化[14],抗肿瘤[15],促进神经干细胞分化[16]等作用。已有研究表明,黄芩苷可以对流感病毒感染导致的小鼠死亡有很好的保护作用,对小鼠肺内的流感病毒有一定的清除作用,能降低肺内流感病毒的血凝滴度和感染力[17],通过下调TLR7/MyD88信号通路,降低病毒感染所致小鼠肺组织病理损伤和炎症反应[18]。
本实验结果表明,黄芩苷在病毒感染后24~48 h有抗病毒作用,基本上可以抑制流感病毒在细胞造成的损伤,并且药物作用48 h后,抗病毒作用不随时间增长而有明显变化。不同给药方式给予黄芩苷,其抗病毒效率不同:药物预防组(Ⅰ)其抗病毒效率低于50%,表明黄芩苷阻断病毒侵入细胞的作用较差。抗病毒吸附组(Ⅱ)其抗病毒效率在40%~70%,表明黄芩苷有抑制病毒吸附于细胞,抗病毒生物合成组(Ⅲ)其抗病毒效率较高,在50%~90%,浓度为3.960和0.990 mg/L时,抑制病毒率较高,分别为87.403%和77.069%,说明黄芩苷对病毒所致的细胞病变有抑制作用,且为主要抗病毒的作用。以上结果说明,黄芩苷抗病毒作用是通过多种方式来实现的,能阻断病毒吸附、穿入细胞,抑制病毒在宿主细胞内的复制增殖,并且主要是抑制病毒吸附后的复制增殖起到抗病毒作用,这与已有文献报道的黄芩苷可显著降低Caspase 8/3活性,通过抑制Caspase 8,进一步抑制Caspase 3活性,调控细胞周期分布发挥抗病毒作用[19]相符合。
流感病毒包膜上含有血凝素(HA)和神经氨酸酶(NA)两种蛋白。HA在病毒进入细胞过程中起到至关重要的作用。HA蛋白经丝氨酸酶水解后分成HA1和HA2,HA1与宿主细胞膜唾液酸受体相结合,引导病毒进入细胞,HA2协助包膜与宿主细胞膜相互融合[20]。因此,在抗病毒药筛选初期,常用血凝实验作为辅助验证实验。本研究血凝实验结果进一步验证,病毒感染细胞后给予不同浓度的黄芩苷,细胞上清中HA比病毒对照组均有不同程度的下降,可能因黄芩苷降低病毒感染细胞的HA、NA和M基因mRNA表达[15],并且黄芩苷浓度为3.960和0.990mg/L时,血凝结果与阳性药组比较无统计学差异,说明其抗病毒效果显著。
综上所述,黄芩苷体外实验中有一定的抗流感病毒作用,早期可以抑制流感病毒吸附、穿入细胞,主要作用是在后期抗病毒生物合成作用。但是具体在流感病毒生物合成周期的哪个环节起作用及其作用机制还不清楚,有必要在分子水平对黄芩苷做进一步抗病毒机制研究。
[1]Fu TM,Grimma KM,Citrona MP,et al.Comparative immunogenicity evaluations of influenza A virus M2 peptide as recombinant virus like particle or conjugate vaccines in mice and monkeys[J].Vaccine,2009,27(9):1440-1147.
[2]De Clercq E.Antiviral agents active against influenza A viruses[J]. Nat Rev Drug Discov,2006,12(5):1101-1025.
[3]Jeffery K,Taubenberger M D,David M.InfIuenza,The Once and Future Pandemic[J].The science of influenza,2010,125(1):16-26.
[4]Moscona A.Medical management of influenza infection[J].Annu Rev Med,2008,59(1):397-413.
[5]Wallis AI,Klimov,Gubareva LV.Surveillance for neuraminidase inhibitor resistance among human influenza A and B viruses circulating worldwide in 2004-2008,Antimicrob[J].Agents Chemother,2008,52(9):3284-3292.
[6]万巧凤,顾立刚,殷胜骏,等.黄芩苷对流感病毒FM 1肺炎小鼠肺损伤的保护研究[J].中华中医药杂志,2011,26(12):2818-2851.
[7]万巧凤,顾立刚,殷胜骏,等.黄芩苷对FM1肺炎小鼠肺组织细胞凋亡FAS/FASL系统的影响[J].中国药理学通报,2012,28(2):208-212.
[8]李沙,甄宏.知母宁体外抗甲型流感病毒作用研究[J].中国药师,2005,8(4):267-270.
[9]董梅,张军平.人感染高致病性禽流感相关研究进展[J].天津中医药,2005,22(6):520-522.
[10]Devde VM,Xu X,Bright RA,et al.Surveillance of resistance to adamantanes among influenza A(H3N2)and A(H1N1)viruses isolated worldwide[J].lrpfect Dis,2007,196(2):249-257.
[11]张艳丽,顾立刚,王庆国,等.清肺注射液不同配伍体外对流感病毒增殖的影响[J].天津中医药,2007,24(5):411-413.
[12]李爽,彭晓芝,廖鹏程,等.空心莲子草有效部位提取物抗甲型H3N2流感病毒作用[J].天津中医药,2012,29(5):478-480.
[13]高雷,陈鸿珊.黄芩苷体外对流感病毒、单纯疱疹病毒和柯萨奇病毒的抑制作用[J].中国新药杂志,2007,17(6):474-478.
[14]Kong F,Luan Y,Zhang ZH,et al.Baicalin protects the myocardium from reperfusion?induced damage in isolated rat hearts via the antioxidant and paracrine effect[J].Experimental and Therapeutic Medicine,2014,7(1):254-259.
[15]Lu HF,hsueh SC,Hsueh YC,Ho YT,et al.ROS Mediates Baicalininduced Apoptosis in Human Promyelocytic Leukemia HL-60 Cells through the Expression of the Gadd153 and Mitochondrial-dependent Pathway[J].Anticancer Research,2007,27(1A):117-126.
[16]张密霞,李越,杜嵘,等.黄芩苷对体外培养神经干细胞分化的影响[J].天津中医药大学学报,2007,26(4):119-201.
[17]初正云,初明,滕宇.黄芩苷体内抗流感病毒作用[J].中国中药杂志,2007,32(22):2413-2415.
[18]Wan QF,Wang H,Han XB,et al.Baicalin inhibits TLR7/MYD88 signaling pathway activation to suppress lung inflammation in mice infected withinfluenza A virus[J].Biomedical Reports,2014,2(3):437-441.
[19]张春晶,顾立刚,于海涛.黄芩苷干预甲型H1N1流感病毒感染诱导的A549细胞周期分布及凋亡[J].病毒学报,2011,27(23):108-115.
[20]David MK,Peter MH,Dane EG,et al.Fields Virology[M].5thed London:Lippincott Williams&Wilkins,2007:1-649.
(本文编辑:高杉,马英)
Inhibitory effect of Baicalin on influenza virus A H1N1 in vitro
LIU Xiao-ting1,ZHANG Yi1,GU Li-gang1,WU Jun1,QIU Ze-ji1,WANG Yue-qi2
(1.Laboratory of Chinese Medicine on Viral Disease,Beijing University of Chinese Medicine,Beijing 100029,China;2.School of Pre-clinical Medicine,Beijing University of Chinese Medicine,Beijing 100029,China)
[Objective]To investigate the inhibitive effect of Baicalin on influenza A H1N1 virus infection in epithelial cell line A549. [Methods]The morphologic study and cytopathogenic effect(CPE)of cells were observed through inverted microscope.The maximum non-toxic concentration(TC0)and the median toxic concentration(TC50)were detected were assayed by MTT method.Furthermore,to identify the best method of administration and action time of baicalin,A549 cell infected with H1N1 were detected by using MTT method. The median inhibitory concentration(IC50)and treatment indexes(TI)of the best method of baicalin on viral infection were calculated with Probit regression.[Results]Baicalin had a significant inhibitory effect on influenza A H1N1 virus infection in epithelial cell line A549. The survival rate of A549 was significantly higher which added baicalin from 7.920 to 0.495 μg/mL compared with the model without the drug.In addition,the best method of baicalin against viral infection were added 2 hours after cells infected and treated 48 hours.The best survival rate was 89.107%with 3.960 μg/mL of baicalin.In this administrated method,IC50was 1.399 μg/mL,and TI was 22.608.[Conclusion]Patients suffered from CAP with chest CT consolidation shadows can be benefited from the use of the safflower yellow injection and the safflower yellow injection can be helped for the absorption of chest CT-suggested consolidation shadows.
Baicalin;antiviral;in vitro;A549;H1N1
R692.3
A
1672-1519(2015)04-0229-05
国家自然科学基金资助项目(81173371)。
刘晓婷(1983-),女,在读博士研究生,研究方向为中医药免疫调节的分子机制。
顾立刚,E-mail:lggulg@163.com。
(2014-11-20)
