化学催化法脱除模拟地下水中硝酸盐氮
2015-08-22李德生胡倩怡崔玉玮邓时海
李德生,胡倩怡,崔玉玮,邓时海
(北京交通大学土木建筑工程学院,北京 100044)
引 言
地下水是重要的淡水资源,近年来,由于生活污水和工业废水的渗漏、含氮化肥的大量使用、污水灌溉以及畜禽粪便和其他含氮固废的淋滤下渗,导致地下水(尤其是浅层地下水)硝酸盐氮污染严重[1-4]。研究表明,我国大部分地区地下水硝酸盐含量较高,超过了WHO制定的饮用水标准[5],其中南方以滇池地区污染最为严重[4,6]。饮用水中高浓度的硝酸盐在人体内经硝酸盐还原菌的作用会生成亚硝酸盐,对人体健康造成严重危害[7]。硝酸盐超标会引发高铁血红蛋白症(又称蓝婴病)[7]、地方性甲状腺肿以及肠道、脑、神经系统、皮肤等肿瘤疾病[8-9]。
目前,对地下水中硝酸盐氮的去除主要分为物理化学法、生物反硝化法和化学还原法。物理化学法(以膜分离法和离子交换法为主)虽然脱氮效果显著,但是能耗高,后处理困难,难以推广使用[10]。生物反硝化法中异养微生物对有机物的依赖限制了其在地下水修复中的应用[11]。化学还原法,例如零价铁的还原虽然经济节能,但是目前只能在酸性条件下进行[12-15],而且产物中氨氮比例过高,达不到真正意义上的脱氮。
本研究利用化学催化载体-自制活性催化固体颗粒载体处理地下水中的硝酸盐氮,无须调节地下水的pH,且在高效降低水中氧化态氮的同时也能达到一定量的总氮去除。本研究通过试验处理模拟受污染地下水,考察了停留时间、pH、原水水质对硝酸盐氮去除率及还原产物的影响,并探讨了化学催化载体化学反应脱氮机理及还原产物的选择途径,为地下水高效深度脱氮提供了理论依据。
1 试验材料和方法
1.1 化学催化载体的制备
为提高地下水中硝酸盐氮的去除率,并使得化学催化载体能够更好适应不同的水质情况,本试验以铁粉和活性炭为主要原料,同时加入氨氮抑制剂和多元微量元素催化剂、起泡剂、缓冲剂及黏合剂进行混合,在高温、严格无氧条件下烧制成自制化学催化载体[16],如图1所示。特殊烧制的自制化学催化载体有大量的微孔和巨大的比表面积。主要物理参数有:直径10~20 mm,密度1200 kg·m-3,比表面积32.017 m2·g-1,孔隙率46%,物理强度≥600 kg·cm-2。

图1 自制化学催化颗粒载体 Fig.1 Self-developed fired integrated carriers
1.2 试验装置及方法
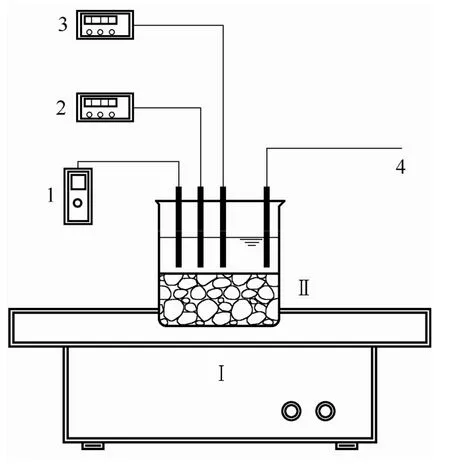
图2 烧杯试验装置示意图 Fig.2 Schematic diagram of experimental equipment
采用烧杯试验,试验装置见图2。试验前,为防止载体的吸附作用影响后期试验数据的准确性,对自制化学催化载体进行水质吸附饱和处理。将自制化学催化载体浸没于含有氨氮的配水中,每4 h 测定水中氨氮含量,直至氨氮含量不再降低,即自制载体已吸附饱和,再用去离子水冲洗去除表面残留物质。开始试验:将烧杯置于摇床上进行振荡,模拟水的流动。烧杯内装填自制载体,载体的水力负荷为0.67 ml·m-3。控制摇床振幅为20 mm,振荡频率为60 r·min-1。
按试验设计控制的时间进行取样,并同时记录样品的DO、pH、ORP的读数。
1.3 试验用水及水质
试验用水水质参照中国西南部滇池一带受严重污染的浅层地下水水质(氨氮多年检出平均值为0.29 mg·L-1,最高值为46.67 mg·L-1;硝酸盐氮平均浓度为10.57 mg·L-1,最高值可达60 mg·L-1)[17],并根据试验项目不同进行调整。由氯化铵、硝酸钾组成主要水质指标。本研究使用化学药品均为分析纯,试验配水用水为自来水。
试验分为4组,分别探究停留时间、pH、原水硝酸盐氮浓度、原水氨氮浓度对脱氮效能的影响。第1组控制停留时间分别为10 min、20 min、30 min、1 h、2 h、3 h、4 h;第2组控制原水pH分别为3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0;第3组控制氨氮含量为0,硝酸盐氮含量分别为10、20、30、40、50 mg·L-1;第4组控制硝酸盐氮含量为10 mg·L-1,氨氮含量分别为0、10、20、30、40 mg·L-1。各组实验用水水质如表1所示。
1.4 水质指标分析及方法
各指标分析方法均参考国家环保总局《水和废水监测分析方法》[18]。pH采用WTW玻璃电极检测,ORP采用HANA电极检测,DO和温度采用 YSI便携式溶解氧仪进行检测,氨氮采用纳氏试剂光度法,硝酸盐氮用紫外法在220 nm和275 nm 2个波长下同时测定[18],亚硝氮用N-(1-萘基)乙二胺分光光度法在波长540 nm处测定,可溶性铁用邻菲罗林比色法在510 nm处测定[18]。试验过程中主要分析仪器为紫外-可见分光光度计(UV 2102C, UNICO company, USA)。
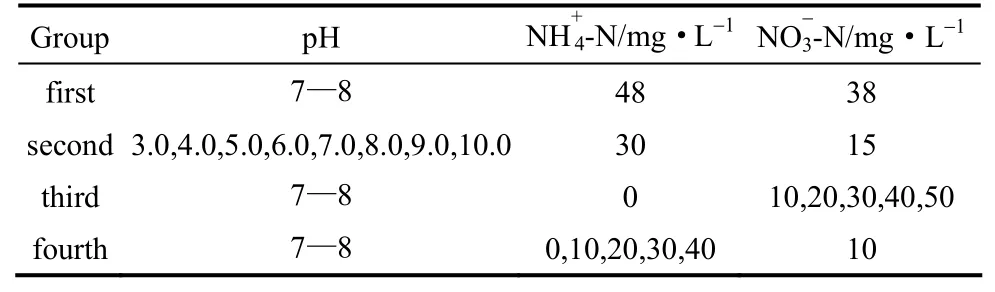
表1 试验用水水质 Table 1 Water quality of experiment
1.5 试验原理
自制化学催化载体对地下水中氨氮和硝酸盐氮的去除原理可概括为:载体的原电池反应、双金属催化还原反应和絮凝沉淀等。
原电池反应所产生的Fe2+与[H]等具有很强的还原性,能还原硝酸盐氮。但是,普通零价铁地下水脱氮主要由Fe0提供还原所需的电子,而该自制化学催化载体由于含有微量多元金属元素,产生了双金属的催化作用,促进Fe2+参与硝酸盐氮的还原反应,使得反应更加迅速和激烈。
自制化学催化载体在水中形成的阳极、阴极主要反应如下。
阳极的主要反应式为
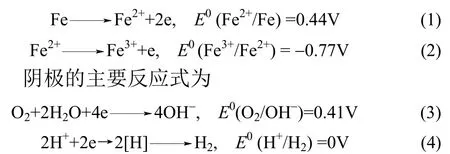
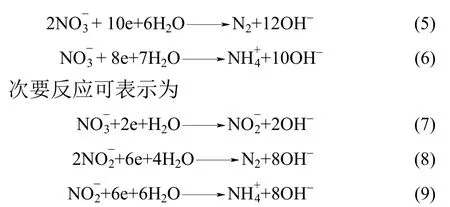
反应产生的大量新生态的[H]与Fe2+均具有很强的还原作用,可以还原溶液中的硝酸盐,生成氨氮或者氮气。主要反应式可表示为
此外,阴极反硝化是产碱反应,阳极产生的铁离子会与OH-反应生成Fe(OH)2或Fe(OH)3,对溶液中的其他物质有絮凝沉淀作用。
2 试验结果与讨论
2.1 自制化学催化载体脱除地下水中硝酸盐氮效能的影响因素
2.1.1 停留时间对载体脱氮的影响 设置试验用水pH=7~8,氨氮48 mg·L-1,硝酸盐氮38 mg·L-1,停留时间分别为10 min、20 min、30 min、1 h、2 h、3 h、4 h进行试验,试验结果如图3所示。

图3 停留时间对氮素浓度的影响 Fig.3 Effect of retention time on nitrogen content
由图3可知,水中硝酸盐氮的含量随停留时间而下降,10 min时的去除率为20.9%,1 h时为71.7%,2 h时约为90%,4 h达到98%以上,停留时间大于4 h时硝酸盐氮的去除率已趋于稳定。而水中氨氮的含量随停留时间变化先减少后增多。反应前60 min,氨氮含量不断减少,接近10.5%,从60 min开始氨氮含量缓慢升高,趋于原水中氨氮的含量。
分析认为:该反应在前1 h内脱氮迅速,优于一般零价铁反应[12,15],主要原因是自制化学催化载体有较大的比表面积,颗粒中均匀分布的Fe和C能够形成大量微小的原电池加快电子传递,同时载体中添加的多元微量催化金属元素可以在铁表面形成高还原电位的双金属系统[19],提高铁的还原活性,降低了反应所需的活化能,提高了脱氮效率,随着时间的延长,水中硝酸盐氮的含量大量减少,其扩散到载体表面的速度降低,降解速率减慢。对氨氮而言,反应初期,由于原水中氨氮浓度较高,有部分氨氮被原电池反应所生成的活性氧化体氧化,使得初期氨氮含量下降。而硝酸盐氮的去除有部分被还原成氨氮[式(6)],因此水中氨氮含量又会缓慢增加,逐渐趋于稳定,故可认为载体对氨氮的去除与硝酸盐氮转化为氨氮的量趋于平衡。
2.1.2 pH对载体脱氮的影响 pH是影响载体脱氮效能的重要因素,根据Tang等[20]对零价铁与硝酸盐氮反应的研究,初始pH会影响零价铁的脱氮效率。本试验探究了pH对自制化学催化载体脱氮效能的影响。将试验用水pH分别调为3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0,停留时间为4 h,试验用水水质为:氨氮30 mg·L-1,硝酸盐氮15 mg·L-1。实验结果见图4。
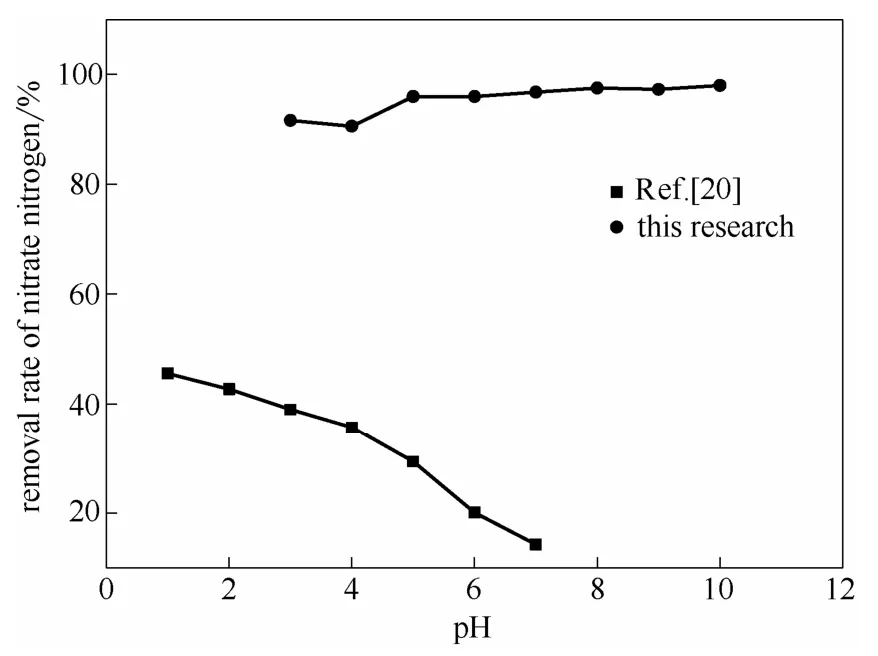
图4 pH对硝酸盐氮去除率的影响 Fig.4 Effect of pH on nitrate nitrogen removal rate
由图4可知,不同pH下,自制化学催化载体对硝酸盐氮的去除率可达到90%以上,说明pH对水中硝酸盐氮的去除率影响较小。
根据Tang等[20]的研究,零价铁与硝酸盐氮的反应为酸促反应,pH越低越有利于硝酸盐氮的还原。酸性条件下,氢离子浓度越高,阴极电位越正,此时体系中产生的原电池的电动势越大,生成的Fe2+和[H]的数目也就越多,对硝酸盐氮的去除率相应随之升高,但是溶液中的Fe2+和Fe3+浓度随着反应进行也逐渐升高。而图4显示,自制的载体在碱性条件下同样具有很好的处理效果。根据Ottley等[21]的研究,在中性偏碱(pH为7.0~8.5)的条件下,加入Cu(Ⅱ)为催化剂,可改善Fe2+的还原活性,从而提高硝酸盐氮的脱除效果。因此自制载体区别于单一的零价铁以及铁碳的简单组合,其中的微量多元金属元素起到了催化反应的作用。除此之外,该载体较大的比表面积也能加快反应的速率。因此自制化学催化载体原电池反应迅速而且强烈,受进水pH的影响较小,即使碱性条件下也不影响原电池反应的正常进行。而且由于Fe2+和Fe3+在 pH分别为8和3时已开始沉淀,因此利用自制化学催化载体脱氮,溶液中不存在Fe2+和Fe3+的积累,经多次检测出水中总铁含量均在0.3 mg·L-1以下。
利用自制载体对地下水脱氮时,不需要调节地下水的pH,优于一般零价铁的脱氮方法。
2.1.3 原水水质对载体脱氮的影响 将试验分为两组,第1组原水pH为7~8,反应时间为4 h,原水中仅有硝酸盐氮时,调节硝酸盐氮浓度分别为10、20、30、40、50 mg·L-1,考察进水硝酸盐氮浓度对自制化学催化载体脱氮效能的影响;第2组原水pH为7~8,反应时间为4 h,原水中硝酸盐氮浓度为10 mg·L-1,调节氨氮浓度分别为0、10、20、30、40 mg·L-1,考察水中氨氮与硝酸盐氮的比例对自制化学催化载体脱氮效能的影响。

图5 原水水质对脱氮效能的影响 Fig.5 Effect of raw water quality on nitrogen removal rate(Δ-N/-N is the percentage of ammonia nitrogen increasing and reduction nitrate nitrogen)
实验结果如图5所示。第1组进水中硝酸盐氮含量的升高,对硝酸盐氮的去除率影响不明显,分别为91.1%,93.1%,93.4%,97.6%,96.8%,;第2组水中氨氮含量的升高,对硝酸盐氮的去除率有影响,但仍保持在90%以上。两组试验均未发现有亚硝酸盐氮的产生。分析原因是硝酸盐氮被还原为氮气或者氨氮,在4 h的停留时间下,基本能够完全反应,原水水质对硝酸盐氮的去除效率影响较小。
根据图5,比较两组实验反应前后氨氮的变化可知,当原水仅含硝酸盐氮时[图5(a)],随着原水硝酸盐氮含量的升高,还原产物中氨氮的比例逐渐降低。当原水中硝酸盐氮浓度不变(10 mg·L-1)且含有氨氮时[图5(b)],随着氨氮含量的升高,还原产物中氨氮的比例降低。分析认为,由于硝酸盐氮的还原反应中同时生成氮气和氨氮,而氨氮的存在可抑制硝酸盐氮向氨氮的转化。在第1组试验中,随着硝酸盐氮浓度的升高,反应初期产生的氨氮抑制了后期硝酸盐氮还原生成氨氮,所以导致还原产物中氨氮的比例降低;在第2组试验中,氨氮初始浓度愈高,抑制作用愈明显,还原产物中氨氮的含量愈低。
2.2 氨氮浓度对脱氮效能的影响机制
由图5可知,氨氮可抑制原电池反应的脱氮效能。
氨氮对脱氮的抑制作用与反应进行的方向有关。硝酸盐氮的降解途径主要有两种,分别产生氮气与氨氮,如式(5)、式(6)所示。
当溶液中不含氨氮时,由于该自制化学催化载体的反应迅速,为反应提供了大量的还原物质,因此硝酸盐氮以反应(6)为主,硝酸盐氮主要被还原为氨氮。然而当溶液中有氨氮存在时,可抑制反应(6)向右进行,使得反应(5)成为主要反应,硝酸盐氮主要被还原为氮气。
在第1组试验中,当原水硝酸盐氮含量较低时,产生的氨氮也较少,氨氮抑制的作用不明显;而当原水硝酸盐氮含量升高到40 mg·L-1时,由于原水中不存在氨氮,前期反应以式(6)为主。当氨氮积累到一定水平时,氨氮抑制了反应(6)的进行,使硝酸盐氮沿着式(5)的反应进行。同样在第2组试验中,由于原水中存在氨氮,所以氨氮在反应初期就表现出一定的抑制作用,并且随着氨氮含量的升高抑制越明显。当氨氮初始浓度达到40 mg·L-1时,反应伊始,便由于大量氨氮的存在而彻底抑制了反应(6)的发生,使得硝酸盐氮完全转化为氮气。
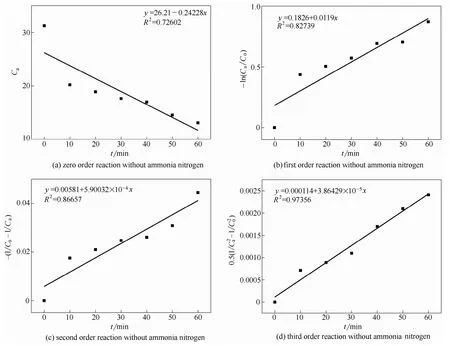
图6 不同反应级数线性回归分析 Fig.6 Linear regression analysis of different reaction series
利用线性回归探究该反应的降解速率方程,可分别计算出不同时间的硝酸盐氮的Ca、-ln(Ca/C0)、-(1/C0-1/Ca)、0.5(1/Ca2-1/C02),其中C0为硝酸盐氮的初始浓度,Ca为t时间硝酸盐氮的剩余浓度。根据Ca-t数据,以Ca、-ln(Ca/C0)、-(1/C0-1/Ca)、0.5(1/Ca2-1/C02)对时间t作图,再按零级、一级、二级、三级反应的反应动力学方程式用回归方法计算相关系数。
试验结果及各级反应的线性关系系数见图6。其中,零级反应(a)、一级反应(b)、二级反应(c)和三级反应(d)拟合的相关性系数分别为0.726、0.827、0.867、0.974。由此得出,采用三级反应动力学方程来拟合原电池反应中硝酸盐氮的降解反应过程动力学线性相关性最好。
因而,硝酸盐氮的降解速率方程为
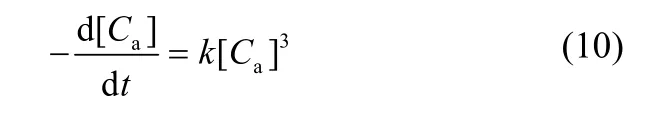
氨氮与硝酸盐氮按不同比例(2:1、2.5:1、3:1)反应的结果,用三级反应动力学方程拟合,结果如图7所示。
计算出的反应系数对应为0.00043、0.00118、0.00433,可以得出,随氨氮浓度与硝酸盐氮浓度比值的增高,反应系数减小,硝酸盐氮降解的速率降低,进一步证明实验中氨氮抑制硝酸盐氮降解,并且氨氮浓度越高,抑制作用越强。因此,在脱氮处理的过程中可以通过控制氨氮与硝酸盐氮的比例来实现还原产物的选择,进而实现高效脱氮。实际应用中可考虑与微生物硝化反应结合,或将化学催化载体作为生物载体,将化学催化与微生物硝化反应耦合实现地下水中氨氮和硝酸盐氮的同步脱除[16]。
3 结 论
(1)自制化学催化载体在120 min内,可去除地下水中90%的硝酸盐氮,与普通零价铁脱氮相比脱氮更为迅速;在去除硝酸盐氮的过程中不受水质pH的限制,不但在酸性条件下,在中性或碱性条件下,去除率仍可达到90%;原水水质对硝酸盐氮的最终还原产物有显著影响,氨氮、硝酸盐氮含量越高,还原产物中氨氮所占比值越低。
图7 不同水质对反应速率系数的影响 Fig.7 Effect of different water quality onreaction ratio
(2)模拟地下水中氨氮的含量随时间的变化先 减少后增加,60 min前氨氮减少近10.5%,60 min后氨氮含量缓慢升高。对氨氮的去除与硝酸盐氮的转化最终趋于平衡。
(3)水中氨氮可以抑制硝酸盐氮向氨氮的转化,并促进氮气的生成。通过反应动力学方程式的线性拟合,硝酸盐氮降解反应为三级反应,且反应速率随着水中氨氮含量的升高而降低。因此,可以通过调整氨氮与硝酸盐氮的比例促使硝酸盐氮向氮气的转化,实现高效脱氮。
(4)自制化学催化载体是通过原电池反应、双金属催化还原和絮凝沉淀等作用,且在Fe2+与[H]的共同作用下将水中硝酸盐氮还原为氮气,从而实现脱氮。
[1] Kobus H.Soil and groundwater contamination and remediation technology in Europe//Sato K, Iwasa Y.Groundwater Updates[M].Hongkong: Best-set Typesermr Ltd., 2000: 3-8.
[2] Agrawal G D, Lunked S K, Malkhed T.Diffuse agricultural nitrate pollution of groundwater in Indian [J].Water Science Technology, 1999, 39(3): 65-75.
[3] Haruvy N, Hadas A, Ravina I, Shalhevet S.Cost assessment of groundwater pollution [J].Water Science Technology, 2000, 42(1/2): 135-140.
[4] Ma Hongbin, Li Xiaoxin, Hu Chunsheng.The research of Chinese groundwater nitrate pollution status [J].Chinese Journal of Soil Science, 2012, 43(6): 1532-1536.
[5] Zhang Liya, Zhang Yizhang, Zhang Yuan, Meng Wei, Liu Xiangchang, Wan Jun.Hun river basin surface water and groundwater nitrogen pollution characteristics research [J].China Environmental Science, 2014, 34(1): 170-177.
[6] Gao Yangjun, Zhang Naiming.Analysis of current situation of groundwater nitrate pollution in Dianchi River Basin [J].Yunnan Geographic Environment Research, 2003, 15(4): 39-42.
[7] Graham Law, Roger Parslow, Patricia Mckinney, Ray Cartwright.Non-Hodgkin’s lymphoma and nitrate in drink water: a study in Yorkshire, United Kingdom [J].Epidemiology Community Health, 1999, 53: 383-384.
[8] Jennifer H Barrett, Roger C Parslow, Particia A Mckinney, Graham R Law, David Froman.Nitrate in drinking water and the incidence of gastric, esophageal, and brain cancer in Yorkshire, England [J].Cancer Causes and Control, 1998, 9: 153-159.
[9] Ann Marie Kocher, Nathan S Bryan, Joseph Loscalzo.Nitrite and Nitrate in Human Health and Disease[M].Humana Press Inc., 2011.
[10] Wisniewski C, Persin F, Cherif T.Denitrification of drinking water by the association of an electrodialysis process and a membrane bioreactor: feasibility and application [J].Desalination, 2001, 139: 199-205.
[11] Li Debin, Zhang Qi, Song Xu.Present situation and main nitrogen removal method of three kind of nitrogen pollution in groundwater [J].Environment and Sustainable Development, 2009(5): 35-37.
[12] Liao C H, Kang S F, Hsu Y W.Zero-valent iron reduction of nitrate in the presence of ultraviolet light, organic matter and hydrogen peroxide [J].Water Res., 2003, 37(17): 4109-4118.
[13] Zhou Jian, Chen Bo, Chen Yao, Long Tengrui, Hu Bin.Iron carbon micro electrolysis process on high nitrate nitrogen removal efficiency of pharmaceutical wastewater [J].China Water & Wastewater, 2011, 27(9): 78-80.
[14] KeY S, Li Q X.Reduction of nitroaromatic pesticides with zero-valentiron [J].Chemosphere, 2004, 54: 255-263.
[15] Oh S Y, Chiu P C, Kim B J, et al.Zero-valentiron pretreatment for enhancing the biodegradability of RDX [J].Chemosphere, 2005, 39: 5027-5032.
[16] Li Desheng.Biological particulate carrier and its preparation method directly disposing ammonia nitrogen fromaerobic low carbon nitrogen ratio wastewater[P]: CN, 2013100934115.2013-10-09.
[17] Ye Xuchun, Zhang Shitao, Song Xueliang, Zhang Zixiong, Mo Meixian, Li Changcai, Jin Deshan, He Huaizhong, Sun Youguo.Distribution and pollution mechanism of shallow groundwater nitrogen in Kunming Basin [J].Journal of Soil and Water Conservation, 2007, 21(4): 185-189.
[18] The State Environmental Protection Administration of China (国家环境保护总局).Water and Wastewater Monitoring Analysis Method(水和废水监测分析方法) [M].4th ed.Beijing: China Environment Science Press, 2002.
[19] Wang Di.Study on removal of nitrate and nitrite in the groundwater ofreduced iron powder[D].Harbin: Northeast Forestry University, 2013.
[20] Tang Cilai, Zhu Yanfang, Zhang Zengqiang, Zhang Yingchao.Fe0removal of nitrate in soil water in Loess Area [J].Acta Scientiae Circumstantiae, 2007, 27(8): 1292-1299.
[21] Ottley C J, Davison W, Edmunds W M.Chemical catalysis of nitrate reduction by iron(Ⅱ) [J].Geoch in Cosmochin Acta, 1997, 61(9): 1819-1828.
