盐芥CAS基因的生物信息学分析及在盐胁迫下的表达
2015-08-20余璐璐曹中权刘龙山范崎黄格格
余璐璐 +曹中权 刘龙山 范 崎 黄格格 徐飞


摘要:盐芥(Thellungiella salsuginea)是一种新型的模式植物,具耐盐特性,但盐芥的抗盐机理仍不清楚。本研究对盐芥氰丙氨酸合酶(cyanoalanine synthase,CAS)基因进行了生物信息学分析,并检测了盐胁迫条件下CAS基因的表达变化。生物信息学分析表明,编码盐芥CAS合酶的基因含有9个外显子和8个内含子,CAS合酶偏酸性,主要定位于细胞质中起作用。启动子分析表明,盐芥CAS基因启动子上有多个盐胁迫响应元件。进一步的盐胁迫试验表明,盐芥植株在200 mmol/L NaCl胁迫条件下表现出较强的抗性,CAS基因受胁迫诱导上升。盐胁迫处理后9 h,CAS基因表达高出对照组材料2倍,氰化氢(HCN)含量被降低到较低水平。这些结果表明,CAS基因在盐芥胁迫应答反应中起重要作用。
关键词:盐芥;氰丙氨酸合酶;盐胁迫;基因分析;基因表达;生物信息学
中图分类号:Q945.78 文献标志码:A 文章编号:1002-1302(2015)07-0025-05
盐芥(Thellungiella salsuginea)是一种有花的盐生植物,与双子叶植物研究中所常用的模式植物拟南芥亲缘关系较近[1-2]。盐芥具有对高盐、干旱和低温等非生物胁迫极高的耐受能力,使得盐芥成为研究植物非生物逆境胁迫机理的理想材料[3-5]。据统计,全球拥有大面积盐渍地,这些土地未能被完全开发和利用[6]。我国盐渍土面积约1亿hm2,高盐环境严重地影响了植物的生长和发育,是造成作物减产的主要原因之一[6]。随着世界范围内可耕地日趋减少以及盐碱、干旱等极端气候状况的日趋严重,研究植物耐盐胁迫的分子机制,寻找有效改良植物耐盐性的方法,已经引起人们广泛关注,并已成为植物分子生物学的研究热点[7-8]。诸多研究表明,盐胁迫等逆境因子会诱导乙烯反应[9-10],乙烯反应的增强有助于植物减轻胁迫造成的伤害;所以,长期以来乙烯也被赋予“胁迫乙烯”之称。众所周知,乙烯的生物合成经蛋氨酸,在三磷酸腺苷(ATP)参与下,转变为S-腺苷蛋氨酸(S-adenosylmethionine,SAM),SAM 在ACC合成酶(ACC synthase,ACS)的作用下转化为1-氨基环丙烷1-羧酸(1-aminocyclopropane-1-carbox-ylic acid,ACC)和甲硫腺苷(5′-deoxy-5′ methylthioadenosine,MTA),ACC在ACC氧化酶(ACC oxidase,ACO)催化下产生乙烯[9]。值得注意的是,植物在产生乙烯的同时,会产生等量的氰化氢(hydrogen cyanide,HCN)[11]。HCN可抑制线粒体呼吸链中的细胞色素C氧化酶的活性,因而HCN对于生物体来说有很强毒性[11]。但是,植物具有产HCN并耐HCN的特性。一方面是因为植物体内存在一条由交替氧化酶(alternative oxidase,AOX)介导的抗氰呼吸途径(cyanide-resistance respiration pathway),可减轻HCN对呼吸链的抑制作用[12]。另一方面,HCN会诱导芥氰丙氨酸合酶(cyanoalanine synthase,CAS)的活性,从而将HCN降低到安全浓度范围内[13]。鉴于乙烯在盐胁迫响应中的重要作用,及CAS合酶与乙烯的密切关系,本研究以盐芥植株为材料,对CAS基因进行生物信息学分析,并检测盐胁迫条件下盐芥CAS基因的表达量,以期为进一步阐明盐芥的耐盐机理提供理论依据。
1 材料与方法
1.1 盐芥CAS基因生物信息学分析
盐芥CAS基因结构利用在线分析工具Gene Structure Display Server(GSDS,http://gsds1. cbi.pku.edu.cn/index.php)进行分析。氨基酸序列分析及同源进化树构建分别利用Vector NTI 11.5和MEGA 5.2软件进行。CAS基因亚细胞定位和蛋白成员理化性质分别使用WolfPSORT (http://psort.hgc.jp/)和ProtParam(http://web.expasy.org/protparam/)进行预测分析。基因启动子响应元件进行在线分析(http://www.dna.affrc.go.jp/PLACE/signalup.html)。
1.2 盐胁迫条件下盐芥CAS基因的表达分析
1.2.1 材料 盐芥种子来源于四川大学生命科学学院林宏辉教授实验室。盐芥种子春化后播种在含营养土和蛭石(1 ∶1)的培养基质上,同时施以1/2Hoagland营养液,培养 40 d 后幼苗用于试验。
1.2.2 盐胁迫处理 取6株长势一样的盐芥植株放置在平皿中,分为A、B 2组,然后用1/2Hoagland营养液适应培养 48 h。A组用200 mmol/L NaCl胁迫处理,B组为对照组。实时记录2组幼苗的生长情况。
1.2.3 盐芥总RNA的提取及基因表达分析 盐芥总RNA的提取采用Trizol(Invitrogen公司)试剂。总RNA逆转录为cDNA(TaKaRa公司试剂盒)后,荧光定量检测CAS基因表达量(引物设计如表1所示)。荧光定量PCR扩增使用TaKaRa公司的SYBR Premix Ex Taq试剂盒,每个循环扩增的目的基因片段通过SYBR-green Ⅰ荧光来检测,CT值用于检测目标基因的起始拷贝数,目标基因的相对含量通过相对CT值来表示,每组试验重复3次。Actin基因作为内参基因[14]。
1.2.4 氧化损伤检测分析 盐胁迫处理后,检测H2O2、丙二醛、电导率及失水率的变化情况。H2O2含量的测定参照 Velikova 等的方法[15]。丙二醛(MDA)含量、电解质渗漏和叶片失水率参照Xu等的方法[16]测定。
1.2.5 叶绿素含量检测 叶绿素含量的测定参照Kichtenchaler等的方法[17]:称取0.5 g叶片,用80%丙酮和少许 CaCO3 快速研磨成匀浆,然后用80%丙酮定容至20 mL;3 000 r/min 离心10 min,取上清液测定在470、646、663 nm处的吸光度(D)。
1.2.6 氰化氢含量检测 氰化氢(HCN)含量检测采用便携式气体检测器(GT901-HCN):植物材料在2 000 mL透明容器中密闭处理2 h后,用气体检测器检测浓度。
2 结果和分析
2.1 盐芥CAS基因的生物信息学分析
2.1.1 盐芥CAS基因结构分析 利用在线分析工具Gene Structure Display Server(GSDS,http://gsds1. cbi.pku.edu.cn/index.php)对盐芥CAS基因结构进行分析,结果表明CAS基因有9个外显子和8个内含子(图1)。
2.1.2 盐芥CAS蛋白同源比对及进化树构建 从NCBI找到20个已知CAS蛋白序列的物种,并与盐芥CAS蛋白序列进行同源比对分析,利用MEGA5.2软件构建系统进化树。从图2可以看出,盐芥CAS蛋白序列与芜菁、亚麻荠、拟南芥和烟草的CAS蛋白序列同源性较高,亲缘关系较近,进化处于同一分支。
2.1.3 盐芥CAS蛋白的亚细胞定位及理化性质分析 盐芥CAS蛋白亚细胞定位使用WolfPSORT(http://psort.hgc.jp/)进行预测,结果如图3所示:盐芥CAS蛋白主要定位于细胞质(预测比例达60.9%),其次是定位于线粒体和细胞核(预测比例均为13.0%),定位于过氧化物酶体和质膜的可能性较低,预测比例分别为8.7%和4.3%。使用ProtParam(http://web.expasy.org/protparam/)对盐芥CAS蛋白进行理化性质分析,结果如表2所示,盐芥CAS蛋白氨基酸长度为323个,分子量为34 364.8 u。从理论等电点数据来看,CAS蛋白偏酸性(pI=5.47)。此外,蛋白不稳定性分析显示,盐芥CAS蛋白的不稳定指数为26.54,未超过临界值(大于40被认为不稳定),表明CAS蛋白稳定性较好。另外,从表2所显示的平均亲水性来看,CAS的亲水性值为0.066,表明其是疏水性蛋白,不过数值并不太高,推测其应是微溶于水。
2.1.4 盐芥CAS基因的启动子分析 利用NCBI在线数据库找到CAS基因的基因编码区上游序列,共计2 032 bp;利用日本PLACE在线分析系统对获得的启动子序列进行分析,结果表明,盐芥CAS基因启动子具有大量的逆境胁迫响应相关的元件,包括W box、AGMOTIFNTMYB2、MYB1AT、TC rich元件等(图4)。
2.2 盐芥CAS基因在盐胁迫响应过程中的变化
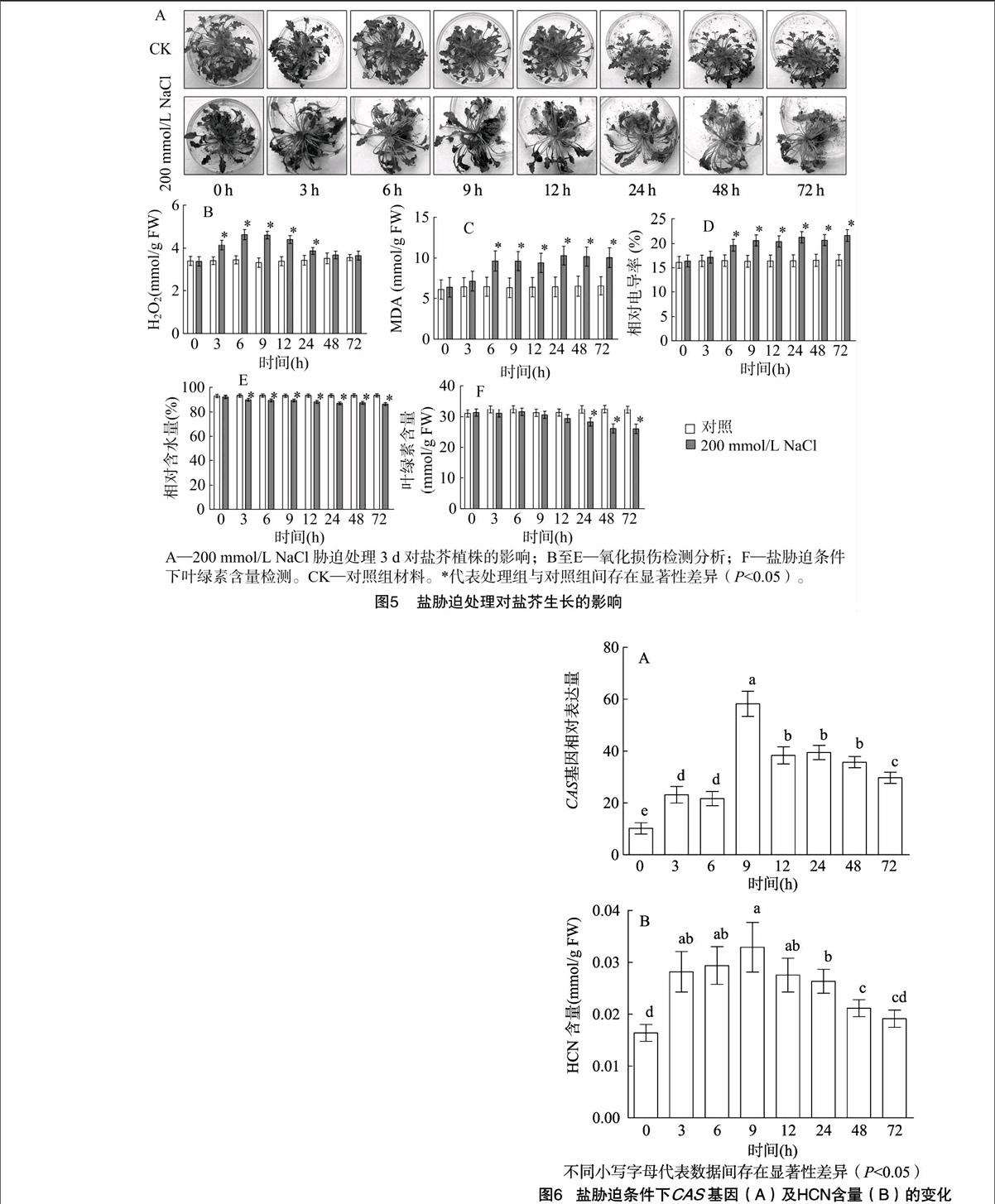
2.2.1 盐胁迫对盐芥生长的影响 在200 mmol/L NaCl胁迫处理12 h后,盐芥植株叶片开始卷曲,表现出明显的失水现象和一定的氧化损伤;但是,盐胁迫处理对盐芥叶绿素的合成影响较小,盐芥在胁迫处理条件下生长3 d,仍呈绿色状态,失水情况未进一步发生(图5),表明盐芥具有较强的耐盐性。
2.2.2 盐胁迫对盐芥CAS基因表达的影响 研究表明,盐胁迫处理能明显诱导CAS基因的表达(图6)。与对照组相比,200 mmol/L NaCl盐胁迫处理盐芥幼苗后,CAS基因的表达明显上升,尤其是在胁迫处理9 h后,CAS基因的表达量上升近2倍。由此推测,CAS基因参与了盐芥盐胁迫应答反应。
3 讨论
与拟南芥相比,盐芥耐贫瘠性强,生命力旺盛,根系强大;但到目前为止,盐芥的抗逆机理仍不是很清楚。本试验对盐芥CAS基因进行了生物信息学分析,并研究了盐芥CAS基因在盐胁迫条件下的表达变化,以期为进一步揭示盐芥对逆境胁迫的耐受机制奠定基础。通过生物信息学研究发现,盐芥CAS基因有9个外显子和8个内含子。启动子分析结果表明,CAS基因启动子上有较多与逆境胁迫响应相关的元件,包括 W-box、MYB响应元件等。由此推测,CAS基因可能参与了盐芥盐胁迫应答。CAS蛋白氨基酸长度为323个,分子量为34 364.8 u,蛋白偏酸性(pI=5.47),微溶于水。从蛋白作用部位来看,CAS蛋白主要作用部位为细胞质,其次为线粒体。鉴于CAS合酶是代谢植物HCN的关键酶,而HCN主要伴随乙烯的合成产生,我们推测CAS合酶与降低盐胁迫诱导乙烯合成过程中的HCN含量,及减轻HCN对线粒体呼吸
链的抑制作用有关。
试验结果表明,与对照组相比,盐芥在200 mmol/L NaCl胁迫条件下叶片表现出一定程度的损伤,H2O2、MDA和电解质渗漏都有明显上升,但整体生长状况良好,叶绿素含量仍维持在一个较高水平,表明盐芥具有较强的耐盐性。据报道,盐芥可以在500 mmol/L NaCl的高盐生境下完成生活史,耐盐能力远强于只能耐受100 mmol/L NaCl的拟南芥[18]。另有研究表明,盐芥对高盐的耐受性可能与盐芥具有苗期生长较旺、根系发达、叶肉致密等优点有关[14,19]。本研究发现,盐胁迫处理后,CAS基因的转录明显上升。盐胁迫处理9 h后,CAS基因的转录水平最高,高出对照组近2倍。García等研究表明,CAS合酶表达的上升有助于减少逆境胁迫引起的活性氧(ROS)累积,从而减轻氧化损伤,维持植物的正常代谢生长[20]。因此,本研究中CAS基因的诱导表达应该也是盐芥对盐胁迫高度适应的原因之一。
从HCN含量变化检测结果可以看出,在盐胁迫3 h后,HCN含量开始上升,在9 h后达到峰值,随后开始下降,并在48 h后接近处理前的水平。这些结果表明,CAS合酶受HCN的诱导,盐胁迫条件下CAS合酶表达量上升有助于减少细胞内HCN的积累,减轻HCN对细胞尤其是线粒体的损伤。但同时也可看出,HCN在盐胁迫处理3 d后,也没有完全恢复到处理前的水平,表明低浓度的HCN在盐芥盐胁迫应答过程中具有一定作用。Xu等研究表明,低浓度的HCN(20 μmol/L)有助于提高黄瓜幼苗抵御盐渍、干旱和冷害胁迫[12]。Seo等研究发现氰化物处理能提高水稻抵御真菌的侵害[21]。Liao等研究报道外施KCN能增强番茄对TMV的抗性[22]。此外,HCN被证实在种子萌发中起正调控的作用,还能作为氮源被植物吸收利用[23-24]。因此,进一步研究CAS合酶与HCN间的动态关系,将有助于揭示植物的耐盐机制。
总之,本研究表明盐芥具有较强的耐盐性,CAS基因在盐芥盐胁迫适应过程中受明显的诱导表达,CAS合酶通过有效降低HCN的浓度,保护线粒体呼吸链的正常运转。同时,低浓度的HCN可能在盐芥逆境胁迫应答过程中扮演着重要角色,但具体机制还需要更多的研究来证实。
参考文献:
[1]Wu H J,Zhang Z H,Wang J Y,et al. Insights into salt tolerance from the genome of Thellungiella salsuginea[J]. Proceedings of the National Academy of Sciences of the United States of America,2012,109(30):12219-12224.
[2]王新宇,于 涛. 盐芥耐盐机制的组学研究[J].现代农业科技,2012(20):228-229,232.
[3]Higashi Y,Ohama N,Ishikawa T,et al. HsfA1d,a protein identified via fox hunting using Thellungiella salsuginea cDNAs improves heat tolerance by regulating heat-stress-responsive gene expression[J]. Molecular Plant,2013,6(2):411-422.
[4]Pedras M,Zheng Q A. Metabolic responses of Thellungiella halophila/salsuginea to biotic and abiotic stresses:metabolite profiles and quantitative analyses[J]. Phytochemistry,2010,71(5/6):581-589.
[5]Taranov V V,Berdnikova M V,Nosov A V,et al. Cold shock domain proteins in the extremophyte Thellungiella salsuginea (salt cress):gene structure and differential response to cold[J]. Molecular Biology,2010,44(5):889-897.
[6]杨劲松. 中国盐渍土研究的发展历程与展望[J].土壤学报,2008,45(5):837-845.
[7]王宝山,赵可夫,邹 琦.作物耐盐机理研究进展及提高作物抗盐性的对策[J].植物学通报,1997(增刊1):26-31.
[8]李 彦,张英鹏,孙 明,等.盐分胁迫对植物的影响及植物耐盐机理研究进展[J].中国农学通报,2008,24(1):258-265.
[9]Abeles F B,Morgan P W,Saltveit Jr M E. Ethylene in plant biology[M]. New York:Academic Press,2012:56.
[10]Morgan P W,Drew M C. Ethylene and plant responses to stress[J]. Physiologia Plantarum,1997,100(3):620-630.
[11]Lee T C,Kalenius E,Lazar A I,et al. Chemistry inside molecular containers in the gas phase[J]. Nature Chemistry,2013,5(5):376-382.
[12]Xu F,Zhang D W,Zhu F,et al. A novel role for cyanide in the control of cucumber (Cucumis sativus L.) seedlings response to environmental stress[J]. Plant,Cell & Environment,2012,35(11):1983-1997.
[13]Yi H,Juergens M,Jez J M. Structure of soybean β-cyanoalanine synthase and the molecular basis for cyanide detoxification in plants[J]. The Plant Cell,2012,24(6):2696-2706.
[14]Gong Q Q,Li P H,Ma S S,et al. Salinity stress adaptation competence in the extremophile Thellungiella halophila in comparison with its relative Arabidopsis thaliana[J]. The Plant Journal,2005,44(5):826-839.
[15]Velikova V,Yordanov I,Edreva A. Oxidative stress and some antioxidant systems in acid rain-treated bean plants:protective role of exogenous polyamines[J]. Plant Science,2000,151(1):59-66.
[16]Xu F,Yuan S,Zhang D W,et al. The role of alternative oxidase in tomato fruit ripening and its regulatory interaction with ethylene[J]. Journal of Experimental Botany,2012,63(15):5705-5716.
[17]Kichtenthaler H K,Wellburn A R. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvent[J]. Biochemical Society Transactions,1983,603:591-593.
[18]Wang Z L,Li P H,Fredricksen M,et al. Expressed sequence tags from Thellungiella halophila,a new model to study plant salt-tolerance[J]. Plant Science,2004,166(3):609-616.
[19]Lugan R,Niogret M F,Leport L,et al. Metabolome and water homeostasis analysis of Thellungiella salsuginea suggests that dehydration tolerance is a key response to osmotic stress in this halophyte[J]. The Plant Journal,2010,64(2):215-229.
[20]García I,Castellano J M,Vioque B,et al. Mitochondrial beta-cyanoalanine synthase is essential for root hair formation in Arabidopsis thaliana[J]. The Plant Cell,2010,22(10):3268-3279.
[21]Seo S,Mitsuhara I,Feng J,et al. Cyanide,a coproduct of plant hormone ethylene biosynthesis,contributes to the resistance of rice to blast fungus[J]. Plant Physiology,2011,155(1):502-514.
[22]Liao Y W,Shi K,Fu L J,et al. The reduction of reactive oxygen species formation by mitochondrial alternative respiration in tomato basal defense against TMV infection[J]. Planta,2012,235(2):225-238.
[23]Ebbs S D,Kosma D K,Nielson E H,et al. Nitrogen supply and cyanide concentration influence the enrichment of nitrogen from cyanide in wheat (Triticum aestivum L.) and sorghum (Sorghum bicolor L.)[J]. Plant,Cell & Environment,2010,33(7):1152-1160.
[24]Gniazdowska A,Krasuska U,Bogatek R. Dormancy removal in apple embryos by nitric oxide or cyanide involves modifications in ethylene biosynthetic pathway[J]. Planta,2010,232(6):1397-1407.
