紫菜丝状体种质特性的ISSR分析
2015-08-20陈淑吟陆勤勤张美如许广平陈国耀
陈淑吟++陆勤勤+张美如+许广平+陈国耀

摘要:利用ISSR标记扩增分析多个紫菜丝状体种质材料,筛选获得条带稳定表达且清晰的30个引物,其中10个引物的扩增条带有种质特异性。利用这些ISSR引物分析不同种质的DNA指纹图谱,可为紫菜种质评价与分子标记鉴定提供依据。
关键词:紫菜;丝状体;ISSR;种质鉴定;DNA指纹图谱
中图分类号: S917.3 文献标志码: A 文章编号:1002-1302(2015)07-0017-03
紫菜属(Pyropia)为大型海产红藻类,全世界约134种,在我国分布约22种,其中条斑紫菜(P. yezoensis)与坛紫菜(P. haitanensis)为主要栽培种类,在海藻产业中占有重要经济地位。紫菜不同种类、不同品系种质的鉴定与分析是优良遗传资源利用的基础。紫菜属物种形态特征简单,易受环境影响,依靠传统形态性状难以准确鉴别,且随着育种材料遗传基础研究的不断深入及选育品种数目的日益增多,品种间差异越来越小。采用基于DNA水平的标记技术,有助于准确、直接获得不同种质间的遗传差异,将大量种质资源区分开来。由高多态性分子标记构建的指纹图谱如SSR、SRAP等标记方法[1-5]具有明显的个体特异性和环境稳定性,已广泛应用于大型海洋藻类的不同种质评价、鉴定或纯度分析中。ISSR标记的原理与SSR相似[6],其扩增位点具有丰富的等位变异性,是一种操作简便、成本较低的DNA标记方法,在植物品种鉴定、遗传作图、基因定位、进化与遗传多样性等方面有大量研究[7],在紫菜遗传特性、亲缘关系相关研究中也有不少报道[8-10]。本研究利用ISSR技术,对国家级紫菜种质库保有的一些优良种质资源进行遗传特性分析,构建这些种质的特征性DNA图谱,为紫菜种质的评价与分子标记鉴定提供依据。
1 材料与方法
1.1 样品材料与基因组总DNA提取
丝状体样品(表1),由江苏省海洋水产研究所国家紫菜种质库提供。取样品丝状体组织,用TaKaRa试剂盒(编号:DV811A)提取基因组总DNA,于4 ℃保存,备用。DNA浓度用加标准分子量电泳检测(图1)。
1.2 PCR扩增与图谱分析
ISSR引物为British Columbia大学公布的第9套引物,由上[CM(25]海生工合成;MgCl2、dNTP及Taq[KG*3]DNA 聚合酶等试剂为上[CM)]
海生工产品;250 bp DNA marker为TaKaRa产品(编号:D515A)。PCR反应在Biometra PCR仪上进行,先选取3个DNA模板分组进行100条引物的PCR扩增筛选;对模板、Mg2+、dNTP浓度、引物及退火温度等多个因子进行优化选择;选用优化后的参数进行扩增反应,反应体系为25 μL,内含Mg2+2.5 mmol/L、dNTP 0.25 mmol/L、引物0.5 mmol/L、约20 ng的DNA 模板和1.5 U Taq酶。PCR扩增反应程序为:94 ℃预变性5 min;94 ℃ 45 s,52 ℃ 45 s,72 ℃ 2 min,36个循环;72 ℃延伸10 min。所有引物采用同一PCR反应参数,扩增产物用1.2%琼脂糖凝胶电泳检测,凝胶中含定量的溴化乙锭(EB)。由紫外分析仪观察结果并拍照。在图谱中,以引物每一个相同迁移位置的DNA扩增带作为同一个位点,记为1,无带则为0,将DNA带的有无转化成(0、1)数据矩阵;利用NTSYS-pc version2.10e软件[11]计算样品间的遗传相似性系数(GS),用非加权组平均法(UPGMA)进行聚类分析。
2 结果与分析
2.1 引物筛选与紫菜丝状体的特异性扩增
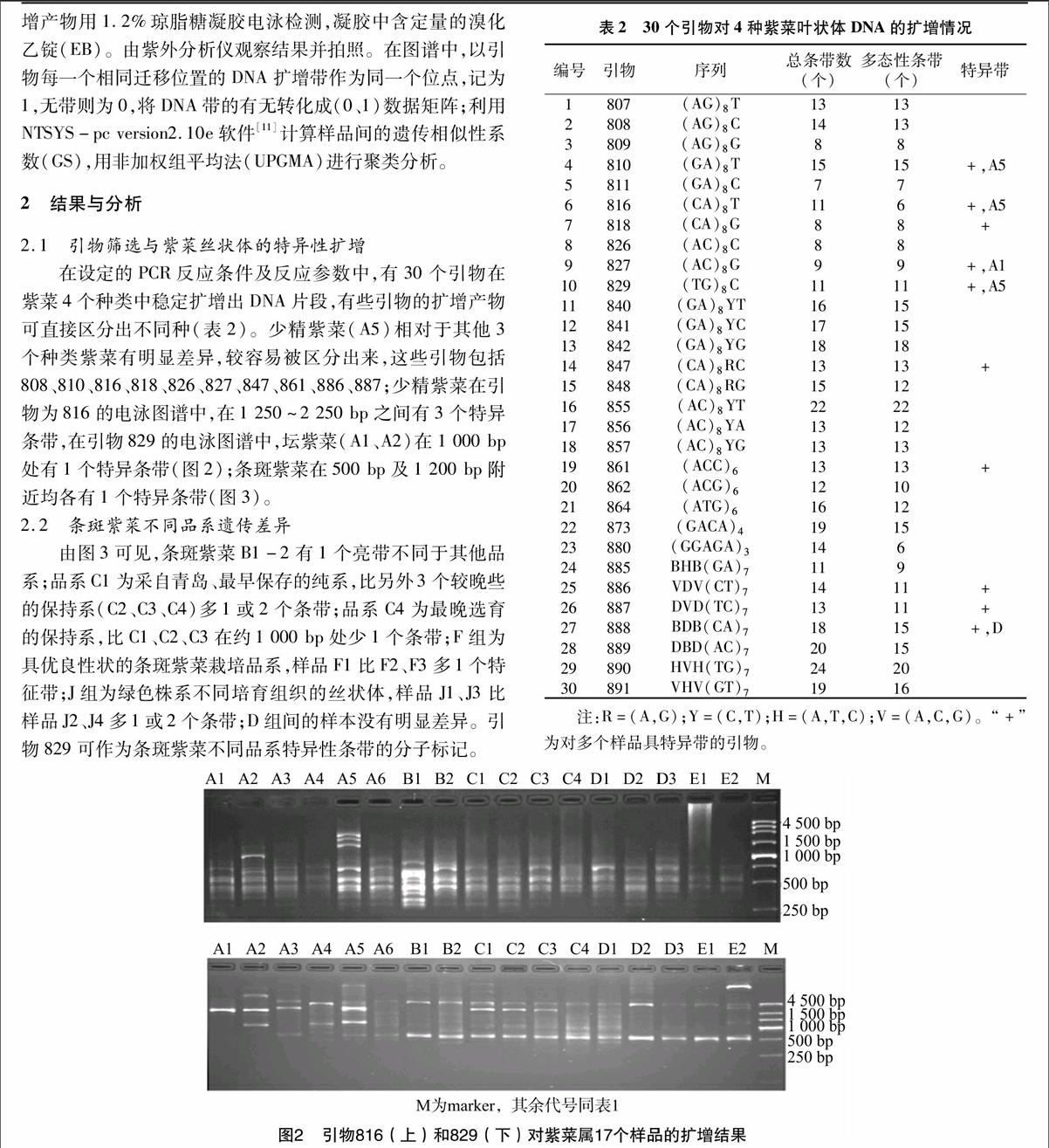
在设定的PCR反应条件及反应参数中,有30个引物在紫菜4个种类中稳定扩增出DNA片段,有些引物的扩增产物可直接区分出不同种(表2)。少精紫菜(A5)相对于其他3个种类紫菜有明显差异,较容易被区分出来,这些引物包括808、810、816、818、826、827、847、861、886、887;少精紫菜在引物为816的电泳图谱中,在1 250~2 250 bp之间有3个特异条带,在引物829的电泳图谱中,坛紫菜(A1、A2)在1 000 bp处有1个特异条带(图2);条斑紫菜在500 bp及1 200 bp附近均各有1个特异条带(图3)。
2.2 条斑紫菜不同品系遗传差异
由图3可见,条斑紫菜B1-2有1个亮带不同于其他品系;品系C1为采自青岛、最早保存的纯系,比另外3个较晚些的保持系(C2、C3、C4)多1或2个条带;品系C4为最晚选育的保持系,比C1、C2、C3在约1 000 bp处少1个条带;F组为具优良性状的条斑紫菜栽培品系,样品F1比F2、F3多1个特征带;J组为绿色株系不同培育组织的丝状体,样品J1、J3比样品J2、J4多1或2个条带;D组间的样本没有明显差异。引物829可作为条斑紫菜不同品系特异性条带的分子标记。
由图3、图4可见,引物888在条斑紫菜的多个种质也得到特异性表达条带,其中:D组品系间的谱带与引物829的有所不同,C组、J组品系间条带表达与829的相一致;D1组样品来自日本,其扩增结果不同于南通产区的D2、D3及D4,后三者条带表达基本一样,均在500~1 000 bp之间相同位置有3条亮带;J1与J3条带一样,J2与J4结果相近,这与用引物829扩增的结果基本一致;F组中的3个优选栽培品系谱带均各有特异性表达。
2.3 遗传相似性与聚类分析[JP2]
由图5可见,在4种紫菜中,南方的坛紫菜与华北的半叶紫菜遗传相似性为0.735 4,少精紫菜与条斑紫菜为0.705 8,条斑紫菜与坛紫菜、少精紫菜与半叶紫菜的遗传距离相对较远,这与崔灵英等的结论[8]相似;条斑紫菜种内各种质虽聚于一起,但样品间的相似度相差较大,来自南通同一海域的优选育种材料16号与17号样品具有最大遗传相似性,系数为0960 8,其次是10号与17号、6号与9号,相似系数分别为0921 6、0901 9。
3 结论与讨论
在同一反应条件下,30个有稳定扩增条带的引物中有10[FL)]
个引物获得特异性表达,以829、888等不同引物对同一种质、同一引物对不同种质扩增可以产生不同的特异性条带,并得到多个种质的扩增图谱。在这些图谱中,不同种类或品系有独一的指纹模式,用引物816、829可区分出少精紫菜、坛紫菜;针对27个条斑紫菜,引物829、888可用于条斑紫菜种内多个品系鉴定。样品F3为显示条斑紫菜形态性状的杂交品系,ISSR扩增图谱也多与条斑紫菜一致,这表明该标记既可构建特异性图谱,也可反映种质属性。有研究报道,部分引物如812、830、834、850、859、866、878、881、895等可以得到扩增产物[7],但由于试验条件或试验参数等原因,本试验未能获得相应的PCR产物,因此,充分优化试验参数、规范试验操作,才有助于构建可供比较的指纹图谱模式。
ISSR标记由于引物中带有锚定碱基,既有高多态性又有较高稳定性,通过单个或多个引物组合使用,即能得到可靠的结论。在一些其他大型海藻种质资源研究中,ISSR方法已是常用的研究方法之一[12-14],笔者所在实验室也用该方法评价了三疣梭子蟹(Portunus trituberculatus)、西施舌(Coelomactra antiquata)及大黄鱼(Pseudosciaena crocea)等[15-17]海产经济动物的遗传资源状况,并结合应用DNA序列等标记技术,检测了ISSR方法的可靠性。笔者在探索简便易行的种质鉴定方法时,利用ISSR已得到多个条斑紫菜品系的独一指纹图谱[18],这些DNA指纹标记,在资源的交换与引种等过程中可作为其品种身份信息的一个内容。
国家级紫菜种质库收集有大量野生紫菜种质资源,并选育获得多个优良种质材料,如何更有效地探究这些资源的遗传多样性,有选择地把优良的遗传变异性状引入到栽培品种中,DNA指纹图谱的构建无疑将为这些种质的鉴定与利用提供帮助。目前,国际植物品种权保护联盟(UPOV) 已将DNA指纹图谱鉴定纳入农作物品种DUS测试内容[19-20]。当然,在采用ISSR 标记构建DNA指纹图谱时,应力求简化、规范试验操作程序及遗传分析方法,保证试验数据的稳定性和可重复性,使构建的指纹图谱更具有可操作性。
[HS2*2][HT8.5H]参考文献:
[1]吴文婷,张 磊,宋志民,等. 5个紫菜属物种丝状体的微卫星初步遗传分析[J]. 南方水产科学,2012,8(4):29-36.
[2]Kong F N,MaoY X,Yang H,et al. Genetic analysis of Porphyra yezoensis using microsatellite markers[J]. Plant Molecular Biology Reporter,2009,27(4):496-502.
[3]Xie C T,Chen C S,Xu Y,et al. Construction of a genetic linkage map for Porphyra haitanensis (Bangiales,Rhodophyta) based on sequence-related amplified polymorphism and simple sequence repeat markers[J]. Journal of Phycology,2010,46(4):780-787.
[4]贾 威,黄林彬,严兴洪. 条斑紫菜6个品系的SRAP分析[J]. 水产学报,2013,37(10):495-1501.
[5]孙 雪,骆其君,杨 锐,等. 紫菜(Porphyra)遗传差异的ISSR分析[J]. 海洋与湖沼,2007,38(2):141-145.
[6]Zietkiewicz E,Rafalske A,Labuda D. Genome fingerprinting by simple sequence repeat (SSR) anchored polymerase chain reaction amplification[J]. Genomics,1994,20(2):176-183.
[7]王建波. ISSR分子标记及其在植物遗传学研究中的应用[J]. 遗传,2002,24(5):613-616.
[8]崔灵英,许 璞,朱建一,等. 四种紫菜叶状体的ISSR分子标记分析[J]. 中国水产科学,2006,13(3):371-377.
[9]袁昭岚,黄鹤忠,沈颂东,等. 条斑紫菜5个栽培品系的ISSR分析[J]. 海洋科学,2006,30(7):9-14.
[10]陈昌生,谢潮添,纪德华,等. 野生坛紫菜种群遗传多样性的ISSR分析[J]. 水产学报,2008,32(5):717-723.
[11]Rohlf F J. NTSYS-pc:numerical taxonomy and multivariate analysis system version 2.1[M]. New York:Exeter Publications,2000.
[12]李文红,姚建亭,王继成,等. 龙须菜(Gracilaria lemaneiformis) 选育品系及其野生型的ISSR指纹分析[J]. 海洋与湖沼,2005,36(3):241-247.[HJ1.85mm]
[13]刘晨临,王秀良,刘胜浩,等. 2008年黄海浒苔绿潮ISSR标记溯源分析[J]. 海洋科学进展,2011,29(2):235-240.
[14]张 婷,时 旭,何建华,等. 麒麟菜属和卡帕藻属海藻的ISSR初步分析[J]. 海洋学报,2011,33(3):173-178.
[15]陈淑吟,吉红九,丁亚平,等. 吕四渔场三疣梭子蟹自然群体同工酶与ISSR遗传多样性分析[J]. 上海水产大学学报,2008,17(4):406-410.
[16]孙中响,吉红九,陈 葵,等. 西施舌不同群体遗传多样性ISSR分析[J]. 江苏农业科学,2010(8):59-63.
[17]陈淑吟,徐士霞,张志勇,等. 大黄鱼野生群体与养殖群体遗传多样性研究[J]. 海洋科学,2011,35(12):82-87.
[18]陈淑吟,陆勤勤,张美如,等. 条斑紫菜(Pyropia yezoensis)10个选育系的ISSR分析[J]. 天津农业科学,2012,18(5):19-23.
[19]谢潮添,陈昌生,纪德华,等. 坛紫菜种质材料DNA指纹图谱的构建[J]. 水产学报,2010,34(6):734-740.
[20]张肖娟,孙振元. 植物新品种保护与DUS测试的发展现状[J]. 林业科学研究,2011,24(2):247-252.
