外源腐胺和精胺对弱光胁迫下黄瓜叶片可溶性糖含量的影响
2015-08-20徐心诚
徐心诚

摘要:以黄瓜品种中农118和冬棚丰冠为试验材料,研究了外施腐胺和精胺对弱光下黄瓜叶片可溶性糖、蔗糖、果糖和葡萄糖含量的影响。结果表明:与自然光照对照相比,弱光下黄瓜叶片可溶性糖、蔗糖、果糖和葡萄糖含量降低;叶面喷施1 mmol/L腐胺与单纯弱光处理相比,黄瓜叶片可溶性糖、蔗糖和果糖含量明显升高,但葡萄糖含量下降明显;施加外源精胺(0.3、0.9 mmol/L)后,果糖、葡萄糖、蔗糖以及可溶性总糖含量均有不同程度上升。
关键词:多胺;弱光胁迫;黄瓜;可溶性糖
中图分类号: S642.201 文献标志码: A 文章编号:1002-1302(2015)07-0130-04
黄瓜(Cucumis sativus)也称胡瓜、青瓜,属葫芦科植物,一年生草本植物。植株柔嫩,茎细长,有分枝,茎上生有分枝的卷须,藉此缘架攀爬。叶掌状,大而薄,叶缘有细锯 齿。花通常为单性,雌雄同株,瓠果。果面光滑或具白、褐或黑色的瘤刺。种子扁平,长椭圆形,种皮浅黄色。黄瓜果实性凉,味甘,具有清热解毒、利水消肿和生津解渴的功效,主治五心烦热、咽喉肿痛、风热眼疾、湿热黄疸、气机郁滞等病症。黄瓜在我国已有2 000多年的历史,无论是过去还是现在黄瓜在我国蔬菜生产和消费中占有非常重要的地位[1]。黄瓜是我国普遍栽培的一种大众化蔬菜,其适应性广且产量高,备受人们青睐[2]。近年来,随着我国设施园艺业的发展,日光温室发展十分迅速,截至2002年年底,我国黄瓜栽培面积已达 125万hm2,节能日光温室面积约为17%,玻璃日光温室约为2%[3],因此,黄瓜的产量和品质对于“菜篮子工程”起着重要影响。
在我国冬春保护地黄瓜栽培中,弱光是影响黄瓜品质和产量的一个主要限制因素。所谓弱光是指环境光强持久或短时间显著低于植物光饱和点,但不低于限制其生存的光补偿点[4]。光照不足常影响其生长发育[5],冬季温室黄瓜生长若遇弱光,常使黄瓜生长停止、叶片反卷、沤根,严重时造成绝产[6]。目前弱光对黄瓜发育影响的研究已有报道,但在弱光条件下外施多胺对黄瓜可溶性糖含量的影响报道尚少。
生物体氮代谢过程中会产生一类物质,其为一类低分子量脂肪族含氮碱[7],这种具有生物活性的物质称为多胺。高等植物中的多胺主要存在于分生组织中,有助于细胞分裂、分化和防止衰老的作用,包括腐胺(putrescine,Put)、亚精胺(spermidine,Spd)、尸胺(cadaverine)和精胺(spermine,Spm)。腐胺是亚精胺和精胺合成的前体[8],也是多胺生物合成途径的中心。在一定程度上外施适量浓度多胺可以减轻盐、渗透、高温、低氧等逆境胁迫对植物的伤害。多胺参与了植物生长和发育的多种生理及生化过程[9-12],并且也参与膜稳定性、渗透调节[13-18]等的调控,在植物对不良环境的适应中起到保护作用[14,18],但多胺对植物耐弱光性的调节机制尚未阐明。本试验以生产中主栽黄瓜品种中农118号和冬棚丰冠为材料,研究了外源腐胺和精胺对弱光下黄瓜叶片中可溶性糖、蔗糖、葡萄糖和果糖含量的影响,探讨精胺对黄瓜耐弱光性的调节作用,以期为腐胺和精胺在冬季温室黄瓜栽培上的应用提供理论参考。
1 材料与方法
1.1 供试材料
本试验所使用的黄瓜品种为中农118和冬棚丰冠。中农118由中国农业科学院蔬菜花卉研究所提供,冬棚丰冠由陕西西安三星种苗有限公司提供。
1.2 试验设计
共设6个处理:(1)对照组,正常光照,记为CK;(2)弱光胁迫组,正常光照的25%;(3)弱光+Put处理组,在25%光照胁迫下,用1 mmol/L Put处理;(4)弱光+0.3 mmol/L Spm处理组,在25%光照胁迫下,用0.3 mmol/L Spm处理;(5)弱光+0.9 mmol/L Spm处理组,在25%光照胁迫下,用 0.9 mmol/L Spm处理。
处理方法:弱光胁迫组采用遮光率为75%的3针中密度型黑色遮阳网(新槐花卉园艺公司生产)覆盖;Put和Spm处理组的遮光处理与胁迫组相同,同时采用叶面喷施法,每天喷施1次Put或Spm,喷施时加0.01%表面活性剂Tween-20,叶片正反面均匀喷施;对照组同时喷施等体积的水。每组处理重复3次。
测定:处理第9天,采用分光光度比色法测定各组黄瓜植株叶片中可溶性总糖、蔗糖、果糖和葡萄糖等的含量。
1.3 提取及含量测定
1.3.1 提取液的制备 将黄瓜叶片烘干,称取50 mg干样品粉末,倒入10 mL刻度试管,加入4 mL 80%乙醇,置于 80 ℃ 水浴振荡保温40 min,冷却后于4000 r/min离心3 min(以离心效果为考量标准),收集上清液,其残渣加2 mL 80%乙醇重复提取2次,合并上清液。在上清液中加入20 mg活性炭,80 ℃脱色30 min(脱色过程中摇动),定容至10 mL,过滤后取滤液即提取液。用该提取液分别进行可溶性总糖、蔗糖、果糖、葡萄糖含量的测定。
1.3.2 可溶性糖含量测定 采用蒽酮比色法[15]。取1 mL提取液,加入2.5 mL蒽酮试剂,在90 ℃下保温15min,取出后迅速冷却。由于可溶性糖能与蒽酮发生化学反应,产生蓝绿色的复杂化合物,其颜色越深说明含糖量越高。该蓝色化合物在620 nm波长处有最大吸收峰,利用这一特性进行D620 nm值比色测定。
1.3.3 蔗糖含量测定 采用蒽酮比色法,取1 mL提取液,加入25 μL 12 mol/L NaOH摇匀,100 ℃煮沸5 min,冷却加蒽酮,80 ℃ 水浴10 min,冷却,显色10 min,测定吸光度D620 nm。
1.3.4 果糖含量测定 采用蒽酮比色法,取1 mL提取液,加入2.5 mL蒽酮试剂,40 ℃保温10 min,冷却,显色10 min,测定吸光度D620 nm。endprint
1.3.5 葡萄糖含量测定 葡萄糖氧化酶专一性催化分子氧对葡萄糖的氧化,形成葡萄糖酸和过氧化氢。其中过氧化氢在过氧化物酶存在下和色原氢供体如邻-联茴香胺发生作用形成一种有色物质,可以进行比色测定[16],加酶制剂30 ℃水浴保温,酶液温度平衡后加1 mL提取液,保温5 min后加 5 mol/L 硫酸,测定吸光度D520 nm。
2 结果与分析
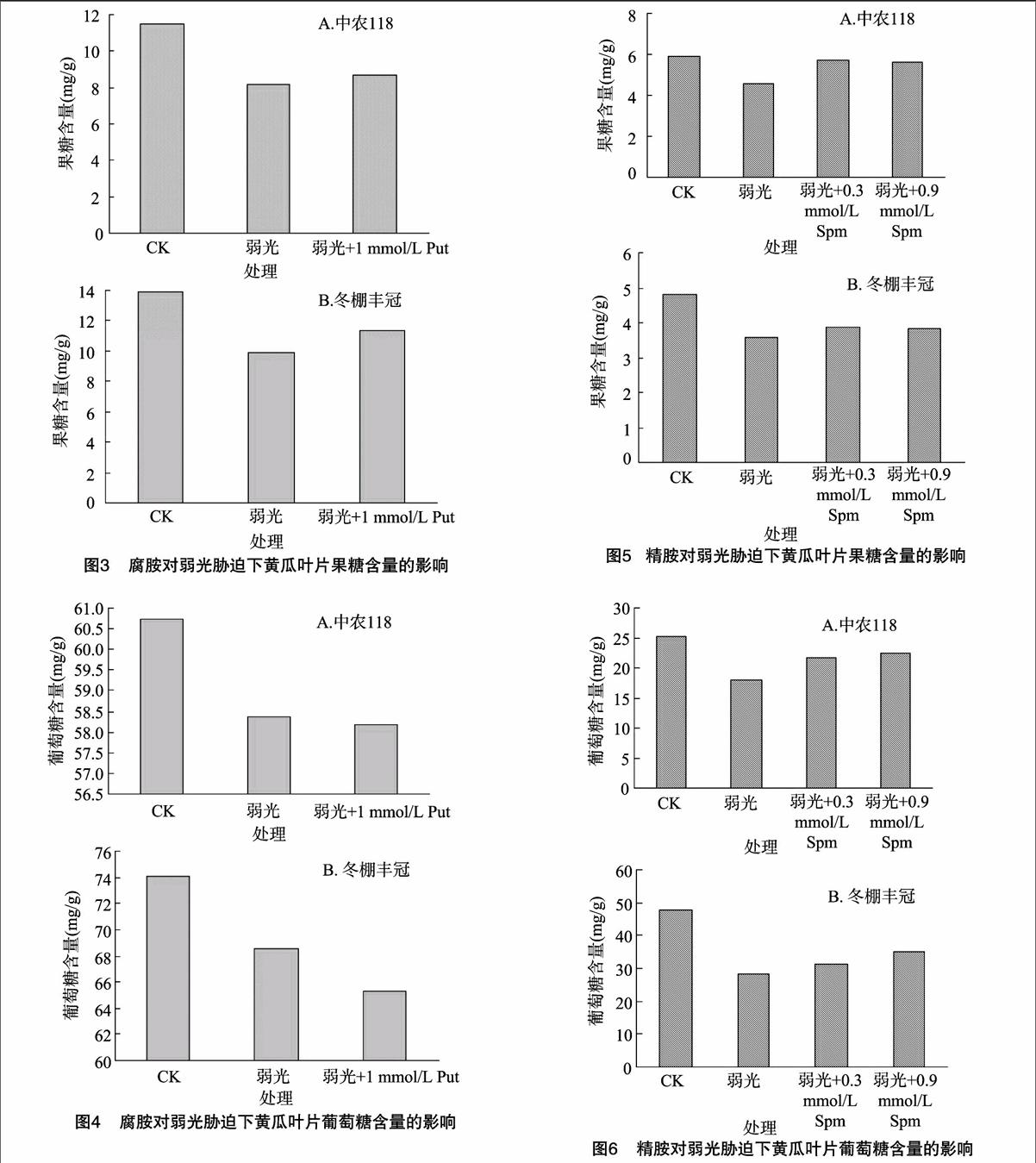
2.1 腐胺对弱光胁迫下黄瓜叶片可溶性糖含量的影响
由图1可以看出,与CK相比,弱光胁迫处理后,黄瓜叶片中可溶性糖含量降低,中农118可溶性糖含量比CK降低54.4%,冬棚丰冠可溶性糖含量比CK降低35.4%;弱光+Put处理组中,中农118的可溶性糖含量比单纯弱光胁迫组升高36.9%;冬棚丰冠的可溶性糖含量比单纯弱光胁迫组升高4.1%。该结果显示,Put可以使弱光胁迫下黄瓜叶片的可溶性糖含量升高。
2.2 腐胺对弱光胁迫下黄瓜叶片蔗糖含量的影响
由图2可以看出,与CK相比,弱光胁迫组的黄瓜叶片中蔗糖含量降低,中农118的蔗糖含量比CK组降低了614%,冬棚丰冠的蔗糖含量比CK组降低了59.4%;弱光+Put处理组中,中农118的蔗糖含量比单纯弱光胁迫组升高了134%,而冬棚丰冠的蔗糖含量比单纯弱光胁迫组升高了17.3%。说明Put可以使弱光胁迫下黄瓜叶片的蔗糖含量升高。
2.3 腐胺对弱光胁迫下黄瓜叶片果糖含量的影响
由图3可以看出,与CK相比,弱光胁迫组的黄瓜叶片中果糖含量明显降低,中农118的果糖含量比CK组降低291%,冬棚丰冠的果糖含量比CK组降低28.4%;弱光+Put组中,中农118的果糖含量比单纯弱光胁迫升高6.4%,冬棚丰冠的果糖含量比单纯弱光胁迫升高14.9%。显示Put可以使弱光胁迫下黄瓜叶片的果糖含量升高。
2.4 腐胺对弱光胁迫下黄瓜叶片葡萄糖含量的影响
由图4可以看出,与CK组相比,弱光处理后,黄瓜叶片中葡萄糖含量降低,中农118的葡萄糖含量比CK组降低39%,冬棚丰冠的葡萄糖含量比CK组降低7.5%;弱光+Put组中,中农118的葡萄糖含量比单纯弱光胁迫降低34%,冬棚丰冠的葡萄糖含量比单纯弱光胁迫降低4.6%。说明Put使弱光胁迫下黄瓜叶片的葡萄糖含量降低。
2.5 精胺对弱光胁迫下黄瓜叶片果糖含量的影响
由图5可知,与CK相比,弱光处理后,2个品种的黄瓜叶片果糖含量均明显降低,中农118的果糖含量下降了226%,冬棚丰冠的果糖含量下降了25.6%。外源喷施0.3 mmol/L Spm后,中农118的果糖含量上升了了19.4%,冬棚丰冠的果糖含量上升了6.0%;外源喷施0.9 mmol/L Spm后,中农118的果糖含量上升了17.9%,冬棚丰冠的果糖含量上升了4.6%。
2.6 精胺对弱光胁迫下黄瓜叶片葡萄糖含量的影响
由图6可知,与CK相比,弱光处理后,2个品种黄瓜叶片葡萄糖含量均降低,中农118的葡萄糖含量下降了28.4%,冬棚丰冠的葡萄糖含量下降了40.9%。外源喷施0.3 mmol/L
Spm精胺后,中农118的葡萄糖含量上升了14.2%,冬棚丰冠的葡萄糖含量上升了6.7%;外源喷施0.9 mmol/L Spm后,中农118的果糖含量上升了17.3%,冬棚丰冠的果糖含量上升了14.6%。
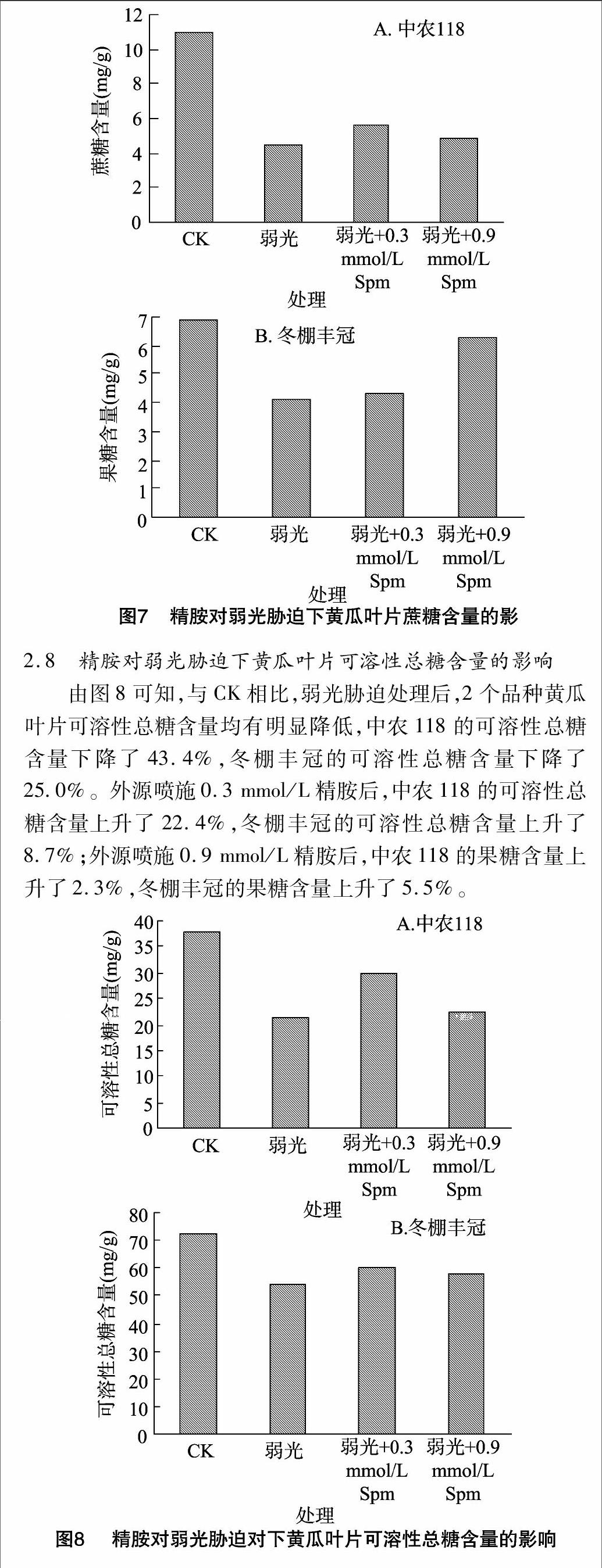
2.7 精胺对弱光胁迫下黄瓜叶片蔗糖含量的影响
由图7可知,与CK相比,弱光处理后,2个品种黄瓜叶片蔗糖含量均显著降低,中农118的蔗糖含量下降了59.2%,冬棚丰冠的蔗糖含量下降了40.6%。外源喷施0.3 mmol/L Spm后,中农118的蔗糖含量上升了10.3%,冬棚丰冠的蔗糖含量上升了3.9%;外源喷施0.9 mmol/L Spm后,中农118的果糖含量上升了3.6%,冬棚丰冠的果糖含量上升了32.1%。
2.8 精胺对弱光胁迫下黄瓜叶片可溶性总糖含量的影响
由图8可知,与CK相比,弱光胁迫处理后,2个品种黄瓜叶片可溶性总糖含量均有明显降低,中农118的可溶性总糖含量下降了43.4%,冬棚丰冠的可溶性总糖含量下降了250%。外源喷施0.3 mmol/L精胺后,中农118的可溶性总糖含量上升了22.4%,冬棚丰冠的可溶性总糖含量上升了87%;外源喷施0.9 mmol/L精胺后,中农118的果糖含量上升了2.3%,冬棚丰冠的果糖含量上升了5.5%。
3 结论
朱延姝等的试验证明,干物质量对光照度反应较为敏感,在弱光这种不良环境条件下生长的植株的干物质质量均有不同程度下降;同时,净光合速率的减弱直接造成了黄瓜生物学产量的明显降低,并且间接造成了经济学产量显著下降[6]。黄瓜在光照温室生长发育的过程中,首要环境影响因子是光照强度。本试验同样证实,弱光胁迫会导致黄瓜叶片中的可溶性糖含量降低。 然而,在本试验中对弱光胁迫条件下的黄瓜叶面喷施腐胺后,对黄瓜叶片中可溶性糖、蔗糖、果糖和葡萄糖含量有明显的影响,可溶性糖、蔗糖和果糖含量都有不同程度的升高,而葡萄糖含量分别降低了3.4%和4.6%。
在弱光条件下,中农118号和冬棚丰冠叶面喷施外源精胺后对黄瓜叶片中可溶性糖、蔗糖、葡萄糖和果糖含量的影响与精胺浓度有关,即在一定范围内随精胺浓度的增加,促进效应加强。由试验结果分析还得出,在弱光胁迫下喷施精胺,可溶性糖、蔗糖、葡萄糖和果糖含量均是升高的。
多胺是植物对逆境胁迫响应的重要物质,可以抵消胁迫引起的负效应,以外源腐胺预处理可缓解弱光胁迫引起的伤害[10,18]。本试验结果表明,与弱光胁迫相比,经外源腐胺处理后黄瓜叶片的可溶性糖都有不同程度的升高趋势,这说明其对有弱光胁迫引起的伤害有缓解作用。在弱光胁迫条件下,外源腐胺缓解弱光影响的机制还不十分清楚,有待进一步研究。施加外源精胺预处理可缓解弱光胁迫引起的伤害。本试验结果表明,与弱光胁迫相比,外源精胺处理后黄瓜叶片的可溶性糖都有不同程度的升高趋势,说明精胺对弱光胁迫有缓解作用,其原因有待进一步研究。endprint
综上所述,施加外源多胺后,对弱光胁迫下的黄瓜幼苗生长有一定的缓解作用,在大田生产中,可以通过施加外源多胺,将外源多胺作为一种弱光保护剂。
参考文献:
[1]李 光,付海鹏,杜胜利. 我国黄瓜新品种应用和良种生产现状[J]. 长江蔬菜,2007(1):30-32.
[2]孙涌栋,李贞霞,李新峥,等. Cu2+对黄瓜发芽期发育和生理特性的影响[J]. 核农学报,2008,22(3):374-378.
[3]徐 刚,彭天沁,高文瑞,等. 不同基质含水量和钾肥施用量对黄瓜生长及光合作用的影响[J]. 江苏农业学报,2014,30(5):1109-1114.
[4]高凌娜,司龙亭,李丹丹,等. 弱光胁迫下黄瓜幼苗叶片解剖结构及光合特性研究[J]. 江西农业大学学报,2009,31(6):1011-1015.
[5]战吉宬,黄卫东,王利军. 植物弱光逆境生理研究综述[J]. 植物学通报,2003,20(1):43-50.
[6]朱延姝,冯 辉,高绍森. 弱光对番茄生长发育及产量的影响[J]. 中国蔬菜,2006(2):11-13.
[7]高丽红,张福墁. 日光温室黄瓜生产中存在问题及解决途径[J]. 沈阳农业大学学报,2000,31(1):113-116.
[8]Shao H B,Liang Z S,Shao M. Changes of anti-oxidative enzymes and MDA content under soil water deficits among 10 wheat (Triticum aestivum L.) genotypes at maturation stage[J]. Colloids and Surfaces B:Biointerfaces,2005,45(1):7-13.
[9]王惠哲,庞金安,李淑菊,等. 弱光处理对春季温室不同品种黄瓜生长发育的影响[J]. 河南农业大学学报,2006,40(2):156-160.
[10]史留功,周 琳,刘怀攀. 亚精胺浸种对小麦幼苗抗渗透胁迫能力的影响[J]. 河南农业科学,2008(7):29-32.
[11]Ahn S J,Im Y J,Chung G C,et al. Physiological responses of grafted-cucumber leaves and rootstock roots affected by low root temperature[J]. Scientia Horticulturae,1999,81(4):397-408.
[12]周 珩,郭世荣,邵慧娟,等. 等渗NaCl和Ca(NO3)2胁迫对黄瓜幼苗生长和生理特性的影响[J]. 生态学报,2014,34(7):1880-1890.
[13]Salehi R,Kashi A,Lessani H. The effects of different cucurbit rootstocks on growth and yield of greenhouse cucumber[J]. Iran J Hort Sci Technol,2004,5:59-66.
[14]Canizares K A L,Goto R. Growth and hybrid produce of cucumber as a function of grafting[J]. Hort Brasil,1998,16:110-113.
[15]赵志成,杨显贺,李清明,等. 不同膜下滴灌方式对设施黄瓜生理特性及水分利用效率的影响[J]. 生态学报,2014,34(22):6597-6605.
[16]Aziz A,Martin-Tanguy J,Larher F. Salt stress-induced protine accumulation and changes in tyramine and polyamine levels are linked to ionic adjustment in tomato leaf discs[J]. Plant Science,1999,45:83-91.
[17]Bouchereau A,Aziz A,Larher F,et al. Polyamines and environmental challenges:recent development[J]. Plant Science,1999,140(2):103-125.
[18]王素平,贾永霞,郭世荣,等. 多胺对盐胁迫下黄瓜(Cucumis sativus L.)幼苗体内K+、Na+和Cl-含量及器官间分布的影响[J]. 生态学报,2007,27(3):1122-1129.endprint
