高效石油烃降解菌CQ6的分离鉴定及He—Ne激光诱变
2015-08-20付瑞敏康治华彭瑞强陈五岭
付瑞敏 康治华 彭瑞强 陈五岭

摘要:从长庆油田石油污染土壤中分离得到一株产生生物表面活性剂的高效石油烃降解菌。通过形态学、生理生化和分子生物学研究,筛选出的菌株CQ6被鉴定为短小芽孢杆菌(Bacillus pumilus)。为了增强该菌降解石油烃的能力,对其进行He-Ne激光诱变,获得6株突变株,通过检测其表面张力、排油圈直径和烃降解率,降解石油烃能力最强且遗传性状稳定的突变株CQ66被挑选出来。本研究表明,He-Ne激光诱变育种技术可有效改良石油烃降解菌,该手段对修复石油污染土壤具有现实意义。
关键词:石油烃降解菌;表面活性剂;He-Ne激光诱变;遗传稳定性
中图分类号: S182 文献标志码: A 文章编号:1002-1302(2015)07-0404-03
随着石油工业的快速发展,在石油勘探、开采、运输及炼制等过程都会出现原油的泄漏,从而对土地和邻近水体造成严重污染[1]。这些原油可通过生物学或非生物学途径而逐步降解。研究表明,消除石油烃污染的各个因素中,微生物降解具有重要作用,当前已报道有多种微生物具有降解石油烃并产生表面活性剂的能力[2-4]。李倩等制备石油烃降解菌剂并将其应用于溢油岸滩的生物修复,结果发现经过28 d的生物修复,其石油烃降解率最高达45.07%[5]。可见采用现代育种技术选育石油烃降解菌对于石油污染区域的生物修复具有极为重要的应用价值。 激光可通过光、电、热和电磁等综合作用引起菌体细胞基因发生改变,从而使所产生的酶发生激活或钝化[6]。低能量的He-Ne激光作用于菌体细胞,可促进菌体细胞生长进而提高代谢物产量,当前引起了微生物育种者的广泛关注[7]。本研究针对长庆油田石油污染土壤,进行了石油烃高效降解菌的分离、鉴定,并通过He-Ne激光辐射诱变育种,选育出一株遗传性能稳定的高效石油烃降解菌,以期为石油污染土壤的生物修复提供数据参考。
1 试验材料
1.1 菌种来源
从长庆油田石油污染土壤中提取。
1.2 培养基
1.2.1 无机盐培养基 MgSO4·7H2O 0.2 g,K2HPO4 1.0 g,KH2PO4 1.0 g,NH4NO3 1.0 g,FeCl3 0.05 g,蒸馏水1 000 mL,pH值7.0。
1.2.2 选择培养基 将2 g原油抽滤灭菌后加到上述无机盐培养基中,即为液体选择培养基,也叫原油发酵培养基。在培养基中加入15 g琼脂制成相应的固体选择培养基,即为油平板。试验所用原油采自长庆油田G010-18 井。
1.2.3 LB培养基 蛋白胨8 g,氯化钠7 g,酵母浸膏5 g,蒸馏水1 000 mL,pH值7.0,即为液体培养基;固体培养基的琼脂添加量控制在15%~18%。
1.2.4 复壮培养基 蛋白胨8 g,氯化钠7 g,酵母浸膏5 g,蒸馏水1 000 mL,pH值7.0,葡萄糖50 mmol/L
1.3 试验仪器
He-Ne激光发生器(波长632 nm,功率10 mW),由西北大学光电厂生产;WZY-1自动液体表面张力仪,由上海衡平制造厂生产。
2 试验方法
2.1 菌株培养
菌株分离自长庆油田G010-18 井周边污染土壤。将100 mL选择液体培养基加入到250 mL锥形瓶中,121 ℃灭菌20 min,而后称取5 g污染土壤置于其中,透气封口膜封住瓶口,280 r/min、30 ℃搖床振荡培养7 d。
2.2 菌株筛选与分离
2.2.1 初筛 采用梯度稀释法,将培养后的菌液用无菌水连续稀释101~107倍,取10-5、10-6、10-7的梯度稀释液分别涂布于以石油烃为唯一碳源的油平板上,每个稀释度均做3个平行试验,将其置于37 ℃培养3 d,能在油平板上生长的就是石油烃降解菌。将石油烃降解菌通过平板划线获得单菌落,将其转至斜面,4 ℃保存。
2.2.2 复筛 为了进一步检测石油烃降解菌对石油烃的降解能力,采用表面张力检测、排油圈[8]和烃降解率[9]等3种方法进行复筛。(1)表面张力检测[8]。将筛选出的石油烃降解菌菌株活化,以2%的比例接入葡萄糖发酵培养基,280 r/min、30 ℃摇床振荡培养7 d后,使用张力仪检测发酵液的表面张力。(2)排油圈[8]。取90 mm培养皿,加入 50 mL 去离子水,滴加0.1 mL液体石蜡于水面,石蜡中心加入10 μL发酵液,发酵液会将石蜡挤向四周形成圆圈,菌株所产生表面活性剂的量及活性同该圆圈的直径成正比。通过对比各菌株所形成的排油圈,选取排油圈直径最大的菌株作深入研究。上述试验均重复3次。(3)烃降解率[9]。将石油烃降解菌菌液以10%的比例接入50 mL的原油发酵培养基中,280 r/min、30 ℃摇床振荡培养7 d后,按照文献[9]中方法测定培养液中原油降解率,计算石油烃降解率。
降解率(D)=(m1-m7)/m1×100%。
式中:m1为初始发酵培养基中原油含量;m7为培养7 d残留油含量。
经过上述试验,即可选出降解石油烃能力最强的菌株。
2.3 形态学和生理生化鉴定
参照文献[10-11]对所选的降解石油烃能力最强的菌株进行形态学鉴定(包括革兰氏染色、芽孢染色和大小测定等),并参照微生物试验标准对该菌进行生理生化测定(包括过氧化氢酶反应、糖发酵试验、IMViC试验、淀粉水解试验、柠檬酸盐利用试验、酪素水解试验和耐盐性试验等),上述试验均重复3次。
2.4 16S rDNA序列分析
参照Fani等的方法[12],采用上海生工生物工程技术服务有限公司提供的试剂盒提取所选菌株的DNA和回收其16S rDNA片段。16S rDNA 的PCR扩增引物采用通用引物(27F:5′-AGAGTTGTCATGGCTC-3′和1492R:5′-TACGGYTACCTTGTTACGACTT-3′),该引物合成自上海生工。PCR反应参数:94 ℃ 5 min;94 ℃ 50 s,50 ℃ 50 s,72 ℃ 90 s,共计30个循环;72 ℃ 10 min。将所得PCR产物回收纯化并提交目的片段至上海生工进行基因测序,所得序列采用MEGA 3.0同NCBI上的相近物种的16S rDNA序列构建系统发育树,树的聚类稳定性进行1 000次自导检验[13]。
2.5 He-Ne激光诱变和突变株的选育
2.5.1 诱变前的活化
将所选菌株于37 ℃培养24 h后,用5 mL无菌生理盐水冲洗斜面后将其置于三角瓶中(内含玻璃珠),充分振荡混匀,采用光电比浊计数法将菌悬液的D值调节至0.986,使其浓度为108 CFU/mL。
2.5.2 He-Ne激光诱变[14]
取2 mL菌悬液分别置于无菌试管中,将 He-Ne 激光的输出功率调节为10 mW,照射距离调节为 25 cm,照射时间为5、10、15、20、25 min,以原菌液为对照,试验均重复3次。
2.5.3 诱变菌培养
无菌条件下取1 mL激光照射后的菌液,将其置于装有9 mL无菌水的试管中,作为10-1,振荡混匀后再以同样方法将其稀释至10-5、10-6、10-7,从3个梯度的稀释液中各取0.2 mL涂平板,每个稀释度设3个平行,37 ℃ 培养20 h后,以原菌悬液作为对照,进行菌落形态观察和菌落计数。
2.5.4 存活率和正突变率的计算
将激光诱变后的菌悬液用复壮培养基培养,条件为280 r/min 、37 ℃下培养6 h,而后使用梯度稀释法将其稀释至10-6,分别取0.1 mL 10-4、10-5和10-6的稀释液涂布在油平板上,以未照射的菌液为对照,37 ℃、96 h后观察生长状况,并计算存活率和正突变率:
存活率=诱变后活菌数/诱变前活菌数×100%;
正突变率=正突变菌株数/诱变后活菌数×100%。
2.5.5 挑取优良突变株
通过菌落形态观察和计数,从诱变后的菌株中挑选出菌落形态变化较大、长得又快又好且透明圈明显的突变株,通过表面张力检测、排油圈和烃降解率等方法检测正突变株降解石油烃和产生表面活性剂的能力,并挑选优良突变株。
2.5.6 突变株遗传稳定性试验
将挑选出的降解石油烃能力最强的突变株转接至LB平板上,作为第1代,然后以相同方法连续继代20代,每隔4代分别将其按照10%的比例接入原油发酵培养基中,280 r/min、30 ℃搖床振荡培养7 d,测其降解率和表面张力,并将其与第1代菌株比较,确定突变株的遗传稳定性。
3 结果与分析
3.1 石油烃降解菌的筛选与分离
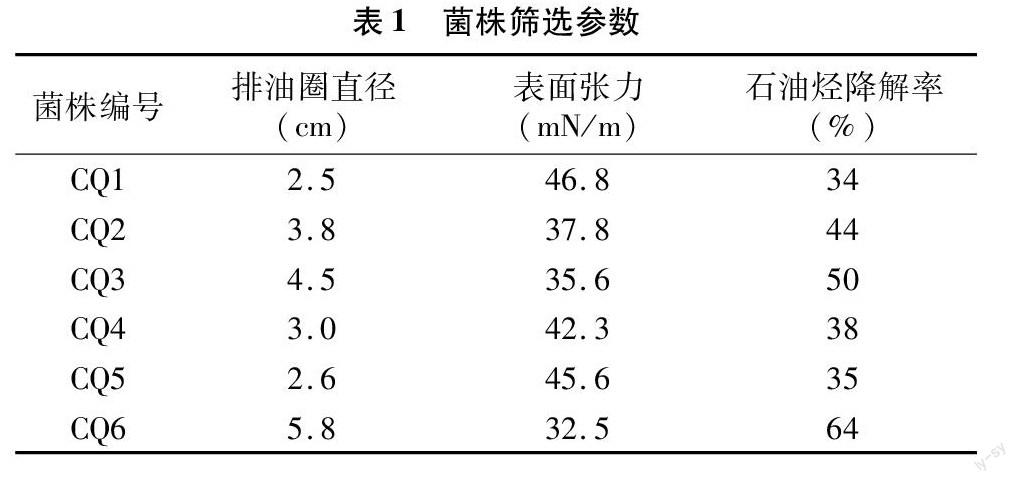
从长庆油田石油污染土壤中分离得到可在油平板上生长且产生透明圈的石油烃降解菌6株,分别为CQ1、CQ2、CQ3、CQ4、CQ5和CQ6,经过表面张力、排油圈和烃降解率等方法检测,结果如表1所示:6株菌对石油烃的降解能力和产生表面活性剂的能力有较为显著的差异,菌株CQ6的排油圈直径和石油烃降解率均高于其他菌株,且表面张力低于其他菌株。基于此,说明菌株CQ6的降解石油烃能力和产生表面活性剂能力最强,因此选取菌株CQ6进行后续研究。
3.2 石油烃降解菌CQ6的表型特征和生理生化特性
将上述所选的石油烃高效降解菌株CQ6挑选出来并进行显微镜镜检和菌落形态观察。结果显示:该菌个体形态为杆状,G-,产椭圆形芽孢,芽孢囊膨大,菌落干燥、不透明且有皱褶,菌落边缘有不规则扩散。
对CQ6进行生理生化检测,结果显示:CQ6为严格好氧菌,抗氯化钠2%、5%、7%、10%,可发酵葡萄糖产酸,IMViC试验结果为-+++,淀粉水解和酪素水解试验结果为阳性。
通过分析CQ6的表型特征和生理生化特征,发现其形态和生理生化特点均和枯草芽孢杆菌标准株相同,据此,可初步判定菌株CQ6为芽孢杆菌属。
3.3 CQ6的16S rDNA的系统发育研究
菌株CQ6的16S rDNA片段(约1 500 bp)的PCR扩增结果如图1所示,将所得PCR产物测序,得到 1 492 bp 的序列,将该序列和NCBI数据库中的各近缘菌株的16S rDNA序列进行比对,应用Bioedit7.0软件进行多重比较,分析其同源性,并构建系统发育树(图2),经分析,所得序列和Bacillus pumilus(登录号:X60637)显示了99%的同源性,根据其系统进化特征,可确定菌株CQ6为短小芽孢杆菌。
3.4 突变株筛选
用激光照射诱变育种的生物学效应主要是引起基因突变从而使酶激活或钝化,激光照射时间会导致突变率发生变化,照射时间越长,突变率越高,但是致死率也随之升高,因此要挑选合适的照射时间以保证一定的突变率和控制致死率。用激光对石油烃降解菌CQ6照射不同时间,结果如表2所示。
由表2可以看出,随着照射时间的延长,菌株的存活率不断下降,正突变率的变化趋势是先升高后降低,推断造成这种情况的原因是由于照射时间过长,不仅会导致活菌数剧烈下
降,也会使更多的菌株出现负突变,因此,综合考虑,CQ6的最佳照射时间选为15 min。
采用排油圈检测、表面张力检测和烃降解率等方法,5株降解石油烃和产生表面活性剂的能力均强于亲本CQ6的菌株被挑选出来,分别编号为CQ61、CQ63、CQ65、CQ66和CQ67,其降解石油烃和产生表面活性剂的结果如表3所示。
如表3所示,突变株CQ66的排油圈直径和石油烃降解率均高于其他突变株,且表面张力低于其他突变株,说明该突变株的降解石油烃能力和产生表面活性剂能力是突变株中最强的,故将其挑选出来,用于后续研究。
3.5 突变株遗传稳定性研究
把石油烃降解能力和产生表面活性剂能力均有所提高的突变株CQ66继代培养20代,每隔4代的菌株分别做石油烃降解率和表面张力试验,结果(表4)表明各代降解石油烃和产生表面活性剂的能力基本一致,说明突变株CQ66的降解石油烃能力的遗传稳定性良好。
4 讨论
本研究从长庆油田石油污染的土壤中分离筛选得到一株高效降解石油烃和产生表面活性剂的菌株CQ6,经形态学、生理生化和分子鉴定确定该菌株为短小芽孢杆菌(Bacillus pumilus)。
为了增强该菌株降解石油烃的能力和产生表面活性剂的能力,对所选菌株进行He-Ne激光诱变育种,并确定最佳照射时间为15 min。
He-Ne激光诱变后,采用排油圈检测、表面张力检测和烃降解率等方法挑选出降解石油烃和产生表面活性剂能力最强的突变株CQ66,并对其进行遗传稳定性检测, 试验结果表明,该突变株降解石油烃和产生表面活性剂的遗传性状稳定,可用于制备固体菌剂或液体菌剂应用于长庆油田石油污染土壤的生物修复。
参考文献:
[1]Ueno A,Ito Y,Yumoto I,et al. Isolation and characterization of bacteria from soil contaminated with diesel oil and the possible use of these in autochthonous bioaugmentation[J]. World Journal of Microbiology and Biotechnology,2007,23(12):1739-1745.
[2]Sathishkumar M,Binupfiya A R,Ho B S,et al. Biodegradation of crude oil by individual bacterial straias and a mixed bacterial consoainm isolated from hydrocarbon contaminated areas[J]. Clean,2008,36(1):92-96.
[3]姜 肸,高 偉,李 倩,等.南海高效石油降解菌的筛选及降解特性研究[J].环境科学学报,2012,32(7):1572-1578.
[4]王彦杰,毕思宁,左豫虎,等.一株表面活性剂产生菌的分离及抑菌活性[J].微生物学通报,2012,39(3):353-360.
[5]李 倩,高 伟,崔志松,等. 不同剂型石油降解菌剂在模拟溢油岸滩修复中的中试应用[J]. 海洋环境科学,2013,32(5):772-775.
[6]陈义光,李铭刚,徐丽华,等.新型物理诱变方法及其在微生物诱变育种中的应用展[J].长江大学学报:自然版,2005,2(5):46-50.
[7]马昕源. 微生物激光诱变育种应用研究进展[J].河北农业科学,2008,12(1):75-77.
[8]刘 佳,黄翔峰,陆丽君,等.生物破乳剂产生菌的筛选及其方法研究[J].微生物学通报,2008,35(5):690-695.
[9]崔丽虹,郭 萍,李宝明,等. 石油烃降解菌的筛选与鉴定[J]. 生物技术通报,2009(9):143-147.
[10]布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].8版.北京:科学出版社,1984:729-795.
[11]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M].北京:科学出版社,2001:43-66.
[12]Fani R,Bandi C,Bazzicalupo M,et al. Phylogeny of the genus Azospirillum based on 16S rDNA sequence[J]. FEMS Microbiology Letters,1995,129(2/3):195-200.
[13]Han J,Sun L,Dong X,et al. Characterization of a novel plant growth-promoting bacteria strain Delftia tsuruhatensis HR4 both as a diazotroph and a potential biocontrol agent against various plant pathogens[J]. Systematic and Applied Microbiology,2005,28(1):66-76.
[14]付瑞敏,韩鸿鹏,张丽琴,等.葡萄霜霉病和白粉病拮抗菌的分离、鉴定和He-Ne激光诱变[J].江苏农业科学,2013,41(8):122-125.
