5种唇柱苣苔属植物光合特性的比较
2015-08-20吕惠珍郭晓云李莹
吕惠珍 郭晓云 李莹

摘要:以5种唇柱苣苔属植物为材料,采用LI-6400XT便携式光合仪在晴朗天气下分别测定其成熟叶片的光合日变化参数、光响应参数和CO2响应参数等,探讨其光合特性的异同。结果表明,5种唇柱苣苔属植物的光合日变化参数不尽相同,不同物种的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)之间都有一定的相关性。净光合速率与光合有效辐射、叶表温度、大气湿度和CO2浓度等环境因子密切相关。5种唇柱苣苔属植物的最大净光合速率由大到小分别为蚂蝗七>钟冠唇柱苣苔>大根唇柱苣苔>药用唇柱苣苔>弄岗唇柱苣苔;其光饱和点(LSP)都在600~800 μmol/(m2·s)之间,差别不大,但也明显低于一般植物;CO2补偿点(CCP)都介于80~125 mg/m3之间,而CO2饱和点(CSP)均在1 100 mg/m3以上,最高的钟冠唇柱苣苔甚至达到1 637 mg/m3。
关键词:唇柱苣苔属;光合日变化;光曲线;CO2曲线
中图分类号: Q945.11 文献标志码: A 文章编号:1002-1302(2015)07-0189-04
苦苣苔科(Gesneriaceae)为多年生草本,隶属于被子植物门(Angiospermae)双子叶植物纲(Dicotyledoneae)合瓣花亚纲(Sympetalae)管状花目(Tubiflorae),全世界约140属2 000余种,我国有56属(其中28属特产我国),约413种。唇柱苣苔属(Chirita)是苦苣苔科的一个大属,以奇特的叶形、丰富的色彩、紧凑的株形而成为苦苣苔科中比较突出的一个种群,共有140余种,主要分布于亚洲东南部及南部热带和亚热带地区,我国有105种5变种,多数分布在南方及西南部地区,多生于石灰岩山的陡崖上[1-3]。该属植物大部分种类花多而大,且花期长,色彩艳丽,正符合人们对园林花卉追求的“新”“奇”“珍”“稀”等的审美需求,因此具有较高的观赏价值,适宜作室内盆花观赏、花坛花境布置和岩石装饰等用材,是开发潜力较大的具有亚热带区域特色的花卉。许多种类在我国南方还是传统的民间草药,多具有清热、止咳平喘、活血、滋补的功能,尤其在广西少数民族地区被广泛使用[4-5]。此外,唇柱苣苔属植物还具有广泛的适应性,表现出对石灰岩生境土壤的高钙性、生境的干旱性、温度的差异性、营养的缺乏性、小环境的多样性等特殊条件的独特的适应性,因而具有极大的开发潜力。近年来,由于人为和自然因素的影响,使得这些野生植物赖以生存的环境遭受严重破坏,一些局域性种类日益稀少,一些地理分布范围较小的特有种、地方种已处于濒危状态,甚至已经灭绝[6]。为了保护这些生物遗传资源,提高其利用率,开展苦苣苔科植物的繁育研究对其保护和合理开发利用具有重要意义。目前国内外针对苦苣苔科植物的研究主要集中在植物系统亲缘学[7-9]、植物分类[10-12]、化学成分[13-15]等方面,国内已开展了对一些苦苣苔植物的繁育工作[16-18],但关于苦苣苔科植物的光合特性研究鲜有报道[19-20]。
光合作用是植物利用光能同化CO2和水,制造有机物并释放O2的过程。光合作用与植物的生长关系密切,是叶的最主要功能,不仅是植物体内最重要的生命活动,同时也是地球上最重要的化学反应过程。它除了与叶片本身的结构和生理机能有关外,也受光照、温度、CO2浓度和水分等环境因子的影响。
本研究以5种唇柱苣苔属植物蚂蝗七(C. fimbrisepala Handel-Mazzetti)、大根唇柱苣苔(C. macrorhiza D. Fang & D. H. Qin)、钟冠唇柱苣苔[C. swinglei (Merrill) W. T. Wang]、药用唇柱苣苔(C. medica D. Fang ex W. T. Wang)和弄岗唇柱苣苔(C. longgangensis W. T. Wang)为材料,采用LI-6400XT便携式光合作用测量系统(LI-COR,USA)在晴朗天气下分别测定其成熟叶片的光合日变化参数、光响应参数和CO2响应参数等,通过对其光合特性进行对比和研究,深入了解其环境需求,以期为苦苣苔科植物,尤其是唇柱苣苔属植物的引种繁育和保护利用提供一定的理论依据。
1 材料与方法
1.1 材料
供试材料为唇柱苣苔属植物蚂蝗七、大根唇柱苣苔、钟冠唇柱苣苔、药用唇柱苣苔和弄岗唇柱苣苔,均采自广西石灰岩地区同一野生居群,于2010年在广西药园引种圃进行统一驯化栽培,选择透气性良好的瓦盆进行栽植,基质为堆肥土、园土、草木灰和细沙的混合基质,按照体积比2 ∶2 ∶1 ∶1的比例混合均匀,每盆1株,常规管理。
1.2 方法
1.2.1 光合日变化參数的测定 于2012年8—9月,选择晴天 05:30—19:30,采用LI-6400XT便携式光合作用测量系统测定该5种唇柱苣苔属植物的光合日变化参数,每隔2 h测定1次。测定时随机取样,每种植物测定5株,以植株主茎自上向下第1张成熟稳定叶作为测试叶片,记录叶片的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)等光合参数,同时记录光合有效辐射强度(PAR)、叶表面温度(Ta)、大气相对湿度(RH)和环境CO2浓度(Ca)等相关环境参数。其中,PAR、Ta、RH和Ca以外界条件为准。为了消除时间上的误差,测定时5种植物随机排序。每个种重复测定3次(选择天气晴朗的3 d,每天测定1次),取平均值。
1.2.2 光响应参数的测定 于2012年8—9月,选择天气晴朗植物光合旺盛的时间段(09:00—11:00),采用LI-6400XT便携式光合作用测量系统测定该5种唇柱苣苔属植物的光响应曲线。测定时随机取样,每种植物测定5株,以植株主茎自上向下第1张成熟稳定叶作为测试叶片,使用LI-6400XT的LED红/蓝光源设定1 200、1 000、800、600、500、400、300、200、100、50、30、20、10、0 μmol/(m2·s)14个不同的辐射梯度,测定前将待测叶片在1 200 μmol/(m2·s)的照度下诱导20 min。为了消除时间上的误差,测定时5种植物随机排序。每个种重复测定3次(选择天气晴朗的3 d,每天测定1次),取平均值。将测得的数据采用非直线双曲线模型进行非线性回归拟合,并将光合有效辐射(PAR)在0~200 μmol/(m2·s)的测定值进行直线回归分析,得到表观量子效率(AQY)、最大净光合速率(Pmax)、光补偿点(LCP)和光饱和点(LSP)。
1.2.3 CO2响应参数的测定 于2012年8—9月,选择天气晴朗植物光合旺盛的时间段(09:00—11:00),采用LI-6400XT便携式光合作用测量系统测定该5种唇柱苣苔属植物的CO2响应曲线。测定时随机取样,每种植物测定5株,测试叶选取同光响应曲线,测定时设置照度为800 μmol/(m2·s),叶室温度为25 ℃。利用CO2钢瓶控制CO2浓度(Ci),CO2浓度梯度为50、100、200、400、600、800、1 000、1 200、1 400、1 600、1 800 μmol/(m2·s),使用LI-6400XT的LED红/蓝光源叶室测定净光合速率(Pn)和胞间二氧化碳浓度(Ci)。为了消除时间上的误差,测定时5种植物随机排序,每个种重复测定3次(选择天气晴朗的3 d,每天测定1次),取平均值。将测得的Pn和Ci数据采用非直角双曲线模型进行非线性回归拟合,当Ci在0~200 μmol/mol时,以Pn对Ci进行直线回归分析,得出羧化效率(CE)、CO2饱和净光合速率(Pn)、CO2补偿点(CCP)和CO2饱和点(CSP)。
1.3 数据分析
测定数据用Excel 2007数据整理和作图,SPSS软件进行数据差异显著分析,Origin 7.0软件对各响应曲线的参数进行拟合及数学模拟。
2 结果与分析
2.1 5种唇柱苣苔属植物的光合日变化
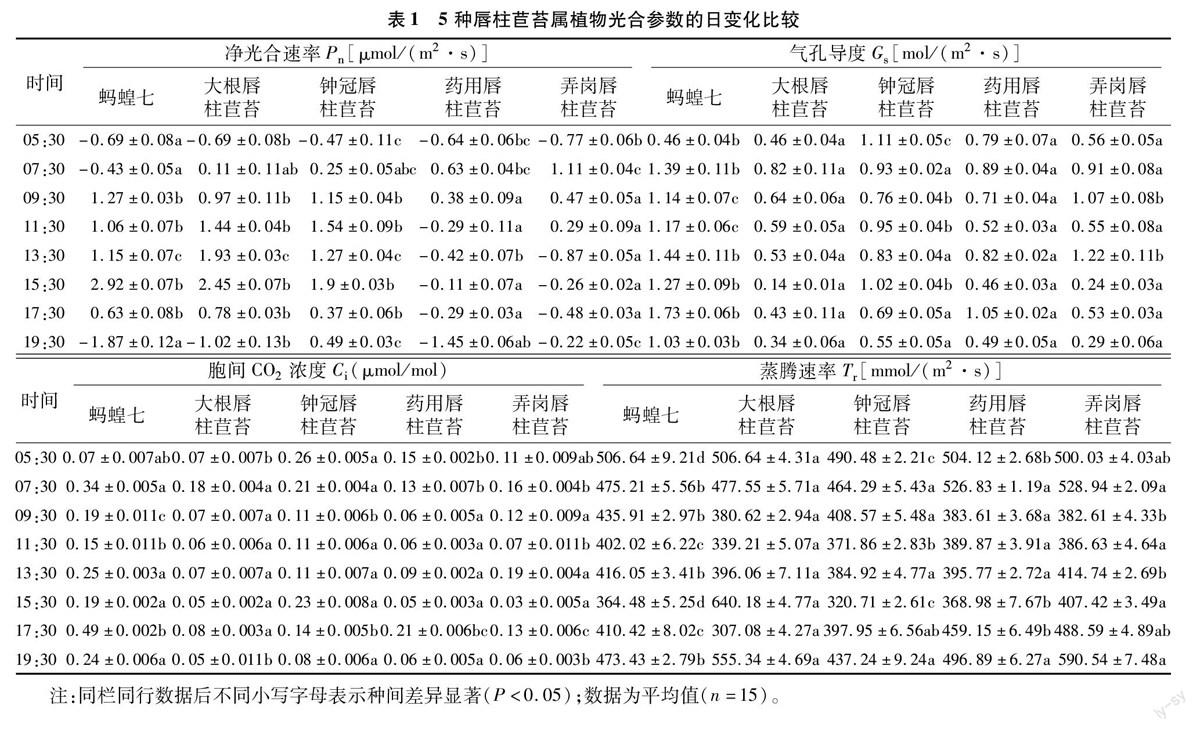
由表1可以看出,5种唇柱苣苔属植物的光合日变化参数不尽相同。5种唇柱苣苔属植物的净光合速率在05:30皆为负值,说明天亮前5种植物的总光合速率都小于呼吸速率。随着时间的推移,总光合速率逐渐增强,蚂蝗七和钟冠唇柱苣苔的净光合速率都先迅速增大,在中午11:30—13:30之间趋于平稳,然后开始上升,于15:30达到最大后又迅速下降,蚂蝗七甚至在19:30降至负值。大根唇柱苣苔净光合速率则是随着时间推移逐渐增强,在15:30达到最大值,然后急剧下降,于天黑后(19:30)又降至负值。药用唇柱苣苔和弄岗唇柱苣苔的净光合速率相对较低,且都出现较明显的双峰曲线,即先增大,07:30达到一个小高峰后逐渐降低,13:30达到最低值,然后又略有升高,15:30后又逐渐降低,说明二者的净光合速率可能出现了“午休”现象。除净光合速率外,5种唇柱苣苔属植物的蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)等其他光合参数日变化也不尽相同。蒸腾速率和气孔导度基本也呈现出较为规则的先增大后减小的趋势,这与净光合速率相对一致。相关分析结果表明,不同物种的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)之间都有一定的相关性。
2.1.1 5种唇柱苣苔属植物的光合参数日变化
2.1.2 相关环境因子日变化 净光合速率与光合有效辐射、叶表温度、大气湿度和CO2浓度等环境因子也密切相关。如图1所示,测试当天,5种唇柱苣苔属植物光合有效辐射和叶表面温度均呈现出先增大后减小的变化规律,最大值均出现在13:30;环境CO2浓度则相反,随着时间的推移,环境CO2浓度先急剧减小,到11:30达到最小值后逐渐增大;而大气湿度则是在07:30达到最大值后迅速降低,13:30略有回升后又逐渐下降,17:30达到最低值后又迅速上升。
2.2 5种唇柱苣苔属植物的光响应曲线
由表2可以看出,5种唇柱苣苔属植物的最大净光合速率Pmax由大到小分别为蚂蝗七>钟冠唇柱苣苔>大根唇柱苣苔>药用唇柱苣苔>弄岗唇柱苣苔。蚂蝗七的光补偿点(LCP)最低,为5.55 μmol/(m2·s),但其光饱和点(LSP)则最高,为770 μmol/(m2·s)。钟冠唇柱苣苔和药用唇柱苣苔的LCP相对较高,皆大于50 μmol/(m2·s),而蚂蝗七和弄岗唇柱苣苔则相对较低,都在10 μmol/(m2·s)以下。5种唇柱苣苔属植物的LSP都在600~800 μmol/(m2·s)之间,差别不大,但也明显低于一般植物。说明唇柱苣苔属植物利用弱光能力较强,但对强光环境较为不适应,这样有利于有机物质的积累。
2.3 5种唇柱苣苔属植物的CO2响应曲线
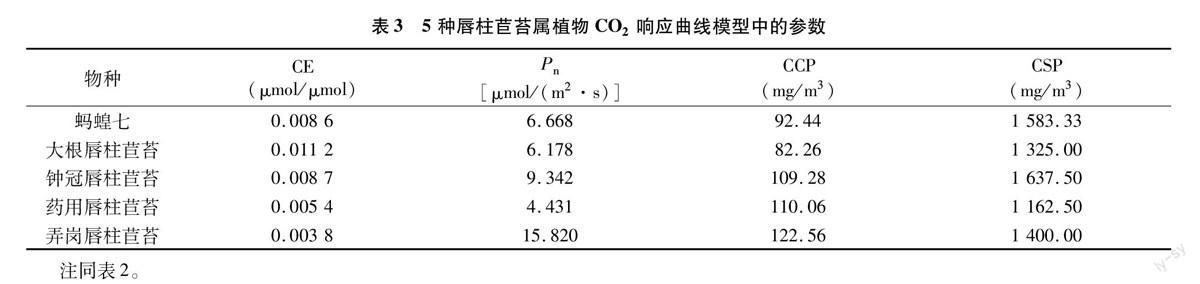
如表3所示,弄岗唇柱苣苔的CO2饱和净光合速率(Pn)最高,为15.820 μmol/(m2·s),最低的为药用唇柱苣苔[4431 μmol/(m2·s)]。CO2补偿点(CCP)都介于80~125 mg/m3之间,相差不大,而CO2饱和点(CSP)均在 1 100 mg/m3 以上,最低的药用唇柱苣苔为1 162.50 mg/m3,最高的钟冠唇柱苣苔甚至达到1 637.50 mg/m3。
3 结论与讨论
由以上结果可以看出,5种唇柱苣苔的光合日变化参数不尽相同。随着时间的推移,总光合速率逐渐增大,蚂蝗七和钟冠唇柱苣苔的净光合速率都先迅速增大,在中午11:30—13:30之间趋于平稳,然后开始上升,于15:30達到最大后又迅速下降;大根唇柱苣苔净光合速率则是随着时间推移逐渐增大,在15:30达到最大值,然后急剧下降,药用唇柱苣苔和弄岗唇柱苣苔的净光合速率相对较低,且都出现了较明显的双峰曲线,说明二者的净光合速率可能出现了“午休”现象。这与郑月萍等研究的4种苦苣苔科植物的净光合速率日变化曲线均为双峰曲线[20]并不吻合,可能是植物生长的环境条件和测定季节不同所致。5种唇柱苣苔属植物的蒸腾速率和气孔导度基本也呈现出较规则的先增大后减小的趋势,这与净光合速率相对一致,说明蒸腾速率和气孔导度对该植物的净光合速率变化有重要作用,这与邓涛等的研究结论[19]基本一致。
5种唇柱苣苔属植物的最大净光合速率由大到小依次为蚂蝗七>钟冠唇柱苣苔>大根唇柱苣苔>药用唇柱苣苔>弄岗唇柱苣苔。钟冠唇柱苣苔和药用唇柱苣苔的光补偿点(LCP)相对较高,皆大于50 μmol/(m2·s),而蚂蝗七和弄岗唇柱苣苔则相对较低,都在10 μmol/(m2·s)以下。5种唇柱苣苔属植物的光饱和点(LSP)都在600~800 μmol/(m2·s)之间,差别不大,但也明显低于一般植物。CO2补偿点(CCP)都介于80~125 mg/m3之间,相差不大,而CO2饱和点(CCP)均在1 100 mg/m3以上,最低的药用唇柱苣苔为1 162.50 mg/m3,最高的钟冠唇柱苣苔甚至达到 1 637.50 mg/m3。说明5种唇柱苣苔属植物需光性不强,属耐阴植物,这可能与唇柱苣苔属植物的原生长环境有关。因此,在今后唇柱苣苔属植物的引种繁育工作中,须既保证正常生长所需的光照条件,又要有一定的遮阴度,同时注意影响其生长的环境因子,而其光合特性的差异也对其最佳栽培条件提出不同的要求。本研究通过对5种唇柱苣苔属植物的光合特性进行对比和研究,希望能为苦苣苔科植物,尤其是唇柱苣苔属植物的引种繁育和栽培技术研究提供一定的理论依据。
参考文献:
[1]中国科学院中国植物志编辑委员会. 中国植物志:第69卷[M]. 北京:科学出板社,1990:125-126.
[2]李振宇,王印政. 中国苦苣苔科植物[M]. 郑州:河南科学技术出版社,2004:171-261.
[3]温 放. 广西苦苣苔科观赏植物资源调查与引种研究[D]. 北京:北京林业大学,2008.
[4]王莉芳,黄仕训,邓 涛,等. 广西唇柱苣苔属植物及其园林应用[J]. 北方园艺,2009(4):174-177.
[5]吕惠珍,余丽莹,黄宝优,等. 广西苦苣苔科药用植物资源[J]. 中国民族民间医药,2010(7):6-10.
[6]温 放,张启翔,王 越.广西唇柱苣苔属和小花苣苔属植物的观赏性状评价与筛选[J]. 园艺学报,2008,35(2):239-250.
[7]葛玉珍.广义石山苣苔属(苦苣苔科)的系统发育研究[D]. 南宁:广西大学,2012.
[8]白贞芳. 苦苣苔科藥用植物亲缘学研究[D]. 北京:北京中医药大学,2010.
[9]汪小全,李振宇. rDNA片段的序列分析在苦苣苔亚科系统学研究中的应用[J]. 植物分类学报,1998,36(2):97-105.
[10]Wang Y Z,Mao R B,Liu Y,et al. Phylogenetic reconstruction of Chirita and allies (Gesneriaceae) with taxonomic treatments[J]. Journal of Systematics and Evolution,2011,49(1):50-64.
[11]Weber A,Middleton D J,Forrest A,et al. Molecular systematics and remodelling of Chirita and associated genera (Gesneriaceae)[J]. TAXON,2011,60(3):767-790.
[12]Wen F,Tang W X,Wei Y G. Hemiboea angustifolia (Gesneriaceae),a new species endemic to a tropical limestone area of Guangxi,China[J]. Phytotax,2011,30:53-59.
[13]房秀华. 苦苣苔科药用植物化学成分研究及化学系统学初探[D]. 北京:中国协和医科大学,1997.
[14]闫文义,陈 林,王金梅,等. 苦苣苔科三萜类化学成分研究进展[J]. 天然产物研究与开发,2012,24(5):698-701.
[15]白贞芳,王晓琴,肖培根,等. 苯乙醇苷类化合物在苦苣苔科药用植物中分布规律[J]. 中国中药杂志,2013,38(24):4267-4270.
[16]邓 涛,何永艳,周太久,等. 外源IBA对5种苦苣苔科植物扦插繁殖的影响[J]. 经济林研究,2013,31(3):68-72.
[17]王 辉. 三种苦苣苔科野生花卉的繁育与抗逆性研究[D]. 杭州:浙江农林大学,2011.
[18]张占江,李 翠,韦 莹,等. 珍稀濒危药用植物弄岗唇柱苣苔离体保存研究[J]. 北方园艺,2014(4):136-138.
[19]邓 涛,莫 丹,周太久,等. 菱叶唇柱苣苔光合特性日变化的初步研究[J]. 江苏农业科学,2010(4):195-197.
[20]郑月萍,沈宗根,姜 波,等. 4种苦苣苔科植物光合特性的比较[J]. 浙江师范大学学报:自然科学版,2012,35(4):446-452.
