尿素法合成甲苯二氨基甲酸苯酯反应体系的热力学分析
2015-08-20崔雪霞王桂荣赵茜李欣赵新强王延吉
崔雪霞,王桂荣,赵茜,李欣,赵新强,王延吉
(河北工业大学化工学院,天津 300130)
引 言
甲苯二氨基甲酸苯酯(diphenyl toluene dicarbamate,PTDC)是重要的有机化合物,在医药、涂料、染料和电缆等方面有重要的用途。尤其PTDC又是非光气法合成甲苯二异氰酸酯(TDI)的中间体,而TDI 是生产聚氨酯的重要原料,随着聚氨酯行业的快速发展,TDI 的需求量也随之增加。工业上生产TDI 采用光气法,由于原料光气剧毒、副产物HCl 易造成设备腐蚀等缺点,从清洁化工的角度,光气法终将被淘汰。目前,非光气法合成TDI 已成为国内外学者关注的焦点[1],多种非光气法如氧化羰基化法[2]、还原羰基化法[3]、碳酸酯法[4-5]和尿素法[6]等均有大量文献报道,其中尿素法是以尿素与甲苯二胺(TDA)以及醇(或酚)为原料,先反应合成甲苯二氨基甲酸酯,然后其再分解为TDI。该法具有原料便宜易得、反应条件温和以及产物分离方便的优点,尤其副产物NH3可以循环至尿素合成单元,可构成零排放的工艺路线,工业化潜力很大。
异氰酸酯反应活性很强,易与含活泼氢的物质发生反应,且异氰酸酯本身毒性较大,因此不宜作为单组分体系储存和运输。解决其储运过程安全性的首选方法是对异氰酸酯进行封闭,然后在需要异氰酸酯的场合通过解封闭获得异氰酸酯并进行目标反应。而且,最近20年来,对封闭型异氰酸酯的需求也急剧增加[7],其中苯酚封闭型异氰酸酯可用于各种单组分涂料、粉末涂料和各类胶黏剂中[8],具有广泛的应用市场。
PTDC 既是非光气法合成TDI 的中间体,又是苯酚封闭型TDI,苯酚封闭型异氰酸酯的解封温度较一般醇类低,更有利于解封闭反应,无论是从PTDC 分解制备TDI 方面,还是从封闭型TDI 直接使用方面,PTDC 均比其他甲苯二氨基甲酸酯更具有优势。本文通过对尿素法合成芳基二氨基甲酸酯的反应路径进行分析,提出合成PTDC 反应的4 种可能反应路径并进行热力学计算,结合文献实验数据分析各反应路径的可行性及难易程度,为后期实验研究及过程开发提供理论指导。
1 反应路径分析
目前还没有关于尿素法合成PTDC 的文献报道,但关于尿素、芳基二胺和脂肪醇合成芳基二氨基甲酸酯反应的研究报道较多。一般尿素法合成芳基二氨基甲酸酯的反应路径分为尿素首先与芳基二胺反应或者尿素首先与醇反应两大类,Ikariya 等[9]和Merger 等[10]对尿素、芳基二胺和醇合成芳基二氨基甲酸酯的分步研究,表明了两大类反应路径的可能性。
对于尿素首先与芳基二胺反应:文献[11]对γ-Al2O3催化剂上尿素与TDA 及正丁醇合成甲苯二氨基甲酸丁酯研究表明,尿素首先与TDA 反应得到芳基单氨基脲,芳基单氨基脲再与醇反应生成芳基单氨基甲酸酯,然后其再分别与尿素和醇反应最终合成芳基二氨基甲酸酯;也有研究表明,尿素与TDA 容易合成甲苯二脲[12],且耿艳楼等[13]认为以甲苯二脲作为中间体,由尿素、TDA 和正丙醇合成甲苯二氨基甲酸正丙酯的反应路径是存在的。这表明尿素与芳基二胺首先反应过程又可分为上述两种路径。
对于尿素首先与醇反应过程:于剑锋等[14]以甲醇和尿素为原料、有机金属为催化剂,获得了高收率的氨基甲酸甲酯;Merger 等[10]分别以Fe(OAc)2和Zn(OAc)2为催化剂,TDA 分别与氨基甲酸甲酯和氨基甲酸乙酯反应,合成了高收率的甲苯二氨基甲酸甲酯和甲苯二氨基甲酸乙酯,表明尿素先与醇反应得到氨基甲酸酯,然后再与芳基二胺反应得到芳基二氨基甲酸酯路径可行。另外尿素可以与醇反应合成碳酸二甲酯[15],碳酸二甲酯容易与TDA 反应合成甲苯二氨基甲酸甲酯[5]。这表明尿素与醇首先反应过程也可存在两种路径。因此,尿素、芳基二胺与醇反应有可能存在4 种反应路径。
基于上述路径分析,本文认为尿素、TDA 与苯酚合成PTDC 反应式为
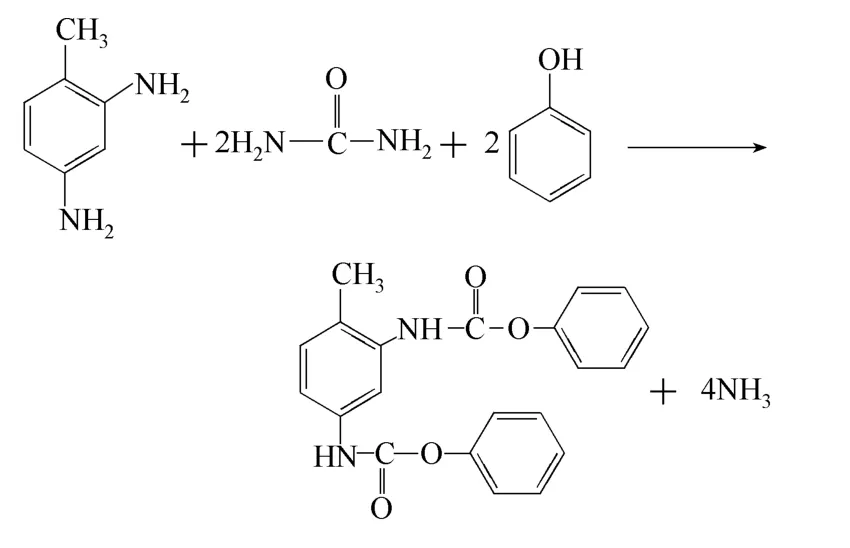
其可能的反应路径为如下4 种。
① 路径Ⅰ 尿素首先与TDA 反应生成甲苯单氨基脲(TU),TU 再与苯酚反应生成甲苯单氨基甲酸苯酯(TMC),然后TMC 与尿素反应得到甲苯单脲基单氨基甲酸苯酯(TUC),最后TUC 与苯酚反应得到PTDC。
② 路径Ⅱ 尿素首先与TDA 反应生成甲苯二脲(TBU),然后TBU 与苯酚反应合成PTDC。
③ 路径Ⅲ 尿素首先与苯酚反应得到氨基甲酸苯酯(PC),然后PC 与TDA 反应生成TMC,TMC 进一步与PC 反应合成PTDC。
④ 路径Ⅳ 尿素首先与苯酚反应生成碳酸二苯酯(DPC),DPC 再与TDA 反应合成PTDC。
2 热力学计算
在热力学计算过程中,除了 NH3和苯酚(phenol)的热力学数据可直接由文献[16-17]获得外,TDA、尿素(urea)以及其他组分的基础热力学数据需要估算。本文采用 Benson 法和Joback 法[18]对各组分的标准摩尔生成热 f,gHΔ⊖、绝对熵S⊝和热容Cp⊝等数据进行估算,热力学计算过程如图1 所示。
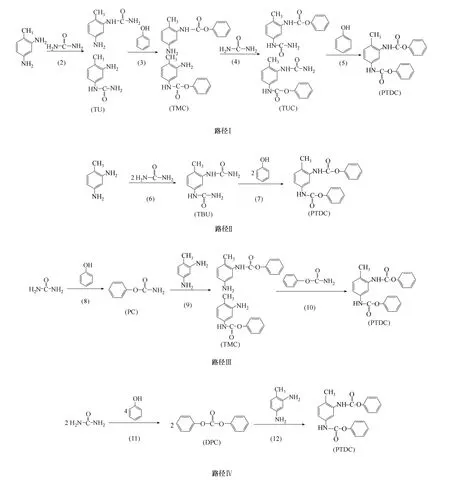
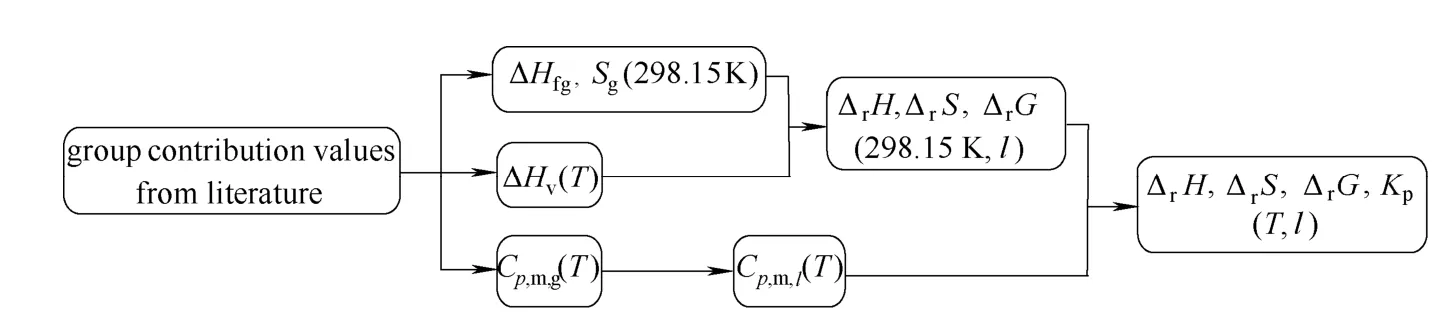
图1 热力学计算过程Fig.1 Thermodynamic calculation process
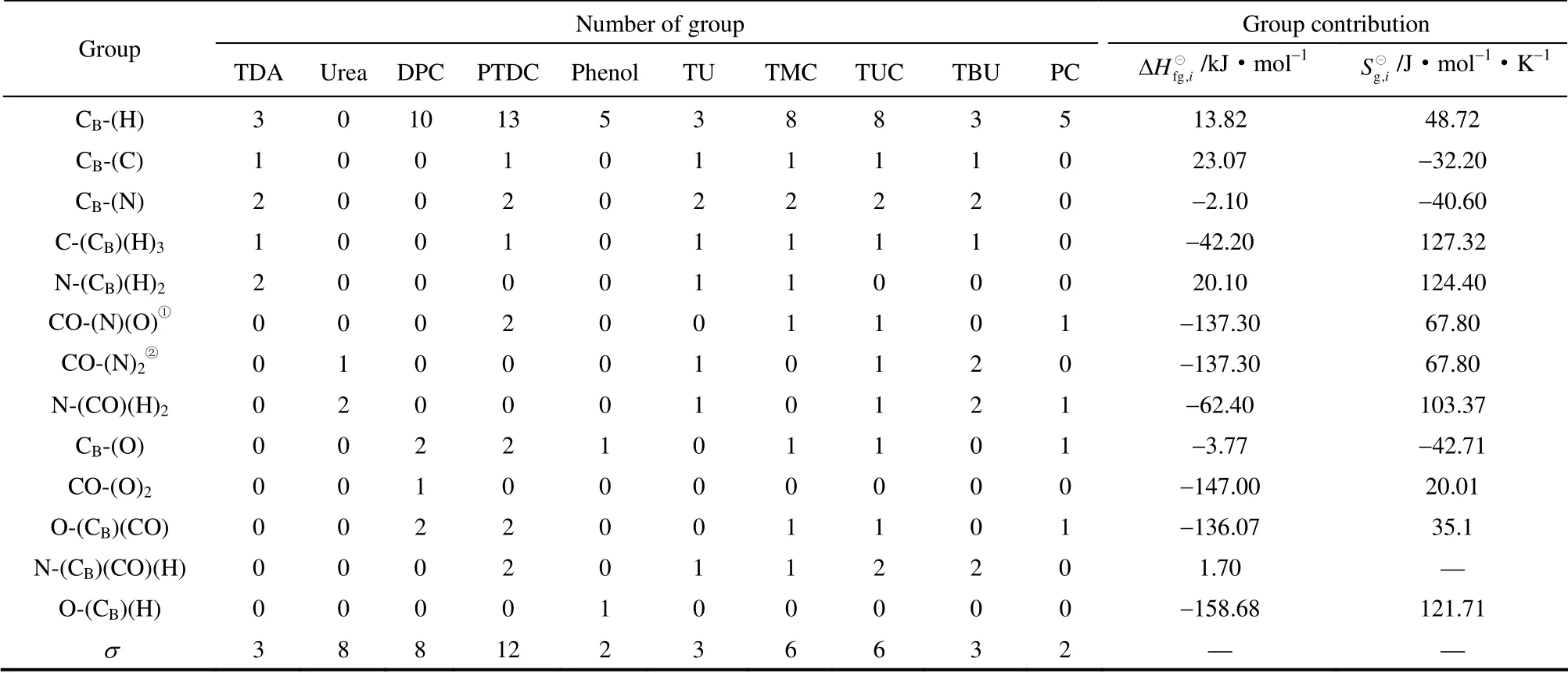
表1 Benson 法基团贡献值(298.15 K)及各组分的对称数[18]Table 1 Benson group contributions (298.15 K) and symmetry number of components
表2 298.15 K 时各组分的气相和Table 2 and of components at 298.15 K(gas phase)

表2 298.15 K 时各组分的气相和Table 2 and of components at 298.15 K(gas phase)
Parameter TDA Urea DPC PTDC TU TMC TUC TBU PC Phenol[17] NH3[16]fg H Δ ⊖/kJ·mol-1 58.33 -262.10 -311.00 -394.55 -159.77 -168.11 -386.21 -377.87 -270.44 -96.36 -46.19 g S⊖/J·mol-1·K-1 399.75 257.25 511.79 676.80 446.52 538.27 585.04 493.29 366.30 316.84 192.51
2.1 298.15 K时理想气体的标准摩尔生成热和绝对熵 的计算
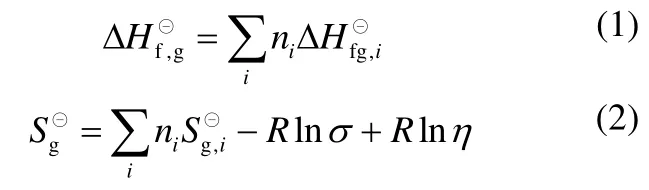
2.2 不同温度汽化潜热的计算
本反应体系为液相反应,除了NH3外其余组分均为液态,因此需要计算298.15 K 时各组分液态的标准摩尔生成热和绝对熵。为此,首先计算不同温度下的汽化潜热。
正常沸点下的汽化潜热按马沛生提出的基团贡献法[20]计算,如式(3)所示,各基团对正常沸点下汽化潜热的贡献值见表3。
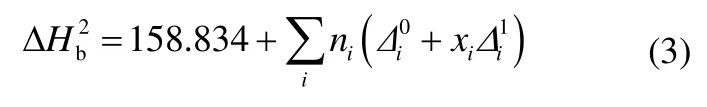
各组分的汽化热与温度的关系采用Watson 经验方程式(4)[20]计算,其中Tr=T/Tc,Tbr=Tb/Tc,n用式(5)[20]计算。正常沸点Tb和临界温度Tc均采用Joback 基团加合法[18]计算,计算式如式(6)、式(7)所示,其中Tb和Tc的基团贡献值见表3,计算得到各组分的Tb、Tc值见表4。

式(8)~式(17)是采用上述Watson 经验方程式(4)计算得到的各组分汽化潜热与温度的关系式。

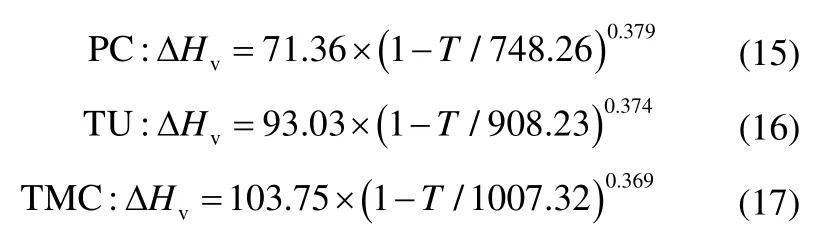
2.3 理想气体热容 的计算
2.4 各组分的液态热容 的计算
表3 、、ΔTbi、ΔTci 和Δpci 的基团贡献值[18,20]Table 3 Group contributions of , , ΔTbi, ΔTci and
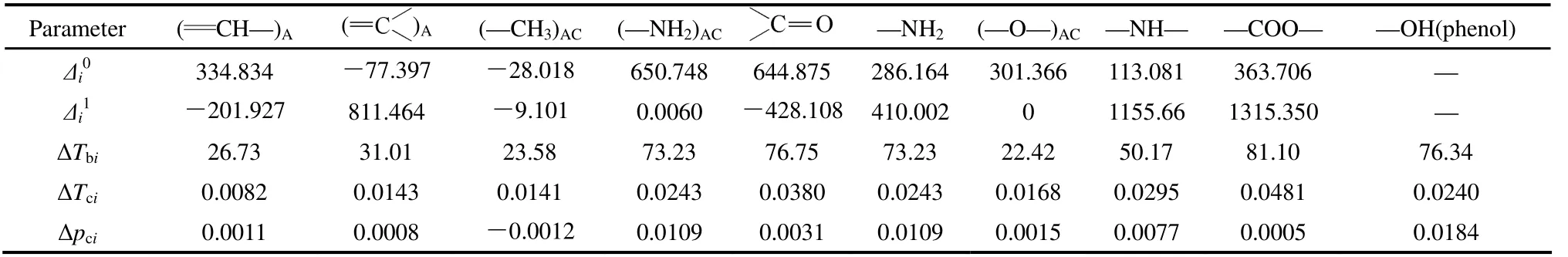
表3 、、ΔTbi、ΔTci 和Δpci 的基团贡献值[18,20]Table 3 Group contributions of , , ΔTbi, ΔTci and
Note: Subscript AC refers to attach directly to aromatic ring.Subscript A refers to aromatic ring group.
Parameter (CH—)A ( )A (—CH3)AC (—NH2)AC —NH2 (—O—)AC —NH— —COO— —OH(phenol) Δi0 334.834 -77.397 -28.018 650.748 644.875 286.164 301.366 113.081 363.706 — Δi1 -201.927 811.464 -9.101 0.0060 -428.108 410.002 0 1155.66 1315.350 — ΔTbi 26.73 31.01 23.58 73.23 76.75 73.23 22.42 50.17 81.10 76.34 ΔTci 0.0082 0.0143 0.0141 0.0243 0.0380 0.0243 0.0168 0.0295 0.0481 0.0240 Δpci 0.0011 0.0008 -0.0012 0.0109 0.0031 0.0109 0.0015 0.0077 0.0005 0.0184
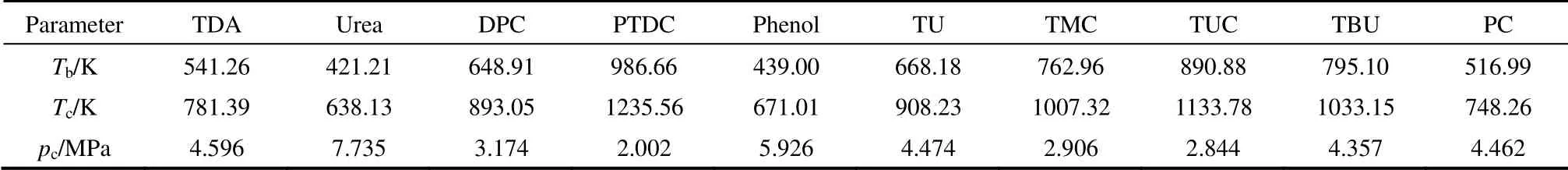
表4 各组分的Tb、Tc、pc 值Table 4 Tb, Tc and pc of components
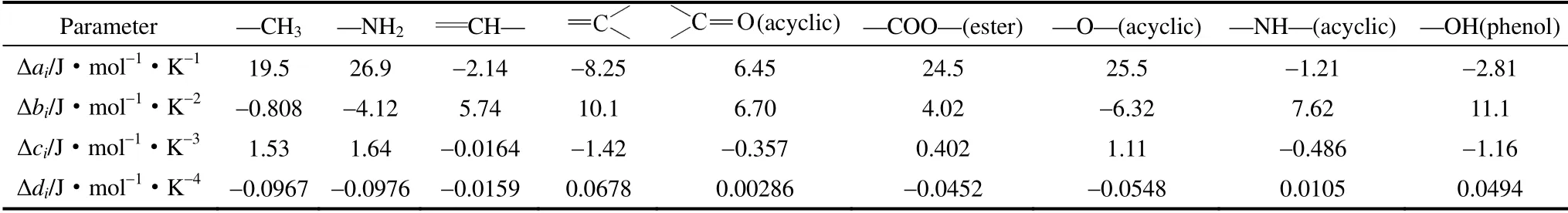
表5 各基团对热容的贡献值[18]Table 5 Heat capacity contributions of groups[18]
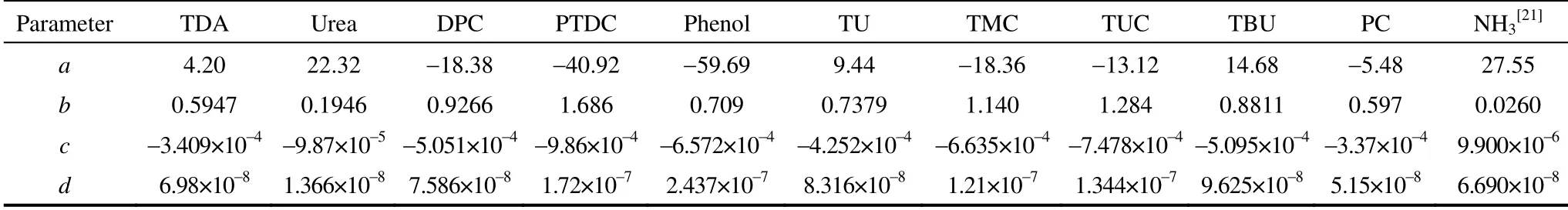
表6 各组分的气态热容系数Table 6 Gaseous heat capacity coefficient of components

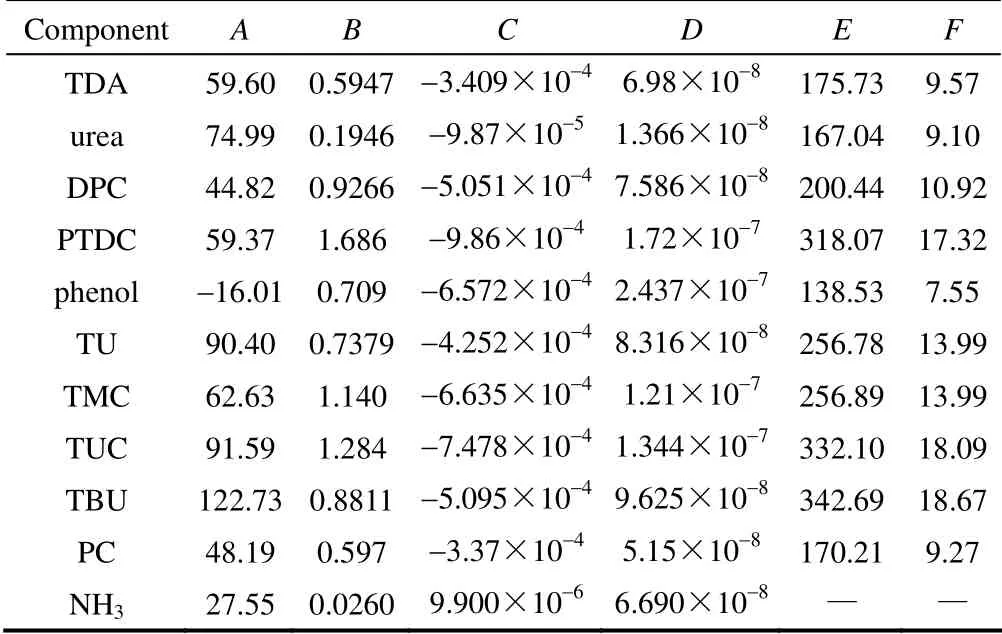
表7 各组分的液态热容系数Table 7 Liquid heat capacity coefficient of components
2.5 298.15 K 时液态反应的焓变、熵变和Gibbs自由能变的计算
本文所涉及的反应体系为液相,因此需要知道298.15 K 下各组分液态的标准摩尔生成热和绝对熵,以便求出反应的焓变和Gibbs 自由能变等。和由式(24)、式(25)计算。
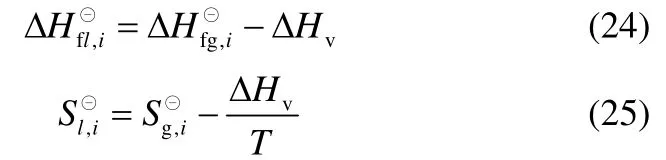
各反应的焓变rHΔ⊖、熵变rSΔ⊖和Gibbs 自由能变rGΔ⊖用式(26)~式(28)计算,计算结果见表8。
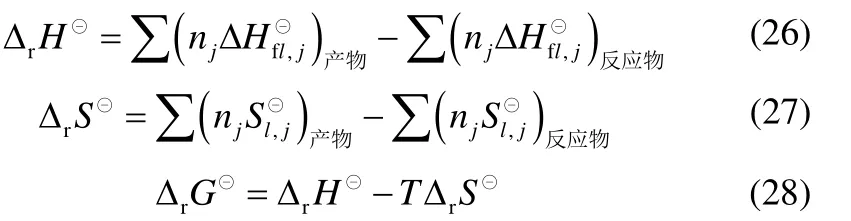
由表8 可以看出:总反应及各个分步反应的焓变均为正值,说明尿素、TDA 和苯酚合成PTDC 的总反应及各路径的分步反应均为吸热反应,升高温度,有利于反应向正方向进行;总反应的Gibbs 自由能变很大,说明总反应在室温下很难进行;在所有各步反应中只有反应(12)的Gibbs 自由能变为负,说明该反应(即TDA 与碳酸二苯酯合成PTDC)在室温下可以自发进行;另外有些反应,如反应(2)(即TDA 与尿素合成甲苯单氨基脲)的Gibbs 自由能变较小,虽然室温下不能自发进行,适当改善反应条件可能比较容易进行。
2.6 不同温度下各反应的焓变、熵变、Gibbs 自由能变和平衡常数的计算
由298.15 K 各液相反应的焓变、熵变以及各组分不同温度的热容可以由式(29)、式(30)求出任意温度下反应的焓变和熵变,由式(31)、式(32)可以得到不同温度下反应的Gibbs 自由能变及平衡常数。
表8 298.15 K 时各反应的 和Table 8 and of reactions at 298.15 K
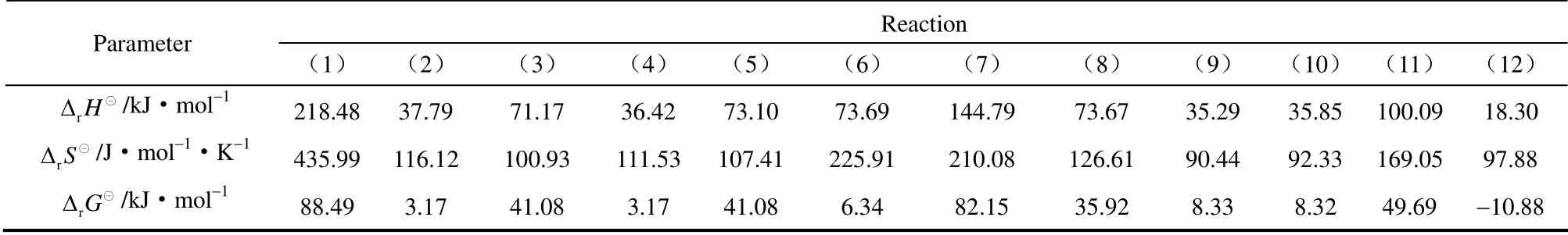
表8 298.15 K 时各反应的 和Table 8 and of reactions at 298.15 K
Reaction Parameter (1) (2) (3) (4) (5) (6) (7) (8) (9) (10) (11) (12)rH Δ ⊖/kJ·mol-1 218.48 37.79 71.17 36.42 73.10 73.69 144.79 73.67 35.29 35.85 100.09 18.30 rS Δ ⊖/J·mol-1·K-1 435.99 116.12 100.93 111.53 107.41 225.91 210.08 126.61 90.44 92.33 169.05 97.88 rG Δ ⊖/kJ·mol-1 88.49 3.17 41.08 3.17 41.08 6.34 82.15 35.92 8.33 8.32 49.69 -10.88
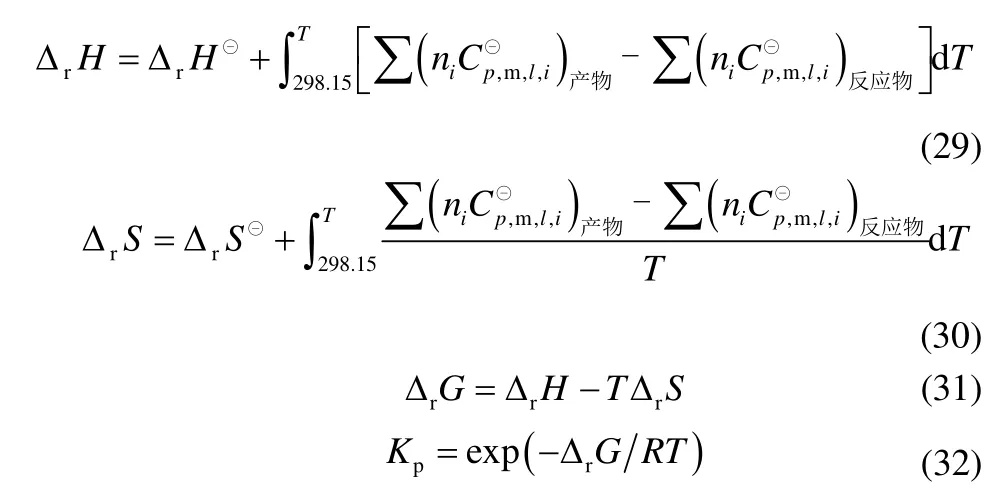
将总反应及各路径中分步反应的焓变、Gibbs自由能变以及平衡常数随温度的变化作图,如图2~图8 所示。
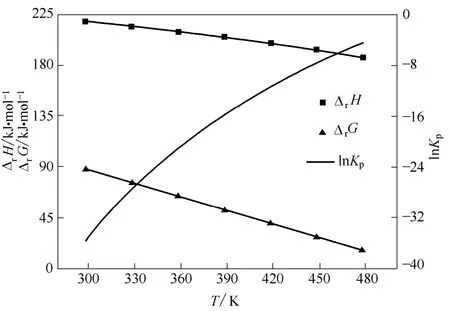
图2 反应(1)的ΔrH、ΔrG 和lnKpFig.2 ΔrH, ΔrG and lnKp of reaction (1)
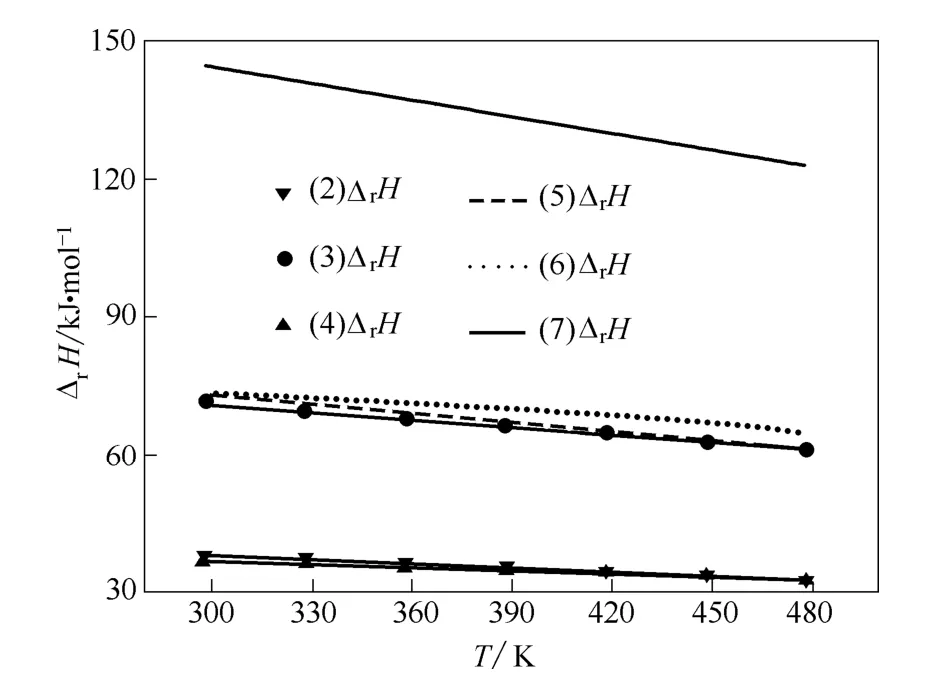
图3 路径Ⅰ和Ⅱ中各步反应的ΔrHFig.3 ΔrH of reactions in path Ⅰ and Ⅱ
3 热力学分析与实验验证
3.1 反应的焓变
由图2~图4 可见:在298.15~478.15 K 温度范围内,总反应与各路径的分步反应的焓变均为正值,说明各步反应均为吸热反应,升高温度有利于向正反应方向进行。
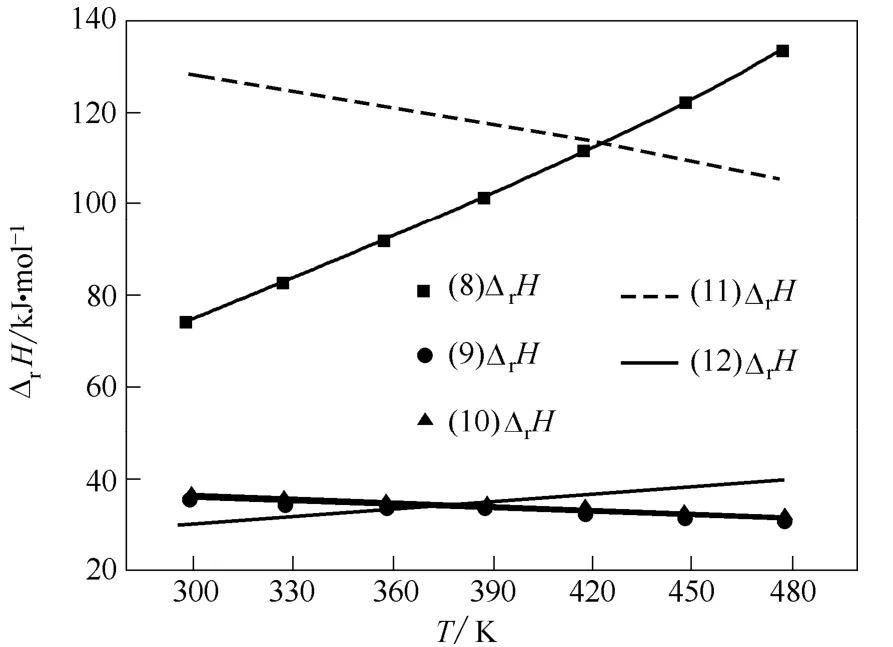
图4 路径Ⅲ和Ⅳ中各步反应的ΔrHFig.4 ΔrH of reactions in path Ⅲ and Ⅳ
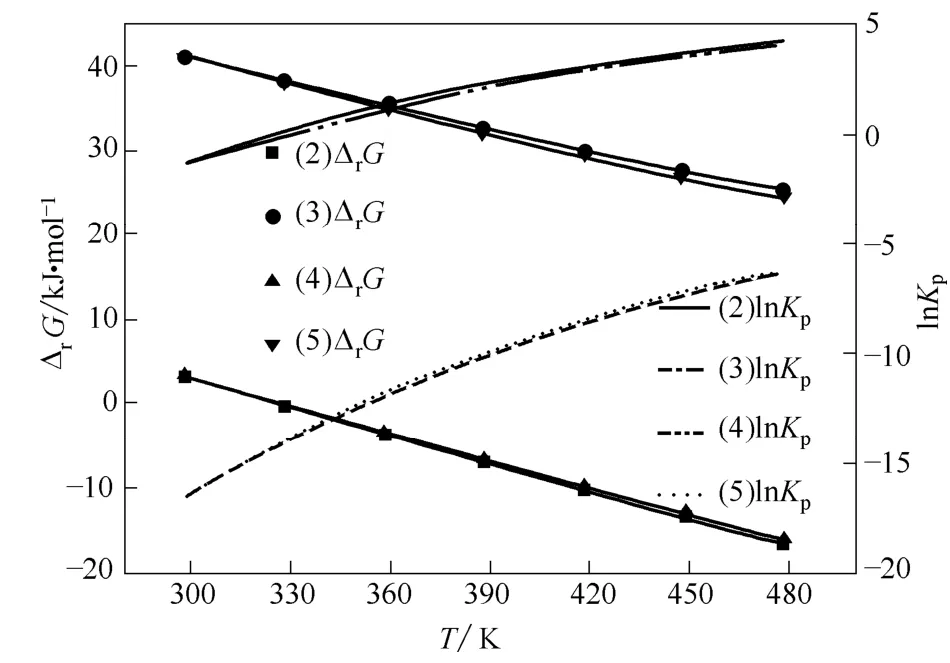
图5 路径Ⅰ中各步反应的ΔrG 和lnKpFig.5 ΔrG and lnKp of reactions in path Ⅰ
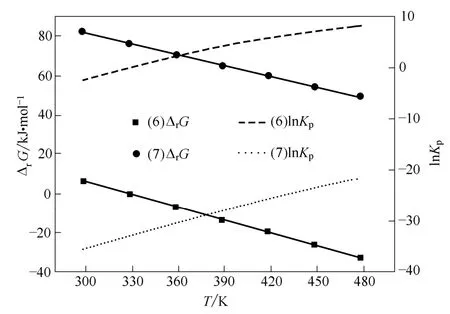
图6 路径Ⅱ中各步反应的ΔrG 和lnKpFig.6 ΔrG and lnKp of each reactions in path Ⅱ
由图3 和图4 可见:在路径Ⅰ中,相同温度下, 反应(3)和(5)的焓变高于反应(2)和(4),则升高温度更有利于反应(3)和(5)。同样,路径Ⅱ中升高温度更有利于反应(7),路径Ⅲ中升高温度更有利于反应(8)。而反应(3)、(5)、(7)和(8)均是苯酚参与的反应,说明相同温度下,各反应路径中有苯酚参与的反应的焓变均较无苯酚参与的反应焓变大。
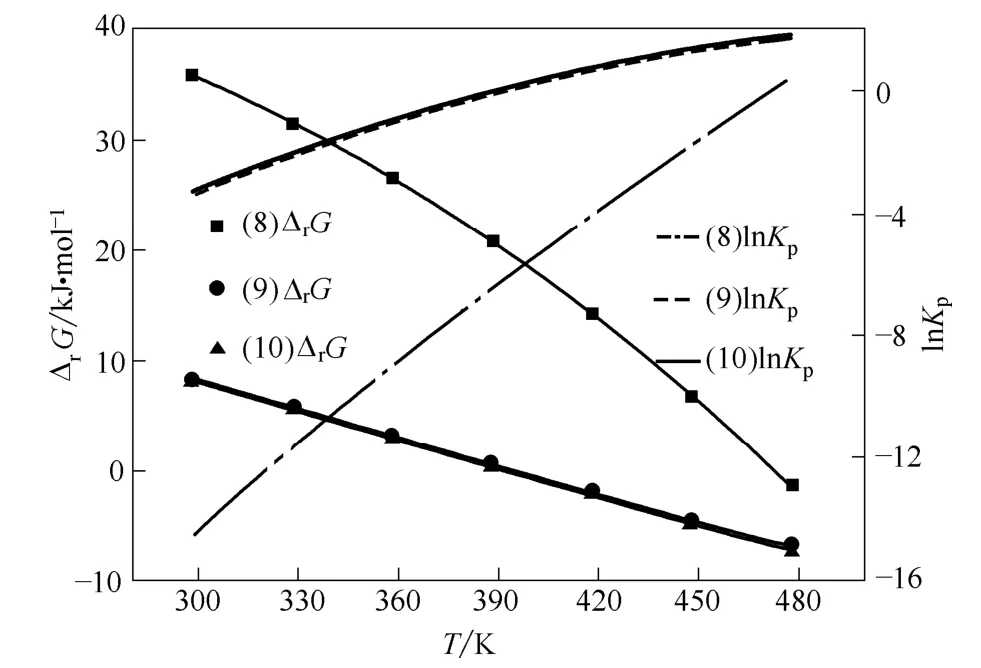
图7 路径Ⅲ中各步反应的ΔrG 和lnKpFig.7 ΔrG and lnKp of reactions in path Ⅲ
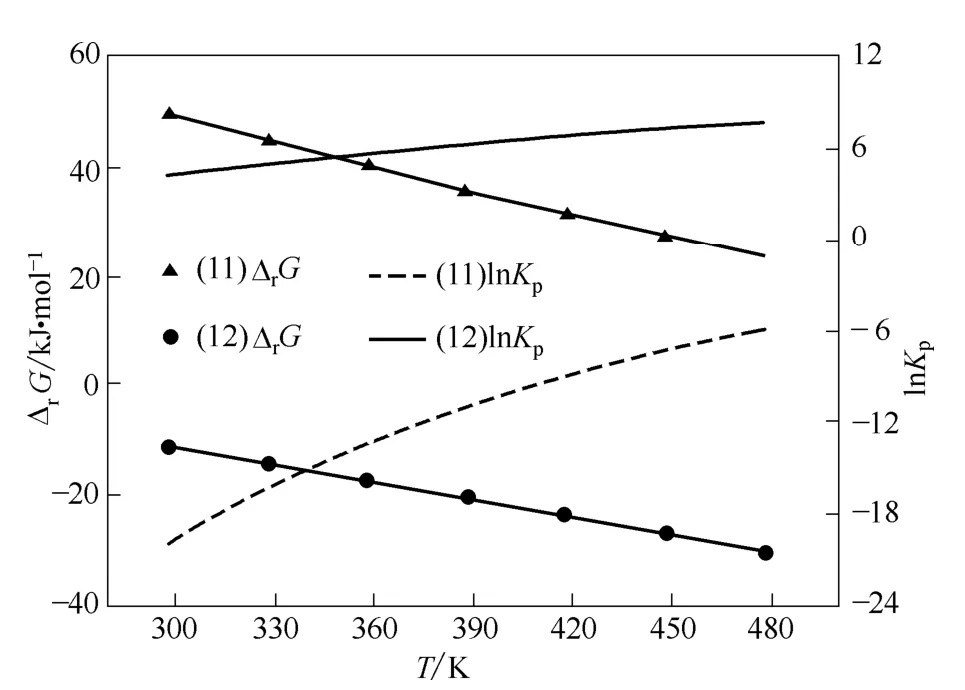
图8 路径Ⅳ中各步反应的ΔrG 和lnKpFig.8 ΔrG and lnKp of reactions in path Ⅳ
3.2 反应的Gibbs 自由能变
由图2 可见:在298.15~478.15 K 温度范围内总反应的Gibbs 自由能变均为正值,且比较大;随着温度升高Gibbs 自由能变虽然在逐渐减小,但仍为正值,所以从热力学角度来看,在此温度范围内,总反应难以自发进行。
由图5 可见:在相同温度下,路径Ⅰ中反应(2)和(4)的Gibbs 自由能变远较反应(3)和(5)的小,所以反应(2)和(4)进行的可能性比反应(3)和(5)大。反应(3)和(5)是有苯酚参与的反应,因此,从热力学角度考虑,该路径中有苯酚参与的反应较无苯酚参与的反应更难进行。温度高于328.15 K 时,反应(2)和(4)的Gibbs 自由能变为负值,说明此温度下该反应路径中尿素参与的反应可以自发进行。
由图6 可见:温度高于328.15 K 时,路径Ⅱ中反应(6)即尿素和TDA 合成甲苯二脲反应的Gibbs自由能变为负值,从热力学角度看,此时该反应可以自发进行。文献[12]对尿素与TDA 合成甲苯二脲反应的实验研究表明:以环丁砜为溶剂、乙酸锌为催化剂、130℃下反应7 h,TDA 转化率可达54.3%,也表明该步反应较容易进行,说明热力学计算预期与文献实验结果一致。随着温度升高,反应(7)的Gibbs 自由能变虽然有所减小,但478.15 K 时仍为正值,反应(7)是苯酚参与的反应,表明此反应路径中苯酚参与的反应难进行。
由图7 可见:当温度高于418.15 K 时,路径Ⅲ中反应(9)和(10)的Gibbs 自由能变为负值,说明此时反应(9)和(10)可以自发进行。温度高于478.15 K 时,反应(8)的Gibbs 自由能变为负值,即此时尿素与苯酚合成氨基甲酸苯酯反应可以自发进行。文献[22]进行尿素与苯酚合成氨基甲酸苯酯反应研究,在以ZnCl2为催化剂、n(尿素):n(苯酚)=1:36、423 K 条件下,氨基甲酸苯酯收率可达64.3%。表明改善反应条件可以实现反应(8)的顺利进行。
由图8 可见,虽然随温度升高,路径Ⅳ中反应(11)的Gibbs 自由能变在减小,但478.15 K 时仍为正值,从热力学角度分析,在低于此温度时该反应不能自发进行。298.15 K 时,反应(12)的Gibbs自由能变为负值,说明TDA 与碳酸二苯酯合成PTDC 反应可以自发进行。文献[23]对TDA 和碳酸二苯酯合成PTDC 反应研究表明,以Ph2P(O)OH[或(BuO)2P(O)OH 和 (BuO)P(O)(OH)2的混合物]为催化剂,363 K 下反应16 h,PTDC 收率可达90%以上,也表明该步反应容易进行。说明热力学计算预期与文献实验结果一致。
可见,在总反应和各路径分步反应中,有尿素参与的反应Gibbs 自由能变较小,温度较高时,Gibbs 自由能变为负值,反应可以自发进行;有苯酚参与的反应Gibbs 自由能变较大,温度高至478.15 K 时,大部分反应的Gibbs 自由能变仍为正值,因此,有尿素参与的反应较容易进行,有苯酚参与的反应较难进行。综合来看,温度高于478.15 K时,路径Ⅲ中各步反应的Gibbs 自由能变均为负值,都能实现自发进行,所以路径Ⅲ是较好的反应路径。
3.3 反应平衡常数
由图2 可见:随着温度升高,总反应的平衡常数逐渐增大,但478.15 K 时,其平衡常数仍很小,所以总反应的平衡转化率会很小。
由图5 可见,随着温度升高,路径Ⅰ各步反应的平衡常数均在增大,当温度高于328.15 K 时,反应(2)和(4)的平衡常数大于1;而温度达478.15K 时,反应(3)和(5)的平衡常数仍很小,预计此反应路径中有苯酚参与的反应转化率很小。
由图6 可见,随着温度升高,路径Ⅱ各步反应的平衡常数均在增大;温度高于428.15 K 时,反应(6)的平衡常数大于1,并随着温度的升高迅速增大,表明由TDA 和尿素反应合成甲苯二脲的转化率会较高。文献[12]对尿素与TDA 合成甲苯二脲反应的实验研究表明,TDA 转化率可达54.3 %,说明热力学计算预期与文献实验结果一致;温度比较高时,反应(7)的平衡常数仍很小,表明此反应路径中有苯酚参与的反应转化率会很小。
由图7 可见,随着温度升高,路径Ⅲ各步反应的平衡常数均增大,当温度高于478.15 K 时,反应(8)的平衡常数才能大于1,从热力学角度看,由尿素和苯酚合成氨基甲酸苯酯反应的转化率不会高;但文献[22]对尿素与苯酚合成氨基甲酸苯酯反应研究表明,氨基甲酸苯酯的收率可达到64.3%,这并非表示热力学计算结果与文献实验结果矛盾,而是由于文献实验是在n(尿素):n(苯酚)=1:36 条件下进行,物料配比远大于化学反应计量系数比,这有助于反应向产物方向进行,获得较高转化率;温度为418.15 K 时,反应(9)和(10)的平衡常数已经大于1,但是随着温度的升高,其平衡常数升高趋势不大,说明升高温度对该反应转化率的影响不会很大。
由图8 可见,随着温度升高,路径Ⅳ各步反应的平衡常数均增大,但温度达478.15 K 时,反应(11)的平衡常数仍很小,从热力学角度看,由尿素与苯酚合成碳酸二苯酯反应的转化率会很小;298.15 K时,反应(12)的平衡常数已经大于1,且随着温度的升高平衡常数迅速增大,因此,从热力学角度分析,由TDA 和碳酸二苯酯合成PTDC 反应的转化率会很高。文献[23]对TDA 和碳酸二苯酯合成PTDC 反应研究表明,在较好反应条件下,PTDC收率达90%以上,说明热力学计算预期与文献实验结果一致。
4 结 论
在缺少热力学基础数据的情况下,采用Benson法、Joback 法等多种估算方法对TDA、尿素和苯酚合成PTDC 反应体系中4 种可能反应路径所涉及的反应进行热力学计算与分析,得到如下结论。
(1)总反应和各个路径的分步反应均为吸热反应,升高温度有利于正反应的进行。
(2)从各反应的Gibbs 自由能变大小分析,在所有反应中,TDA 与碳酸二苯酯合成PTDC 反应是最容易进行的;一般有尿素参与的反应较容易进行,而有苯酚参与的反应较难进行。
(3)从各反应的平衡常数分析,TDA 与碳酸二苯酯合成PTDC 以及尿素与TDA 合成甲苯二脲反应的平衡常数很大,转化率会很高;各反应路径中,有尿素参与的反应,预计转化率较高,而有苯酚参与的反应,转化率会很小。
(4)从热力学角度分析,在各反应路径中均有些反应容易进行,有些较难进行。综合来看,路径Ⅲ在热力学上有较大优势,是较好的反应路径。对于比较难进行的反应,可以通过改善操作条件,促进反应平衡向右移动。
符 号 说 明
Cp,m——摩尔定压热容,J·mol-1·K-1
ΔG ——Gibbs 自由能变,kJ·mol-1
ΔH ——焓变,kJ·mol-1
K ——反应平衡常数
p ——压力,Pa
S ——熵,J·mol-1·K-1
T ——温度,K
Δi——各基团对汽化热的基团贡献值
η ——光学异构体数
σ ——对称数
ω ——偏心因子
上角标
⊝——标准态
下角标
b ——沸点
f ——生成态
g ——气态
l ——液态
r ——反应态
[1]Li Qifeng(李其峰), Wang Junwei(王军威), Kang Maoqing(亢茂青), Wang Xinkui(王心葵), Peng Shaoyi(彭少逸).Progress in non-phosgene synthesis of phenyl carbamate through carbonate process [J].Chemical Bulletin(化学通报), 2003, 66(11): 762-766.
[2]Shi F, Deng Y Q, Sima T L, Yang H Z.A novel PdCl2/ZrO2-catalyst for synthesis of carbamates by oxidative carbonylation of amines [J].Journal of Catalysis, 2001, 203(2): 525-528.
[3]Ma Jianjun(马建军), Feng Huixia(冯辉霞), Pei Xianwu(裴先武), Guo Jingwei(郭静威), Wei Yun(魏云).Production method, current situation and development trend of toluene diisocyanate [J].Applied Chemical Industry(应用化工), 2009, 38(3): 429-434.
[4]Shi Yun(史芸), Zhang Guanglin(张广林), Wang Shengping(王胜平), Ma Xinbin( 马 新 宾 ).Synthesis of isocyanates from dimethylcarbonate [J].Acta Petrolei Sinica: Petroleum Processing Section(石油学报:石油加工), 2010, 26(4): 648-656.
[5]Wang Yanji(王延吉), Wang Guirong(王桂荣), Zhao Xinqiang(赵新强), Li Fang(李芳).A preparation method of dimethyl toluene-2,4- dicarbamate [P]: CN, 1488623A.2004.
[6]Zhao X Q, Wang N, Geng Y L, An H L, Wang Y J.Direct synthesis of dimethyl toluene-2,4- dicarbamate from 2,4-toluene diamine, urea, and methanol [J].Industrial & Engineering Chemistry Research, 2011, 50(24): 13636-13641.
[7]Liu Yuhai(刘玉海), Zhao Hui(赵辉), Li Guoping(李国平).Isocyanate(异氰酸酯) [M].Beijing: Chemical Industry Press, 2004: 134.
[8]Zhang Hailong(张海龙), Zhang Biao(张彪), Dai Zhen(戴震), Wang Cuicui(王萃萃), Xu Gewen(许戈文).Reaction mechanism and applications of blocked isocyanates [J].Coatings Technology & Abstracts(涂料技术与文摘), 2009, 30(2): 14-17.
[9]Ikariya T, Itagaki M, Mizuguchi M, Hachiya T, Hattori T, Nakamura T.Method of manufacturing aromatic urethane [P]: EP, 0437258.1991.
[10]Merger F, Towae F.Process for the preparation of aliphatic di- and polyurethanes [P]: US, 4713476A.1987.
[11]Wang G R, Li X, Wang Y J, Zhao X Q.Mechanism for synthesis of dibutyl toluene-2,4- dicarbamate via urea route catalyzed by γ-Al2O3[J].Industrial & Engineering Chemistry Research, 2014, 53(6): 2130-2136.
[12]Wang N, Geng Y L, An H L, Zhao X Q, Wang Y J.Synthesis of toluene-2,4-bisurea from 2,4-toluene diamine and urea and the reaction kinetics [J].Chinese Journal of Chemical Engineering, 2013, 21(8): 927-932.
[13]Geng Yanlou(耿艳楼), Fang Honggang(方鸿刚), An Hualiang(安华良), Wang Guirong(王桂荣), Zhao Xinqiang(赵新强), Wang Yanji(王延吉).Synthesis of dipropyl toluene-2,4-dicarbamate via urea route [J].Acta Petrolei Sinica: Petroleum Processing Section(石油学报:石油加工), 2013, 29(3): 494-500.
[14]Yu Jianfeng(于剑峰), Tang Shiming(唐仕明), Yuan Cunguang(袁存光).The study of homogeneous catalytic synthesis of carbamate by methanol and urea [J].Chemical Engineering of Oil & Gas(石油与天然气化工), 2005, 34(4): 234-237.
[15]Zhao Xinqiang(赵新强), Wang Yanji(王延吉), Shen Qunbing(申群兵), Yang Hongjian(杨红健), Zhang Jiyan(张继炎).Synthesis of dimethyl carbonate from urea and methanol over metal oxide catalysts [J].Acta Petrolei Sinica: Petroleum Processing Section(石油学报:石油加工), 2002, 8(5): 47-52.
[16]Zhu Ziqiang( 朱 自 强), Wu Youting( 吴 有 庭).Chemical Thermodynamics(化工热力学) [M].Beijing: Chemical Industry Press, 2009: 343-344.
[17]Yao Yunbin(姚允斌), Xie Tao(解涛), Gao Yingmin(高英敏).Physical Chemistry Handbook(物理化学手册) [M].Shanghai: Shanghai Science and Technology Press, 1985: 912-969.
[18]Dong Xinfa(董新法).Property Estimation Theory and Computer Calculation(物性估算原理及计算机计算)[M].Beijing: Chemical Industry Press, 2006: 45, 152-153, 158, 172-176, 195-196.
[19]Wang Guirong(王桂荣), Zhao Xinqiang(赵新强), Wang Yanji(王延吉).Thermodynamic analysis of synthesis of toluene-2,4-dicarbamate [J].Chemical Industry and Engineering(化学工业与工程), 2005, 22(l): 8-13.
[20]Wang Fu’an(王福安).Guide of Chemical Data(化工数据导引)[M].Beijing: Chemical Industry Press, 1995: 116-119.
[21]Song Shimo(宋世漠), Zhuang Gonghui(庄公惠), Wang Zhenglie(王正烈).Physical Chemistry(物理化学)[M].Beijing: Higher Education Press, 1993: 345-370.
[22]Wang Xinping(汪欣萍).Synthesis of diphenyl toluene dicarbamate via urea route—preparation and characterization of intermediates and study on synthesis of phenylcarbamate[D].Tianjin: Hebei University of Technology, 2014.
[23]Michele A, Angela D, Eugenio Q.Reaction of aromatic diamines with diphenylcarbonate catalyzed by phosphorous acids: a new clean synthetic route to mono- and dicarbamates [J].Tetrahedron, 1998, 54(46): 14145-14156.
