花生果针离体培养研究
2015-08-18李长生夏晗赵传志侯蕾张烨赵术珍
李长生+夏晗+赵传志+侯蕾+张烨+赵术珍

摘 要:以中华8号花生品种为试材,研究了GA、6-BA和生长素(IAA和NAA)对花生果针离体培养的影响。结果表明,花生果针离体培养的最佳培养基配方为MS 培养基的无机盐成分、B5培养基的有机成分、300 mg/L水解酪蛋白、6%蔗糖、1.0 mg/L GA、0.5 mg/L IAA和0.01 mg/L 6-BA,在此条件下,花生子房膨大率为72%。
关键词:花生;果针;子房;离体培养
中图分类号:S565.201 文献标识号:A 文章编号:1001-4942(2015)06-0008-04
Study on Peg Culture in Vitro of Peanut
Li Changsheng, Xia Han, Zhao Chuanzhi, Hou Lei, Zhang Ye, Zhao Shuzhen*
(Biotechnology Research Center, Shandong Academy of Agricultural Sciences/Shandong
Provincial Key Laboratory of Crop Genetic Improvement, Ecology and Physiology, Jinan 250100, China)
Abstract Using Zhonghua 8 as experimental material, the effects of GA, 6-BA and auxin (IAA and NAA) on peg culture in vitro of peanut were studied. The results indicated that the optimum medium contained inorganic salts of MS, organic constituents of B5, 300 mg/ L casein hydrolysate and 6% sucrose and supplemented with 1.0 mg/L GA, 0.5 mg/L IAA and 0.01 mg/L 6-BA. Under this condition, the peanut ovary enlargement rate was 72%.
Key words Peanut; Peg; Culture in vitro
花生是我国最重要的油料作物之一。我国花生总产量占全国油料作物总产量的1/2,占世界花生总产量的2/5,居世界第一位,实现花生产业全面、协调、可持续发展对保障我国粮油安全具有重要意义[1]。花生遗传多样性低[2],利用生物技术进行种质创新和品种培育,是实现我国花生遗传改良新飞跃的关键。然而,花生的分子生物学研究远落后于其它农作物,对花生重要农艺性状形成的分子机理研究甚少。因此,加快花生分子生物学研究进程,揭示花生产量、品质形成的分子机理,对利用现代生物技术手段结合传统育种方式培育花生高产、优质和抗病品种具有重要意义。
花生与大豆、油菜、拟南芥有很大不同,花生植株在地上部分开花,授粉后合子只分裂几次便停止,子房在受精后的一段时间内并未明显膨大,子房柄却不断伸长。伸长的子房柄和未膨大的受精子房形成一针状结构,称为“果针”。在正常生长的花生植株上,随着果针的伸长,受精子房被推入土壤中,在黑暗条件下开始膨大,最终发育成荚果[3~6]。如果人为阻止果针入土,在光照条件下果针将不能膨大形成荚果[4,7,8]。黑暗和机械刺激曾被认为是果针入土后导致荚果膨大的主要原因[9],但其诱导荚果发育的分子机理尚不清楚。在模式植物拟南芥中的研究表明,激素信号是外界环境调控植物生长发育的桥梁。由于在大田栽培条件下对果针处理受环境影响较大,为获得均一的试验材料以研究黑暗和机械刺激诱导基因表达变化、激素合成和信号传导等的变化,建立和优化果针离体培养体系尤为重要,其优势在于不受季节限制,能够精确控制处理强度、时间等各种因素,可为花生荚果膨大机理的研究提供稳定可靠的试验材料。
1 材料与方法
1.1 试验材料
1.1.1 试验品种 供试花生品种为中华8号,由中国农业科学院油料作物研究所提供。
1.1.2 培养基 基本培养基为MS 培养基的无机盐成分、B5培养基的有机成分、300 mg/L水解酪蛋白和6%蔗糖。配方如下:
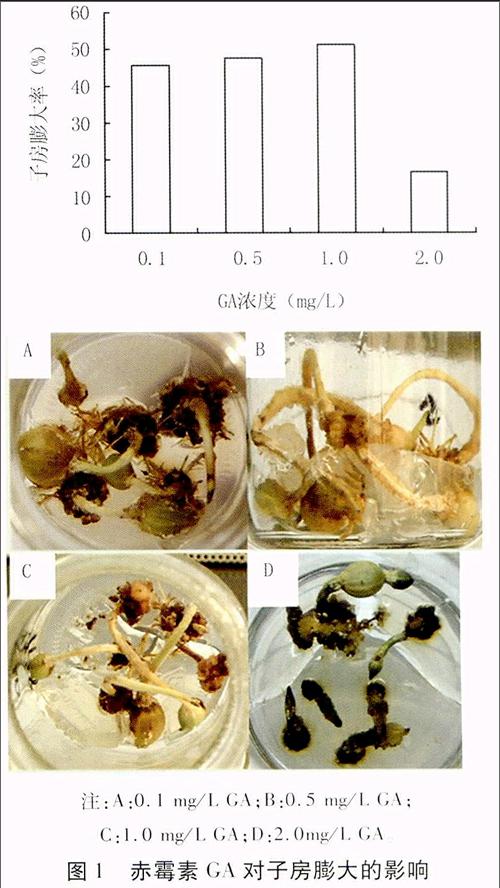
① GA浓度对子房膨大的影响
A: 基本培养基+0.05 mg/L 6-BA+1.0 mg/L NAA+0.1 mg/L GA
B: 基本培养基+0.05 mg/L 6-BA+1.0 mg/L NAA+0.5 mg/L GA
C: 基本培养基+0.05 mg/L 6-BA+1.0 mg/L NAA+1.0 mg/L GA
D: 基本培养基+0.05mg/L 6-BA+1.0mg/L NAA+2.0 mg/L GA
② 6-BA浓度对子房膨大的影响
E: 基本培养基+0.5 mg/L GA+1.0 mg/L NAA+0.01 mg/L 6-BA
B: 基本培养基+0.5 mg/L GA+1.0 mg/L NAA+0.05 mg/L 6-BA
F: 基本培养基+0.5 mg/L GA+1.0 mg/L NAA+0.1 mg/L 6-BA
③ IAA浓度对子房膨大的影响
G: 基本培养基+0.5 mg/L GA+0.05 mg/L 6-BA+0.5 mg/L IAAendprint
H: 基本培养基+0.5 mg/L GA+0.05 mg/L 6-BA+1.0 mg/L IAA
I: 基本培养基+0.5 mg/L GA+0.05 mg/L 6-BA+2.0 mg/L IAA
④NAA浓度对子房膨大的影响
使用培养基B和H的试验结果,进行比较。
1.2 试验方法
选取饱满的花生种子于2014年5月初播种于大田。开花后取第二、三节位长3 cm且粗细一致的花生果针,用自来水冲洗干净,70%酒精表面消毒5 s,再用0.1%升汞表面消毒8 min,无菌水冲洗3次,然后切取果针顶端1 cm左右(带子房和部分子房柄),子房朝上垂直接种于培养基上。接种后置于完全黑暗条件下培养。培养温度25±1℃, 相对湿度40%~60%。每处理10瓶,每瓶培养基中放5个果针。
子房膨大率(%)=每瓶培养基中膨大的果针数/接种果针总数×100
2 结果与分析
2.1 GA浓度对子房膨大的影响
由图1可以看出,在6-BA (0.05 mg/L)和NAA(1.0 mg/L )浓度不变的条件下,花生子房膨大率随GA浓度的升高先增大后减小,当GA浓度为1.0 mg/L时,子房膨大率达最大,为51.1%。表明适宜浓度的GA可以促进子房的膨大,但GA浓度过高则会抑制子房的膨大。
注:A:0.1 mg/L GA;B:0.5 mg/L GA;
C:1.0 mg/L GA;D:2.0mg/L GA。
图1 赤霉素GA对子房膨大的影响
2.2 6-BA浓度对子房膨大的影响
由图2可知,随着6-BA浓度的增加,花生子房膨大率逐渐降低。当6-BA浓度为0.01 mg/L时,膨大率为72%,而当6-BA浓度达到0.10 mg/L后,子房膨大率仅为29.2%。
注:E:0.01 mg/L 6-BA;B:0.05 mg/L 6-BA;F:0.1 mg/L 6-BA。
图2 6-BA对子房膨大的影响
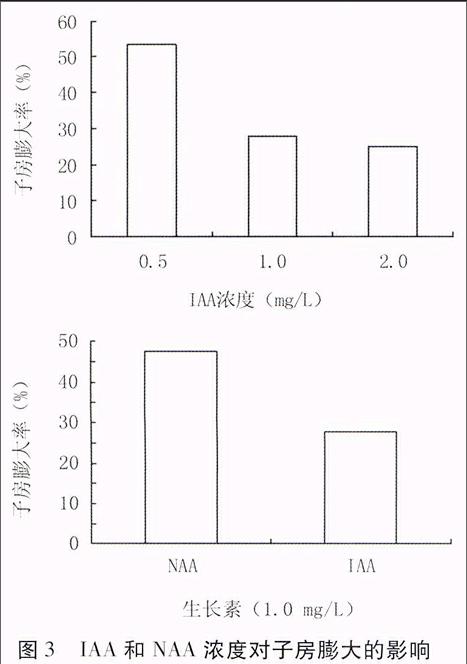
2.3 IAA和NAA浓度对子房膨大的影响
由图3可知,当NAA与IAA浓度均为1.0
图3 IAA和NAA浓度对子房膨大的影响
mg/L时,NAA处理的花生子房膨大率高于IAA。由于IAA是植物体内存在的激素,适当降低IAA浓度至0.5 mg/L,效果优于1.0 mg/L的NAA,子房膨大率可达53.3%。
3 结论与讨论
激素在植物生长发育过程中具有重要的调控作用,花生胚胎发育状况与内源激素的代谢密切相关[10]。许多研究表明,花生子房膨大受到内源植物激素的调节[7~9,11],但哪种激素起主要作用仍存在争议。封海胜等认为GA在子房膨大过程中起主要作用[12];而冯启理和潘瑞炽[13]认为NAA 是诱导子房膨大的主要激素,GA 是促进子房柄伸长的主要激素,花生果针能否从伸长生长转入膨大生长,与这两种激素的平衡状况有关[13]。而从豌豆和西红柿果实发育的研究中发现生长素和GA是协同起作用的[14,15]。正常情况下拟南芥荚果发育需要受精作用的完成,受精诱导种子中生长素的合成,而生长素激活了胚珠中GA代谢,GA促进荚果正常发育[16,17]。Feng等[18]报道0.5 mg/L或2.0 mg/L NAA有利于荚果形成和胚胎发育;而随后,Feng等[19]研究又表明2.0 mg/L NAA不利于荚果和胚胎发育,并推测这种试验结果的矛盾可能是两次试验中培养基营养成分及环境条件不同改变了植物材料对激素的需求和响应。本试验结果表明,合适的GA浓度有利于子房膨大;生长素是子房膨大不可缺少的,而且较低浓度的IAA比NAA效果更好;较高浓度的6-BA并不利于子房膨大。
Feng等[19]在培养基中添加1.0 mg/L NAA 和0.5 mg/L GA时子房膨大率达到81%,但笔者利用该培养基培养离体果针时子房膨大率均未超过60%,而在培养基中添加0.01 mg/L 6-BA、1.0 mg/L NAA 和0.5 mg/L GA时子房膨大率达72%。综合各种激素浓度的影响,本试验所得花生果针最佳离体培养基为在MS 培养基的无机盐成分、B5培养基的有机成分、300 mg/L水解酪蛋白和6%蔗糖基础上添加1.0 mg/L GA、0.5 mg/L IAA和0.01 mg/L 6-BA。
参 考 文 献:
[1] 汤松,禹山林,廖伯寿,等. 我国花生产业现状、存在问题及发展对策[J].花生学报,2010,39(3):35-38.
[2] Pandey M K,Monyo E,Ozias-Akins P,et al. Advances in Arachis genomics for peanut improvement[J]. Biotechnol. Adv.,2012,30(3):639-651.
[3] Zharare G E,Blamey F P,Asher C J. Initiation and morphogenesis of groundnut (Arachis hypogaea L.) pods in solution culture[J]. Ann. Bot.,1998,81:391-396.
[4] Moctezuma E. The peanut gynophore: a developmental and physiological perspective[J]. Can. J. Bot.,2003,81:183-190.endprint
[5] Xia H,Zhao C Z,Hou L,et al. Transcriptome profiling of peanut gynophores revealed global reprogramming of gene expression during early pod development in darkness[J]. BMC Genomics,2013,14:517.
[6] Zhu W,Chen X,Li H,et al. Comparative transcriptome analysis of aerial and subterranean pods development provides insights into seed abortion in peanut [J]. Plant Mol. Biol.,2014,85(4-5):395-409.
[7] Zamski E,Ziv M. Pod formation and its geotropic orientation in peanut, Arachis hypogaea L.,in relation to light and mechanical stimulus[J]. Ann. Bot.,1975,40:631-636.
[8] Thompson L K,Ziv M,Deitzer G F. Photocontrol of peanut (Arachis hypogaea L.) embryo and ovule development in vitro [J]. Plant Physiol.,1985,78:370-373.
[9] 潘瑞炽,陈惜吟,罗蕴秀.花生入地结荚原因的研究[J].植物生理学报,1983,9:109-116.
[10]张新友,徐静, 汤丰收,等.花生种间杂种胚胎发育及内源激素变化[J]. 作物学报,2013,39(6):1127-1133.
[11]Lee T A,Ketring D L,Powell R D. Flowering and growth response of peanut plants (Arachis hypogaea L. var. Starr) at two levels of relative humidity[J]. Plant Physiol.,1972,49(2):190-193.
[12]封海胜,申馥玉,顾淑媛,等. 花生子房离体培养研究简报[J].中国油料,1980(2):69-72.
[13]冯启理,潘瑞炽. NAA,GA3和BA 对离体花生子房结荚的影响[J].植物生理学报,1989,15(2):111-116.
[14]Ozga J A, Reinecke D M. Interaction of 4-chloroindole-3-acetic acid and gibberellins in early pea fruit development [J]. Plant Growth Regul.,1999,27:33-38.
[15]Serrani J C,Ruiz-Rivero O,Fos M,et al. Auxin-induced fruit set in tomato is mediated in part by gibberellins[J]. Plant J.,2008,56:922-934.
[16]Vivian-Smith A,Luo M,Chaudhury A,et al. Fruit development is actively restricted in the absence of fertilization in Arabidopsis[J]. Development,2001,128:2321-2331.
[17]Dorcey E,Urbez C,Blazquez,et al. Fertilization dependent auxin response in ovules triggers fruit development through the modulation of gibberellin metabolism in Arabidopsis[J]. Plant J.,2009,58(2):318-332.
[18]Feng Q L,Stalker H T,Pattee H E,et al. Arachis hypogaea plant regeneration through in citro culture of peg tips[J]. Peanut Sci.,1995,22:129-135.
[19]Feng Q L,Pattee H E,Stalker H T. In vitro reproductive development of peanut,Arachis hypogaea L.,as influenced by plant growth regulators, sucrose and pH[J].Peanut Sci.,1995,22(2):135-141.endprint
