鸭坦布苏病毒病发病模型的建立
2015-08-12周晓波卞红春
周晓波 李 银 杨 凌 朱 明 卞红春
(①江苏省盐城市畜牧兽医站 224000 ②江苏省兽医研究所)
鸭坦布苏病毒病发病模型的建立
周晓波①李 银②杨 凌①朱 明①卞红春①
(①江苏省盐城市畜牧兽医站224000②江苏省兽医研究所)
摘要为疫苗的研究提供工具,建立鸭坦布苏病毒病发病模型,将168只35日龄无坦布苏病毒感染的樱桃谷肉鸭随机分成7组,每组24只,其中1~6组分别以不同含量的鹅源坦布苏JS804株病毒肌肉注射进行攻毒,对照组肌肉注射相同剂量的PBS。攻毒后每天观察临床症状。分别于攻毒后2、4、6、8、13、20d每组随机取4只攻毒鸭扑杀,分别取每只鸭各脏器样品2份,一份放-20℃冻存,用于套式RT-PCR检测病毒;另一份用4%多聚甲醛固定,用于免疫组织化学分析和组织病理学分析。结果表明:试验鸭于攻毒后腿瘫、头颈扭曲、行走不稳;各主要脏器均出现病变,其中以脾脏、肝脏、脑最为明显;套氏RT-PCR,攻毒后8日各脏器病毒阳性检出率最高,其中以脾脏检出率最高;由攻毒检测结果确定鸭的攻毒量为1.6×106TCID50。脑神经元细胞变性、坏死;肝细胞水泡变性、肝小叶结构破坏;脾脏淋巴细胞变性、坏死。免疫组化定位发现:心肌纤维细胞、脾脏生发中心、肺泡上皮细胞、肾小球上皮细胞、脑血管内皮细胞、肝细胞均有棕黄色阳性信号。本试验成功建立了鸭坦布苏病毒病樱桃谷肉鸭发病模型,为今后研制疫苗及免疫效果判定奠定了基础。
关键词鸭坦布苏病毒病发病模型免疫组织化学
从2010年4月起,我国东南水禽养殖大省(市、自治区)的鸭、鹅发生一种以采食量显著下降、产蛋严重下降、具有脑炎样神经症状的传染病[1,2]。发病的种鸭、蛋鸭产蛋率大幅下降甚至绝产,其死亡率为2%~15%,肉鸭、肉鹅死亡率为10%~55%,给鸭鹅养殖业造成巨大的经济损失。通过流行病学调查、病原分离、动物回归试验及基因测序分析等,已证实该病为不同于现有资料报道的一种新发黄病毒感染[3~7]。2011年,中国畜牧兽医学会第一届水禽疫病防控研讨会将该病统一命名为“鸭坦布苏病毒病”。为研究坦布苏病毒病的发病机制和将来研制疫苗提供帮助,本试验开展了鸭坦布苏病毒病发病模型建立的研究。
1 材料与方法
1.1毒株与试验动物鹅源坦布苏病毒JS804株由江苏省农业科学院兽医所禽病研究室分离、鉴定、保存;35日龄樱桃肉鸭购自丹阳某养鸭场,ICR乳鼠购自扬州大学比较医学实验中心。
1.2主要试剂和仪器DNA抽提试剂盒、AMV Reverse Transcriptase、Random Primer(9mer)、rTaxDNA聚合酶及DNA marker(DL2000)购自Takara公司;免疫组织化学所用一抗为本实验室保存的鼠源多抗(效价1:5000);PBS液(0.01M,pH=7.2)、柠檬酸缓冲液(0.01M,pH=6.0)、4%多聚甲醛溶液、即用型SABC免疫组化染色试剂盒、DAB显色试剂盒、切片石蜡(56~58℃)、中性树胶均购自博士德生物制药有限公司。RM2015病理切片机、徕卡HI1210摊片机购自德国徕卡仪器有限公司;隔水式电热恒温培养箱购自上海市跃进医疗器械一厂。
1.3病毒TCID的测定病毒增殖后按照殷震方法[8]50接种BHK-21细胞,测定病毒毒价。
1.4试验动物分组与攻毒168只35日龄无坦布苏病毒感染的樱桃谷肉鸭,随机分成7组,按表1进行攻毒。

表1 分组与攻毒情况 (只、ml)
隔离分开饲养,攻毒后每天观察临床症状,分别于攻毒后2、4、6、8、13、20d分6批次进行剖杀取病料,每次每组随机抽取4只,放血处死。快速取每一组织器官各两份,一份用4%多聚甲醛固定,用于免疫组织化学和病理学分析;另一份放-20℃冻存,用于套式RT-PCR检测病毒。
1.5剖检病变观察剖杀鸭子时注意观察肝脏、脾脏、脑、心肌等是否有病变并进行拍照。
1.6套式RT-PCR检测按照RNAiso plus试剂盒说明书要求从病料提取总RNA,参照黄欣梅等[9]的介绍合成引物,进行套式RT-PCR。取10μl PCR产物用1%琼脂糖凝胶电泳并观察结果。
1.7主要脏器组织病理观察将扑杀鸭各器官经4%多聚甲醛溶液固定,制备石蜡切片[10],经苏木精-伊红染色[11]后镜检,观察病理变化。
1.8主要脏器免疫组织化学(IHC)分析取扑杀鸭各器官经4%多聚甲醛溶液固定24h以上,SABC法进行免疫组织化学[12,13]分析。
2 结果
2.1病毒的滴度增殖的病毒在BHK-21细胞上测定的病毒毒价为106.30TCID50/0.1ml。
2.2临床症状及剖检变化(1)临床症状:第1组鸭攻毒后第2天开始精神不振,采食量开始下降;第6天1~5组攻毒鸭采食量均显著下降,排白绿色粪便;第15天食量开始恢复,白绿色粪便逐渐减少;第20天采食量等均恢复至正常水平。攻毒后第4天有轻微神经症状,轻度腿瘫;第8天神经症状明显,表现腿瘫、趴卧、头颈扭曲、行走不稳、共济失调,躺卧时两腿向后伸展,严重的倒地不起;第16天神经症状逐渐减轻;第20天神经症状消失。攻毒鸭与对照鸭相比长势慢、体型小、瘦弱。6组没有明显症状,7组无肉眼可见症状。(2)剖检变化:1组鸭攻毒后4d肝脏轻微肿大,边缘轻微出血;脾脏轻微肿大,局部坏死。攻毒后6d肝脏肿大,边缘出血;脾脏肿大,局部有小坏死灶;腿肌轻微出血;心脏外壁出血,个别心内膜出血;脑水肿、充血。攻毒后8天脾脏斑驳似大理石样外观,肿大坏死,形似乒乓球;肝脏肿大呈土黄色,边缘出血或淤血;脑膜出血,脑轻度水肿、充血、有散在的出血点;腿肌出血;心肌外观苍白,有白色条纹状坏死,有的心脏外壁有出血,多数病例心脏内膜出血;肺脏淤血、水肿;肾脏充血,轻微肿大;胰脏有轻微的出血或坏死点。2组鸭剖检病变同1、3、4、5组病变依次减轻。6组没有明显病变,7组无病变。
2.3套式RT-PCR检测(1)1组攻毒后8d套式RT-PCR检测结果:具体结果见图1。1组攻毒后其它时间和其它各组攻毒后套式RT-PCR检测结果见表2、3、4。(2)1组鸭扑杀后套式RT-PCR阳性统计情况:具体结果见表2。(3)各组鸭不同时间扑杀后套式RT-PCR阳性率统计结果:具体结果见表3。(4)各组鸭不同时间扑杀后各脏器套式RT-PCR阳性率统计结果:具体结果见表4。
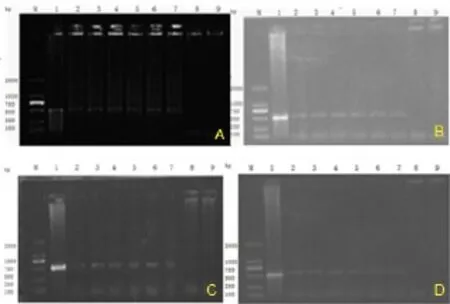
图1 1组攻毒后8d各组各脏器检测结果
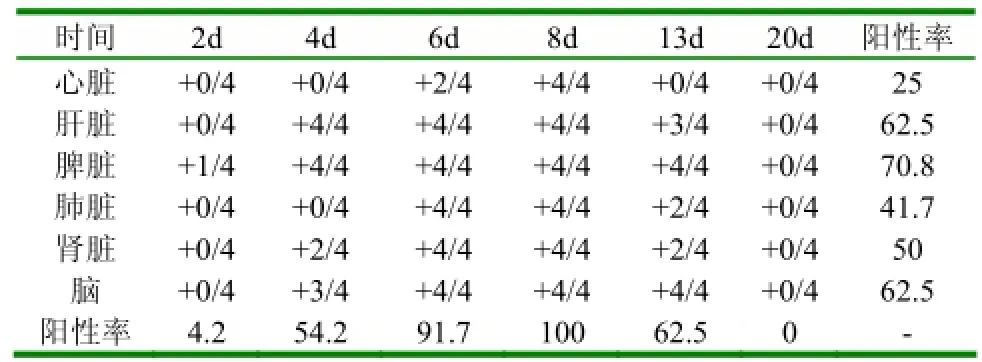
表2 1组鸭扑杀后套式RT-PCR阳性统计分析结果 (%)
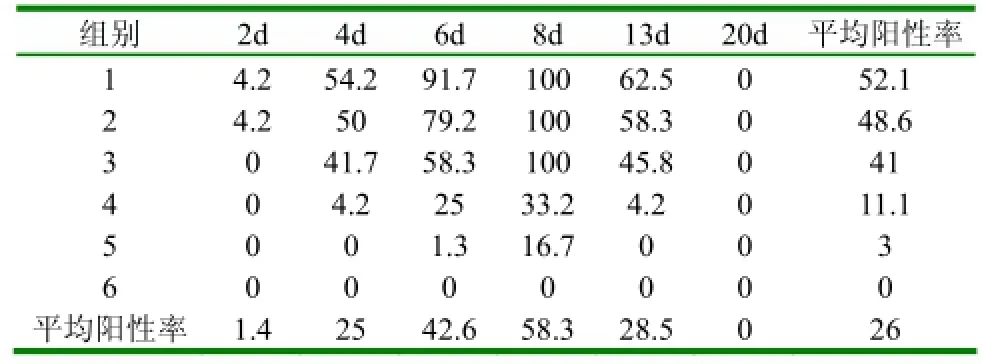
表3 各组鸭攻毒后不同时间扑杀后套式RT-PCR阳性率 (%)
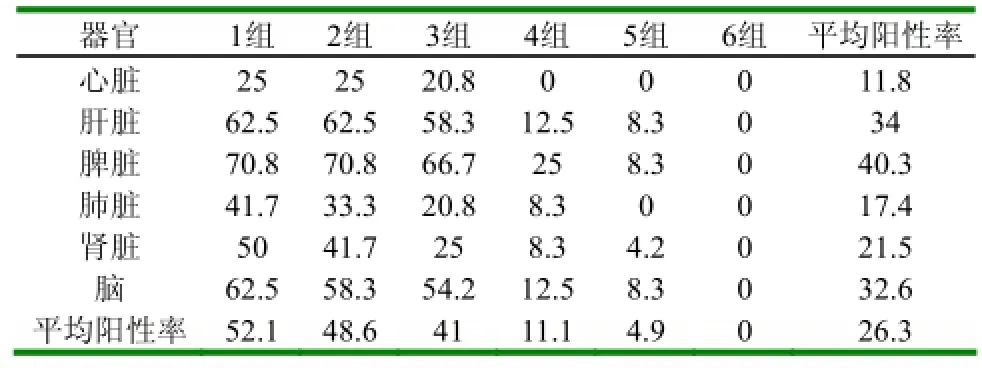
表4 不同组鸭扑杀后各脏器套式RT-PCR阳性率 (%)
从表3和表4可以看出:3组在攻毒后8d检测率高达100%,攻毒后不同时间脾脏平均检测阳性率高达66.7%。2.4病理组织学变化选择3组做组织病理学分析,主要脏器均出现病理病化,尤其以脑、肝脏、脾脏病变最为明显,均出现了组织结构破坏、细胞坏死,对照组未见明显病理变化。病理变化见图2。

图2 病理组织学观察结果(HE染色× 400)
2.5免疫组织化学分析选择攻毒组3组进行免疫组织化学分析,在心脏、脾脏、肺脏、肾脏、脑组织均发现阳性细胞,尤其以脾脏、脑组织内居多。具体结果见图3。

图3 免疫组化分析结果(IHC染色×400)
3 讨论
(1)鸭坦布苏病毒是流行于我国的一种新型黄病毒病,从2010年4月起发生在我国东南部,迅速蔓延至我国主要养鸭省市包括浙江、江苏、江西北京、湖北等[2-5,14-16]地,给养鹅、养鸭业带来巨大的经济损失。(2)本研究选择35日龄樱桃谷肉鸭,腿肌肌肉注射鹅黄病毒JS804毒株。通过临床症状、组织病理学、免疫组织化学等方面来研究攻毒模型。临床症状表明攻毒剂量越大的组症状越严重;临床剖检也是攻毒剂量越大的组眼观病变越严重;套氏RT-PCR攻毒剂量越大的组,各个组织器官检测率更高。此结果相一致,说明在一定范围内,攻毒剂量的高低同发病严重程度呈正相关。(3)攻毒组3组(1.6× 106TCID50)试验鸭,临床出现腿瘫、排白绿色粪便、行走不稳等症状;剖检各主要脏器可见眼观病变,尤以脾脏明显;套式RT-PCR检测是阳性,第8天脾脏检测率最高;组织病理学发现脾脏、肝脏、脑等脏器病变严重;免疫组织化学分析,脾脏、脑组织阳性细胞居多。所以,临床、剖检、套式RT-PCR、病理组织学、免疫组织化学均表明:本试验已成功建立了鸭坦布苏病毒发病模型,即34日龄樱桃谷肉鸭的攻毒量是1.6×106TCID50,攻毒后8d发病最严重,脾脏检测率最高。
鸭坦布苏病毒病发病模型的成功建立,为今后坦布苏病毒病疫苗的研制和免疫效果的判定奠定了基础。
参考文献
[1] Tao Yun, Weicheng Ye, Zheng Ni. Identification and molecular characterization of a novel flavivirus isolated from Pekin ducklings in China[J].Veterinary Microbiology, 2012,157(3) :311-319.
[2] 李玉峰, 马秀丽, 于可响等. 一种从鸭新分离的黄病毒研究初报[J]. 畜牧兽医学报, 2011, 42(6): 885-891.
[3] 黄欣梅, 李银, 赵冬敏等. 新型鹅黄病毒JS804毒株的分离与鉴定[J]. 江苏农业学报, 2011, 27(2): 354-360.
[4] Su J L, Li S, Hu X D, et al. Duck egg-drop syndrome caused by BYD virus, a new Tembusu-related Flavivirus[J]. PLoS One. 2011, 6(3):e18106.
[5] 腾巧泱, 颜丕熙, 张旭等. 一种新的黄病毒导致蛋鸭产蛋下降及死亡[J]. 中国动物传染病学报, 2010, 18(6): 1-4.
[6] Yan P, Zhao Y, Zhang X, et al. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China[J]. Virology,2011, 417(1): 1-8.
[7] 陈钦材, 杨光华. 病理学进展(第2版)[M]. 北京: 人民卫生出版社,1986,16-30.
[8] 殷震, 刘景华. 动物病毒学(第2版)[M]. 北京: 科学出版社, 1997: 331-335.
[9] 黄欣梅, 赵冬敏, 刘宇卓等. 禽黄病毒套式RT-PCR检测方法的建立及应用[J]. 畜牧与兽医, 2012, 44(6): 1-4.
[10] 王伯云, 李玉松, 黄高等. 病理学技术[M]. 北京: 人民卫生出版社, 2000: 83~84.
[11] 刘增辉. 病理染色技术[M]. 北京: 人民卫生出版社, 2000: 158~160.
[12] 刘彦仿. 免疫组织化学[M]. 北京: 人民卫生出版社, 1990: 58~69.
[13] 陈文钦, 刘华珍, 罗冠中等. 神经肽Y免疫反应神经元在鸽小脑中的定位—SABC法研究[J], 中国兽医学报. 2006, 26(02): 180-182.
[14] 张大丙. 鸭出血性卵巢炎的研究进展[J]. 中国家禽, 2011, 33(14): 37-38.
[15] 万春和, 施少华, 程龙飞等. 一种引起种(蛋)鸭产蛋骤降新病毒的分离与初步鉴定[J]. 福建农业学报, 2010, 25(6): 663-666.
[16] 曹贞贞, 张存, 黄瑜等. 鸭出血性卵巢炎的初步研究[J]. 中国兽医杂志, 2010, 46(12): 3-6.
中图分类号:S858.293
文献标识码:A
文章编号:1007-1733(2015)02-0005-03
收稿日期:(2014-11-20)
