三个品系小鼠白消安无精子症模型的比较
2015-08-10暴国王尚明张长勇魏刚陈西华王丽丽张斌许芮豪王宁石翠格徐祥波贺斌王介东张树成
暴国,王尚明,张长勇,魏刚,陈西华,王丽丽,张斌,许芮豪,王宁,石翠格,徐祥波,贺斌,王介东,张树成
(国家卫生计生委科学技术研究所,北京 100081)
目前已经建立的生精障碍动物模型各具特点,常以外源性因素对动物机体造成损伤而获得生精障碍,但机体的其他组织和器官也同样会发生异常。外源性因素包括物理(如温水浴、红外线、激光、微波和超声波等热效应,冷效应,电离辐射的多种射线等)、化学(如化疗药物环磷酰胺、白消安,肾损害药物腺嘌呤,直接破坏生精功能的药物棉酚、雷公藤)和病理(通过实验对动物造成免疫性生精功能损害,如实验性抗精子抗体、实验性睾丸炎、实验性隐睾、实验性精索静脉曲张)以及基因缺陷/转基因动物的动物模型。造模成功的动物成为少精子症、无精子症、弱精子症模型动物[1]。白消安清除内源性生精细胞诱导无精子症模型是生精障碍造模方法中常用的经典方法之一。
白消安是氮芥类烷化剂。在体内主要作用于G1期和G0期的细胞,是细胞周期非特异性药物,通过与细胞DNA 中鸟嘌呤发生烷化作用而破坏DNA 的结构与功能[2-3],严重干扰DNA 的合成,具有特异性地损伤干细胞的作用。
不同白消安剂量造成生精上皮不同程度的损害,小鼠无精子症造模文献报告所建议的使用剂量是采用腹腔单次注射白消安40 mg/kg 以上[4-5]。本实验室在工作中发现白消安剂量对不同品系动物造模效果存有差异,造模中动物的死亡率与白消安剂量直接相关,而过高的动物死亡率直接增加实验成本。本文报告3个品系小鼠(NIH、ICR、Balb/c)不同剂量白消安的造模效果,比较优化最佳实验临界剂量,以期减少动物的死亡率、提高造模成功的实验效率。
材料与方法
一、实验动物及造模方法
SPF级成年雄性小鼠在屏障环境中饲养,光周期调控为06:00~18:00光照,18:00~06:00黑暗;温度控制21±2℃,湿度控制50%~60%,自由进食和摄水。
分别使用ICR、NIH、Balb/c雄性小鼠(来源于中国生物制品检定所实验动物中心、中国医学科学院实验动物中心、北京维通利华实验动物技术有限公司和中国军事医学科学院实验动物中心)4批次实验共1 096只。动物购入后饲养检疫2周以上备用。所有动物随机分组,腹腔单次注射白消安(mg/kg)45、40、35 和30 剂量,40d后存活小鼠为模型动物,造模后连续分别观察2生精周期(小鼠生精周期为35~40d)共70d;以正常动物(无处理)为对照。
二、主要试剂
白消安(Sigam,美国,批号STBB7150V)溶解于 二 甲 基 亚 砜(DMSO;Amresco,美 国,批 号0939B379)中,于37℃水浴中保持恒温配制成2%药液[4];DMEM/F12培养液(Wisent,加拿大,批号319080002)。
三、研究方法
1.实验方法:分4批次进行实验。每周称量一次动物体重,比较动物体重。造模后每天观察记录动物生长和死亡情况。模型动物(给予白消安后40d的存活动物)分别于0.5周和5周、7.5周(分别为造模后和恢复1、1.5个生精周期)各取材3~5只动物,于10周(2个生精周期)观察结束时取材全部动物。采用颈椎脱臼法处死后取材,进行附睾精子检测和睾丸组织形态观察。
2.附睾精子质量检测:采用附睾精子泳动试验进行精子质量的检测。每次实验前1天,对使用的培养液进行毒性检验(精子于该培养液中孵育1~2h观察精子活动性)。将附睾于含2 ml培养液的35mm 培养皿中剪碎,36.5℃孵育30min使精子充分游离泳动,取精子游离悬液滴于载玻璃片上,镜检。观察200个精子分析精子活动性指标;使用血球计数板进行精子计数,分析精子数目指标。
3.睾丸组织形态学观察:睾丸以多聚甲醛固定,常规石蜡包埋,5μm 切片,苏木精-伊红(HE)染色,封片,镜检观察。
4.造模和生精能力恢复效果的评价:本实验采用经典的白消安生精障碍模型,以附睾精子质量检测和睾丸组织形态进行评价,附睾中不能检出精子或只能偶尔检出不完整死精子和睾丸组织生精上皮损伤严重丧失生精能力为造模成功。
四、统计学处理
实验数据以Excel保存,使用SPSS12.0 统计软件进行统计分析,采用卡方检验、回归分析和方差分析;P<0.05为差异有统计学意义。
结 果
一、动物外观体征表现
总体表现:造模后动物整体表现为明显虚弱,体重开始减轻或不增加,明显怕冷基本上迭拥挤靠在一起,脱毛明显,出现乏力蜷卧、食量减少、活动明显减少萎靡、反应迟钝、耳廓苍白、眯眼、眼睑周围浮肿、皮毛卷曲、竖毛皱绺、皮毛无光泽、多尿等症状。这些症状在3 个品系动物中表现一致,至造模后90d左右,以上症状开始好转,但至实验全程仍无法达到正常动物的外观体征表现(图1、图2)。
3个品系小鼠表现的比较:造模后NIH 与ICR、Balb/c小鼠的外观体征表现明显不同。造模产生的不良体征表现,在NIH 小鼠表现更为明显,攻击性明显增加,撕咬争斗加剧并连续,使皮毛产生的明显外伤不易恢复;皮肤干燥且脆弱、口腔粘膜干燥和唇裂、皮肤溃烂、多形性红斑和结节性红斑等典型的骨髓再生障碍表现;而ICR 和Balb/c小鼠上述表现轻微。提示白消安对NIH 小鼠产生的损伤更明显、更剧烈,受到的损伤恢复最慢。
二、造模动物死亡率
造模后第2天开始出现动物死亡,集中出现于2~3周,30d后减少,40d后基本无死亡(表1)。
3个品系小鼠的死亡率与白消安的剂量呈正相关。在NIH 小鼠,造模后死亡率呈显著剂量效应关系(P<0.01),45mg/kg剂量组死亡率为69.2%,使造模成功动物明显减少,造模效率低(图3)。NIH 和ICR 小鼠35mg/kg剂量组的存活率分别为71.3%(194/272)和94.4% (51/54),显 著 高 于40mg/kg剂量组(P<0.01);Balb/c小鼠35mg/kg剂量组存活率为90.9%,同期正常对照组动物存活率96.91%。
三、造模效果的比较分析
1.附睾精子检查:对造模动物于自然恢复不同时间进行附睾精子检查显示,30mg/kg白消安剂量组于0.5 周可见活精子,5 周可见大量活精子;35mg/kg白消 安 以 上3 个 剂 量 组 于0.5 周、5 周、7.5周附睾精子均为0(0.5周可偶见残余不完整死精子)。
自然恢复10周(2个生精周期)检查,结果显示自然恢复能力NIH 小鼠显著高于ICR、Balb/c小鼠(P<0.01),Balb/c小鼠自然恢复能力最低仅可偶见不完整精子;自然恢复10周后,NIH 和ICR 模型小鼠均显示白消安高剂量组(40或45mg/kg)精子质量高于低剂量组(35mg/kg)的趋势(表2)。

图1 造模后40dNIH 小鼠外观体征
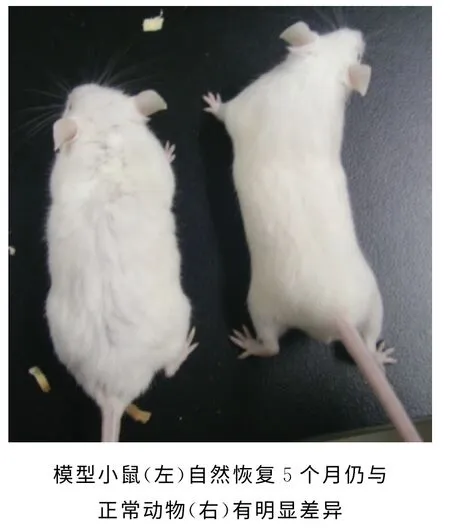
图2 造模后149dNIH 小鼠外观体征

表1 造模动物死亡率
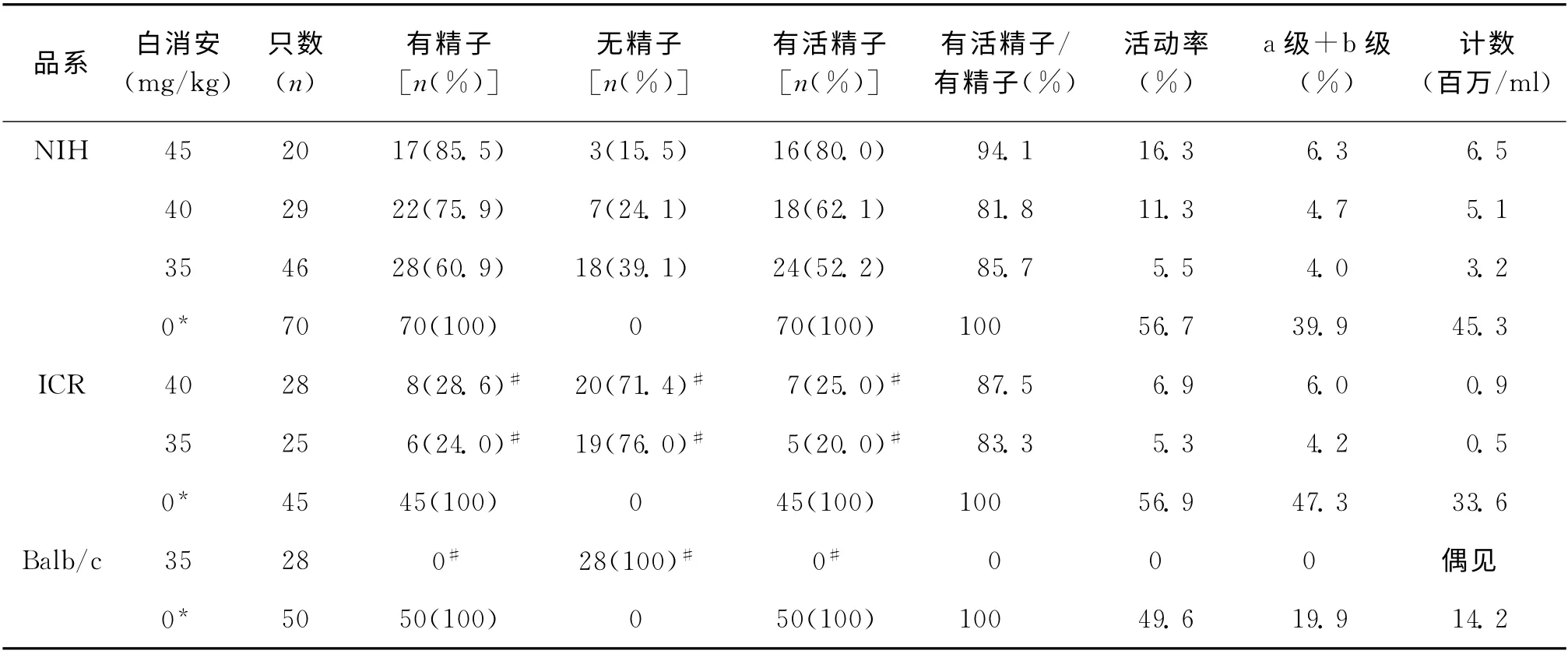
表2 造模动物自然恢复10周的附睾精子检测结果
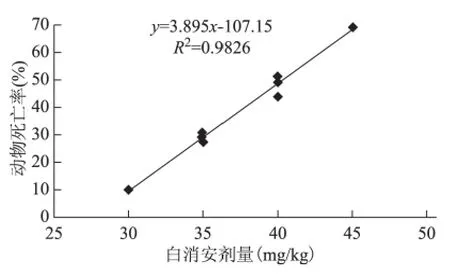
图3 NIH 小鼠白消安不同剂量下的死亡率
2.睾丸组织形态学观察:造模动物自然恢复不同时间的睾丸组织形态学观察显示,30mg/kg白消安剂量组于0.5周睾丸生精小管内可见2~4层生精上皮,存在各级完整的生精细胞,显示生精能力未受到完全损伤。35mg/kg白消安以上3个剂量组0.5周、5周生精上皮处于完全损伤状态,仅残余单层生精上皮细胞,生精细胞数量明显减少,基底膜侧仅见少量精原细胞残留,大部分细胞空泡化,变性细胞充斥管腔;7.5周可见生精上皮有散在的生精细胞,未见精子;10周可见生精上皮部分功能恢复,见有完整生精细胞、精子细胞和精子;提示1.5个生精周期前处于无精子症状态,至2个生精周期生精能力轻度恢复。
3.造模效果和生精能力恢复的比较:通过附睾精子检测和睾丸组织形态学观察,表明30 mg/kg白消安在NIH 小鼠造模失败;3 个品系小鼠在35mg/kg白消安以上3个剂量组造模成功,获得无精子症模型动物。使用临界剂量35mg/kg可以取得较好造模效果,提示可以不采用通常建议的40mg/kg~45mg/kg剂量。白消安无精子症小鼠模型在2个生精周期内维持基本稳定,处于无精子症或低生精能力状态,适合进行相关研究工作,造模后的模型动物用于设计评价性试验时可以进行70d(2个生精周期)的干预处理。
四、35mg/kg白消安无精子症模型小鼠的生长表现和睾丸组织形态学鉴定分析
1.体重变化:3 个品系小鼠注射白消安后第2天动物体重即开始下降,造模后2周达到最低,以后逐渐缓慢增加,但始终低于正常动物,仅与造模前接近,说明造模后动物体重停止明显生长。NIH 小鼠体重下降最明显,下降22.15%(37.97g至29.56g);ICR 小鼠下降8.14%(39.21g至36.02g),Balb/c小鼠下降10.82%(23.67g至21.11g)(图4)。
2.睾丸组织形态学分析:(1)造模后:对35mg/kg白消安造模40d后的睾丸组织形态进行观察,显示3 个品系小鼠的整体表现一致(图5)。整个睾丸组织严重萎缩,极度退化变性,精曲小管萎缩变细疏松,管腔内各级生精细胞呈明显的空泡化,基底膜侧精原细胞偶见,精曲小管内未见精子;间质组织发生退化,细胞形态不完整,排列紊乱,总体表现完全丧失生精生成能力(图6)。(2)自然恢复2个生精周期:可见部分(约5%~15%)的精曲小管恢复生精上皮细胞,基底膜侧可见散在精原细胞,整体表现仍为精子生成能力低下(图7)。组织形态学表现与附睾精子质量检测结果一致,造模后动物丧失精子发生能力,恢复2个生精周期后,部分精曲小管中可有部分生精上皮细胞恢复,恢复程度不一致,整体恢复表现为处于较低下程度。
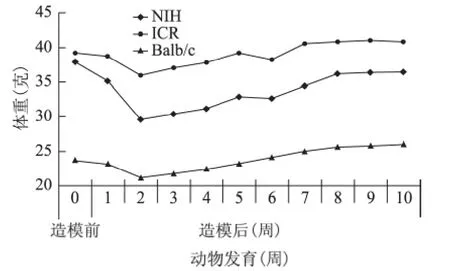
图4 造模后动物生长中的体重变化
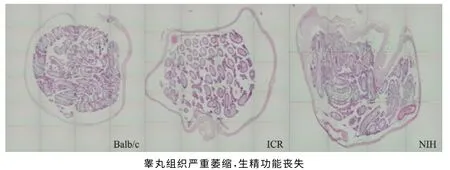
图5 造模40d 各品系小鼠睾丸组织横切面(×20)
讨 论
白消安(Busulfan,又名马利兰-Myleran,化学名1,4—丁二醇二甲磺酸酯)临床上最初在1952年用于治疗慢性粒细胞性白血病[6],用于造血干细胞移植前清除体内异常和肿瘤细胞、抑制/破坏受体免疫系统做好移植前的准备工作[7-8]。具有特异性地损伤干细胞的作用。使用的剂量为半数致死量,在损伤生精干细胞的同时,也对其他组织干细胞产生损伤,产生较严重的骨髓抑制[4]。在注射后小鼠体重减轻,第二天开始出现死亡,一般3 周后不再死亡,存活小鼠体重明显降低15%~25%,造模成功的存活小鼠在4周后血象开始恢复正常,而睾丸明显萎缩,生精上皮产生直接损害,生精小管失去正常的生精上皮结构[9];小鼠的无精子症表现是可逆的。
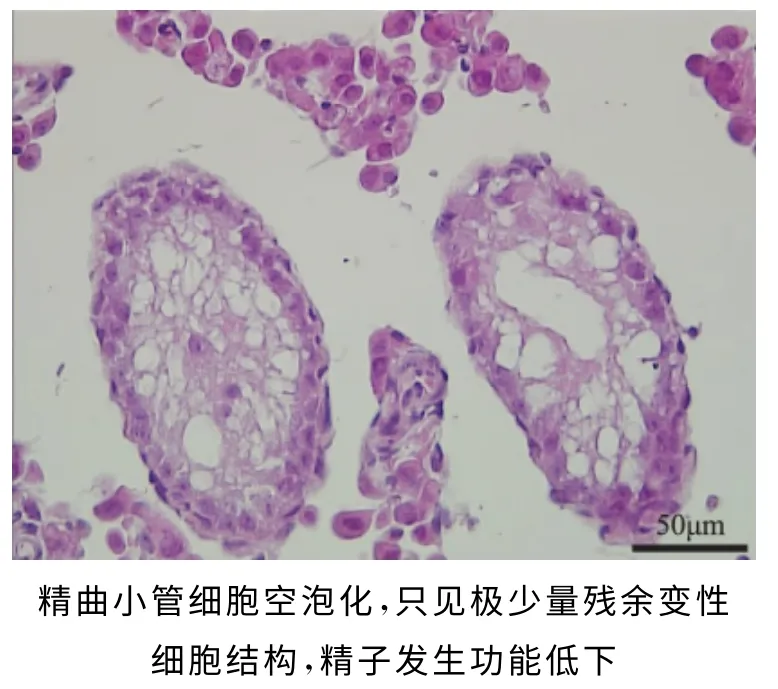
图6 造模40d睾丸组织形态表现(×40)
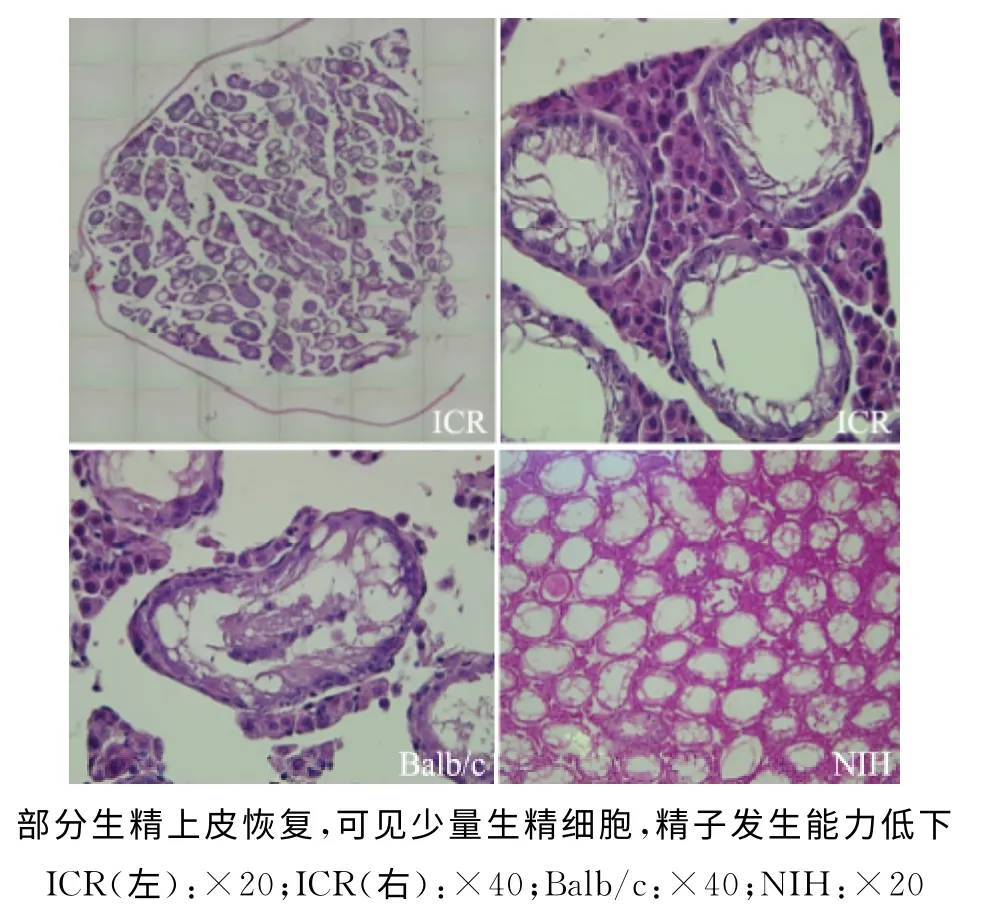
图7 造模后恢复2个生精周期的睾丸组织形态表现
白消安对睾丸生精能力产生直接损伤,主要通过氧化损伤抑制阻断正常的精子发生,在特异性清除内源性生精干细胞的同时,对间质细胞无明显毒性作用,睾丸生精小管呈唯支持细胞样表现,3个月后可有20%的生精小管恢复生精[9],这与本实验观察结果不一致,本文结果发现白消安对睾丸间质细胞有一定的影响,间质组织发生退化,细胞形态不完整,推测原因可能是由于生精上皮的损伤严重,诱导了间质细胞的变性退化,有待进一步的实验验证;对睾丸支持细胞(Sertoli cell)之间的细胞连接也产生明显损伤[10-12]。由于对DNA 合成的损害,所以体内多种细胞的分裂生长均受到干扰,特别是处于快速分裂状态的各级生精上皮细胞,均同时受到杀伤,使睾丸精子发生“即刻”发生阻滞。那么,“即刻”死亡的生精细胞和已有的精子,需要多长时间被清除出体内,是解释利用白消安模型的重要问题。研究显示,白消安注射后4周,绝大部分各级生精细胞可以排出睾丸丧失生育能力,而前3周仍具有生育能力[10]。本实验通过3品系小鼠的35mg/kg白消安研究结果证实造模40d后,通过组织形态学评价睾丸内生精上皮细胞基本清除“干净”,附睾精子泳动试验证实附睾中无残余精子,可利用造模成功的无精子症模型动物(造模40d后存活动物)进行药效学研究。
白消安常用剂量在不同种属的单位使用剂量差别很大,大鼠10mg/kg和15mg/kg[13-14],猪40mg/kg~100 mg/kg[15],狼只需4 mg/kg~12 mg/kg[16]。小鼠是使用最多的实验动物之一,以往主张的剂量多在40mg/kg~45mg/kg[4-5,9,17-20]。
由于白消安对机体细胞同时具有全身性的伤害,选择最低有效剂量十分重要。有研究证实,在Balb/c小鼠,白消安在20 mg/kg以下不会导致动物死亡,在30mg/kg、40mg/kg、50mg/kg的死亡率分别为6.5%、86.7%、100%[21]。本实验观察显示,35mg/kg白消安造模后NIH 与ICR、Balb/c动物的体重变化明显不同,白消安致NIH 小鼠体重降低程度最高,下降22.15%(37.97g至29.56g),体重恢复最慢;而ICR 和Balb/c小鼠表现基本接近,ICR 小鼠下降8.14%(39.21g至36.02g),Balb/c小鼠下降10.82%(23.67g 至21.11g)。NIH 和ICR 小鼠均显示出模型小鼠在自然恢复10周后,高剂量组(40或45mg/kg)精子质量有高于低剂量组(35mg/kg)的趋势,提示白消安造模高剂量下死亡率高而存活动物可能生存质量更高,生精恢复能力更强。
本实验结果提示,在白消安35 mg/kg剂量下三个品系小鼠均可成功获得无精子症模型,动物死亡率在ICR 小 鼠 为5.6%、Balb/c 小 鼠 为9.1%、NIH 小 鼠 为30% 左 右(3 批 次 分 别 为31.2%、27.2%、29.6%),三品系小鼠在造模后动物外观体征、死亡率(存活率)、体重方面具有明显差异,白消安对NIH 小鼠产生的损伤更明显,受到的损伤恢复最慢,ICR 和Balb/c小鼠表现基本接近。造模对动物的损伤(外观体征、死亡率、体重)表现与精子质量的恢复无明显相关性(NIH 受到损害程度最高,但精液质量的恢复以NIH 小鼠最高);精液质量的恢复与小鼠品系无直接关系。
本实验结果证实:临界剂量为35 mg/kg的白消安均可以对ICR、NIH、Balb/c三个品系雄性小鼠成功建立无精子症模型,并较40mg/kg和45mg/kg白消安明显降低动物死亡率,造模成功动物成活率明显提高,提示可以不采用通常建议的40~45mg/kg剂量。白消安无精子症小鼠模型在2 个生精周期(70d)内维持基本稳定,睾丸精子生成能力的恢复和附睾精子质量均维持无精子症或低生精能力状态。
[1] 张树成,贺斌,王尚明,等.少精子症和无精子症动物模型及其在中药研究中的应用[J].四川中医,2009,27:40-43.
[2] Morley A,Blake J.An animal model of chronic aplastic marrow failure.I.Late marrow failure after busulfan[J].Blood,1974,44:49-56.
[3] Meistrich ML.Male gonadal toxicity[J].Pediatr Blood Cancer,2009,53:261-266.
[4] Bucci LR,Meistrich ML.Effects of busulfan on murine spermatogenesis:cytotoxicity,sterility,sperm abnormalities,and dominant lethal mutations[J].Mutation Res,1987,176:259-268.
[5] 张树成,贺斌,刘永军,等.三种生精障碍动物模型组织形态学表现的比较分析[J].生殖医学杂志,2009,18:559-561.
[6] Haut A,Abbott WS,Wintrobe MM,et al.Busulfan in the treatment of chronic myelocytic leukemia.The effect of long term intermittent therapy[J].Blood,1961,17:l-19.
[7] Clift RA,Radich J,APPelbaurn FR,et al.Long-term followup of a randomized study comparing cyclophosphamide and total body irradiation with busulfan and cyclophosphamide for patients receiving allogenic marrow transplants during chronic phase of chronic myeloid leukemia [J].Blood,1999,94:3960-3962.
[8] 张善堂,孙自敏.白消安在造血干细胞移植中的应用及其治疗药物监测研究进展[J].中国医院药学杂志,2009,29:228-232.
[9] 张茨,王玲珑,金化民,等.白消安诱导小鼠无精子症模型[J].医学新知杂志,2003,13:201-202.
[10] Zohnic K,Zhang X,Tam SL,et al.The efficiency of male fertility restoration is depedent on the recovery kinetics of spermatogonial stem cells after cytotoxic treatment with busulfan in mice[J].Hum Reprod,2012,27:44-53.
[11] Anjamrooz SH,Movahedin M,Mowla SJ,et al.Assessment of morphological and functional changes in the mouse testis and epididymal sperms following busulfan treatment[J].Iran Biomed J,2007,11:15-22.
[12] Dehghani F,Hassanpour A,Poost-pasand A,et al.Protective effects of L-carnitine and homogenized testis tissue on the testis and sperm parameters of busulfan-induced infertile male rats[J].Iran J Reprod Med,2013,11:693-704.
[13] Ogawa T,Dobrinski I,Brinster RL.Recipient preparation is critical for spermatogonial transplantation in the rat[J].Tissue Cell Res,1999,31:461-472.
[14] Jiang FX.Behaviour of spermatogonia following recovery from busulfan treatment in the rat[J].Anat Embryol(Berl),1998,198:53-61.
[15] Kim JH,Jung-Ha HS,Lee HT,et al.Development of a positive method for male Stem cell-mediated gene transfer in mouse and pig[J].Mol Reprod Dev,1997,46:515-526.
[16] Stellflug J,Green JS,Leathers CW.Antifertility effect of busulfan and procarbazine in male and female coyotes[J].Biol Reprod,1985,33:11237-11243.
[17] Brinster RL,Zimmermann J W.Spermatogenesis following male germ-cell transplantation[J].Proc Natl Acad Sci USA,1994,91:11298-11302.
[18] Brinster RL,Avarbock MR.Germline transmission of donor haplotype following spermatogonial transplantation[J].Proe Natl Acad Sci USA,1994,91:11303-11307.
[19] Dobrinski I,Avarbock MR,Brinster RL.Transplantation of germ cells from rabbits and dogs into mouse testes[J].Biol Reprod,1999,61:1331-1339.
[20] Shinohara T,Orwig KE,Avarbock MR,et al.Germ line stem cell competition in postnatal mouse testes[J].Biol Reprod,2002,66:1491-1497.
[21] 王德志.白消安对雄性小鼠生精、性行为和不育影响的研究[D].武汉:武汉大学,2010.
