动物胰岛素与人胰岛素在中国糖尿病患者中的安全性和有效性对比:Meta分析
2015-08-10赵家军张贺娜王柯杨军
赵家军 张贺娜 王柯 杨军
1山东大学附属省立医院内分泌科;2礼来苏州制药有限公司上海分公司
1 前言
糖尿病在全球范围内给人类健康和社会经济发展带来严重的危害。在我国,糖尿病也是一个日益严峻的公共卫生问题[1-4]。近年来随着生活方式和饮食习惯的改变以及人口的老龄化,中国人群中糖尿病的患病率急速升高[1-3,5]。据估计,中国成年人中糖尿病的患病率已经由1980年的0.67%[5]增至2008年的9.7%[1]。
胰岛素治疗对于糖尿病及其并发症的照护非常重要。糖尿病的发病机理是由于胰岛β细胞胰岛素分泌缺陷(1型糖尿病)和/或机体对胰岛素不敏感(2型糖尿病),从而导致碳水化合物、脂肪和蛋白质代谢的缺陷[6]。长期患糖尿病将导致视网膜、周围神经和肾脏等组织和器官的病变,以及增加心血管系统病变的风险[6]。1型糖尿病患者必须进行胰岛素注射治疗,而2型糖尿病患者随着其胰岛β细胞功能的不断恶化,仅通过改变生活方式和口服降糖药常无法有效控制血糖,大约50%的患者在启用口服降糖药6年后即需胰岛素注射治疗[7]。因此,胰岛素治疗对于控制血糖和防治糖尿病长期并发症尤为重要。针对胰岛素的长期临床应用已经充分证明了使用胰岛素控制血糖的安全性和有效性。由牛、猪和羊的胰腺组织提纯的动物胰岛素曾经被广泛用于临床治疗糖尿病。当前,动物胰岛素在一些地区仍有应用。重组人胰岛素自上个世纪八十年代开始被用于治疗糖尿病[8]。与动物胰岛素相比,重组人胰岛素的免疫原性较低,诱导产生的胰岛素抗体较少[9]。但是,重组人胰岛素对于控制高血糖症的安全性和有效性是否优于动物胰岛素仍有争议[10,11]。
现有的系统评价和M eta分析[12,13]显示,在白种人糖尿病患者中,人胰岛素和动物胰岛素有相似的安全性和有效性。在白种人糖尿病患者中,与牛或猪胰岛素相比,人胰岛素对于降低血浆糖化血红蛋白(hemoglobin A 1c,HbA1c)的效果更好一些,但是其差异未达到统计学的有效意义[12]。动物胰岛素和人胰岛素在空腹血糖浓度和注射部位不良反应的发生率方面无差异[12,13],在低血糖的发生率方面无差异,在血糖达到满意控制时的每日剂量无差异[12]。但研究显示,当患者由动物胰岛素转换为人胰岛素治疗后, 其血浆胰岛素抗体浓度有轻度降低[12]。然而,在中国糖尿病患者中尚缺乏类似的系统评价和M eta分析。
在全球范围内,动物胰岛素正逐渐被重组人胰岛素所代替,但是在中国,动物胰岛素仍然被广泛使用[14]。过去,有一系列的研究[15-37]比较了动物胰岛素和人胰岛素在中国糖尿病患者中的安全性和有效性。但这些研究的样本多数都较小,因此缺乏足够的统计学效力。基于上述原因,我们对文献进行了系统的检索并对有关研究进行Meta分析。本Meta分析比较了动物胰岛素和人胰岛素在中国糖尿病患者中的安全性和有效性。
2 资料与方法
2.1 检索策略
以人胰岛素(或优泌林、诺和灵、甘舒霖)和动物胰岛素(或猪胰岛素、牛胰岛素、羊胰岛素)为主题词检索中国期刊全文数据库(1994~2013.11)、V IP维普数据库(1989~2013.11)、中国生物医学文献数据库(1 9 7 8 ~2 0 1 3.11)、万方数据库(1997~2013.11);以hum an insu lin(或Humu lin、 Novolin、Gansulin)、animal insulin(或porcine insulin、 pork insulin、beef insulin、sheep insulin)和China(或Chinese、Taiw an、Taiw anese、Hong Kong)检索MEDLINE(1966~2013.11)。
2.2 纳入和排除标准
同时符合以下条件的文献被纳入:①研究为随机对照试验(random izedcontrolledtrial,RCT)、非随机对照试验(non-random izedcontrolledtrial,NRCT)和由动物胰岛素治疗转换为人胰岛素治疗的转换试验(sw itch studies,SW)。②对动物胰岛素和人胰岛素在中国糖尿病患者中的使用进行平行比较或前后比较。③至少报告接受动物胰岛素或人胰岛素治疗后一项临床结局指标:空腹血糖浓度(fasting blood glucose,FBG),餐后2h血糖浓度((2h-postprandial plasma glucose,2h-PBG),达到满意控制血糖时的每日胰岛素用量和HbA1c水平,不良反应如低血糖症、过敏反应和注射部位局部反应的发生率。
排除标准:①重复研究;②动物试验;③非最终试验报告;④会议论文或摘要。
2.3 文献筛选和数据提取
由一位研究者检索文献、阅读标题和摘要并按照纳入和排除标准对文献进行筛选,对无法确定的文献进行全文阅读并与另一位研究者讨论决定是否纳入。对有关系统评价的参考文献部分进行手工检索以发现符合纳入标准的研究。纳入研究中的数据由一位研究者提取并经另一位研究者确认,提取的数据主要包括:①一般资料:题目、作者、发表日期和文献来源。②研究特征:包括随机方法、对照、治疗时间和样本大小。③治疗前后的临床结局指标:FBG、2h-PBG、达到满意控制血糖时的每日胰岛素用量和HbA1c。④接受胰岛素治疗前后的不良反应发生率:低血糖症、过敏反应和注射部位局部反应。当RCT 和NRCT中部分患者由动物胰岛素转为人胰岛素治疗且具有其基线数据时,则该部分患者也将并入SW进行分析。
基于不同剂型或不同方案胰岛素的选择对胰岛素疗效和安全性的可能影响[38],我们对纳入研究中明确表明对使用相同剂型的动物或人胰岛素的试验数据进行了亚组分析。
2.4 数据质量评估
使用Jadad[39]评分标准对纳入的研究的质量(包括随机序列的产生方法、随机化隐藏、盲法和试验退出或撤出)进行评估。
2.5 统计分析
采用统计计算R项目(http://www.r-project.org)提供的R软件(2.15.1版本)进行M eta分析。对于某一临床结局指标,如有3篇或3篇以上文献进行了报告则进行M eta分析。计量数据采用均数差(MD),计数数据采用相对危险度(RR),各效应量以95%置信区间(95%CI)表示。各研究的异质性采用Cochran Q检验。当各研究有统计学同质性时,采用固定效应模型进行合并分析。当各研究有明显统计学异质性时(P<0.05),采用随机效应模型进行合并分析。对于采用相对危险度报告的临床结局指标,在固定效应模型下采用Mantel-Haenzsel Chi2检验进行比较;或在随机效应模型下采用Dersimonian-Laird检验进行比较。动物胰岛素组与人胰岛素组间采用双侧t分布检验进行比较,P<0.05为存在明显统计学差异。若研究中仅报告了患者的个体数据时,则由本文作者汇总计算出各组的平均值后合并其他研究进行Meta分析。
3 结果
3.1 文献检索结果
检索中国期刊全文数据库、VIP维普数据库、中国生物医学文献数据库、万方数据库和MEDLINE总计获得597篇相关文献(图1)。根据纳入标准,阅读标题和摘要排除非比较性研究和未报告相关临床结局指标的研究总计521篇。对余下76篇文献进行全文阅读,排除个案报告、综述和无关研究,最终纳入23个研究。其中 6个为NRCT[15-20]、7个为RCT[21-27]、10个为SW研究[28-37](表1)。纳入的研究报告了至少一项临床结局指标,多数研究没有描述随机分配方法和盲法。大多数的RCT和NRCT的样本小于100,大多数SW研究的样本小于50。约30%的研究的疗程为3个月,约有50%的研究没有描述疗程长短(表1)。使用JADAD评分标准对研究进行质量评价显示多数研究为低质量(结果未示出)。
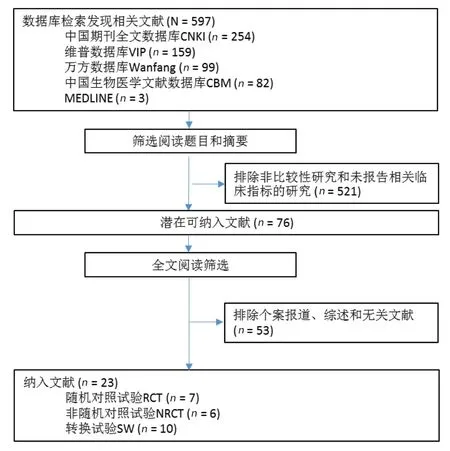
图1 文献检索和筛选流程及结果
3.2 结局指标
3.2.1 总体分析结果
⑴每日胰岛素用量:有7 个R C T[21-27],4 个NRCT[15,16,18,20],及10个SW[28-37]报告了达到血糖满意控制时的胰岛素用量。NRCT中有2个研究[17,19]未报告这一指标,因此未被纳入Meta分析。对上述各组研究数据Meta分析显示,使用胰岛素治疗高血糖症,当血糖达到满意控制时,所需人胰岛素用量明显低于动物胰岛素(图2)。
⑵低血糖反应发生率:有3个RCT[22-24],4个NRCT[15,16,19,20],及3个SW[30,31,34]报告了胰岛素治疗期间患者低血糖反应的人数[22-24]或次数[15,16,19,20,30,31,34]。Meta分析上述各组数据显示,接受人胰岛素治疗的患者在治疗期间发生低血糖症的风险明显低于接受动物胰岛素治疗的患者(图3)。RCT 中有4个研究[22,24-26],NRCT中有2个研究[17,18],SW中有7个研究[28,29,32,33,35-37]未报告这一指标, 因此未被纳入Meta分析。

表1 纳入研究的特征
⑶HbA1c:有5个SW[30,32,34,35,37]研究报告了胰岛素治疗达到血糖满意控制后,患者HbA1c变化情况。M eta分析上述SW研究中患者HbA1c变化情况显示,患者由动物胰岛素治疗转为人胰岛素治疗后,其HbA1c明显下降(图4)。同时,患者的每日胰岛素用量也明显下降(图1)。其他5个SW研究未报告HbA1c变化[28,29,31,33,36]。RCT和NRCT中报告了HbA1c变化的研究不足3个,未进行Meta分析。

图2 中国糖尿病患者达到血糖理想控制时每日人胰岛素或动物胰岛素用量比较的Meta分析
⑷注射部位红肿硬结:有3个RCT[21,23,27]研究报告了患者接受人胰岛素或动物胰岛素治疗后,注射部位红肿硬结发生率。Meta分析上述RCT显示,与接受动物胰岛素治疗的患者相比,接受人胰岛素治疗的患者发生注射部位局部反应的风险明显较低(图5)。其他RCT研究未报告注射部位局部反应发生情况[22,24-26]。NRCT和SW中报告了注射部位局部反应发生率的研究不足3个,未进行Meta分析。
⑸过敏反应:有3个RCT[21,22,27]研究报告了患者接受人胰岛素或动物胰岛素治疗后过敏反应的发生率。Meta分析上述RCT研究显示,与接受动物胰岛素治疗的患者相比,接受人胰岛素治疗的患者发生过敏反应的风险无明显差异[RR=0.19, 95%CI(0.03, 1.09)]。其他RCT、NRCT和SW研究未报告过敏反应发生情况。
3.2.2 亚组分析结果
Giugliano等[38]于2011年发表的一篇Meta分析报告了不同剂型的胰岛素(基础胰岛素、餐时胰岛素和双相胰岛素)在7759名2型糖尿病患者中的有效性和不良反应发生率存在差异。与餐时胰岛素和双相胰岛素比较,基础胰岛素治疗的患者达到HbA1c<7%的比例较低,发生低血糖症的风险也较低。我们对纳入文献中明确表明了胰岛素剂型(例如短效或中效人或动物胰岛素)的研究进行了亚组分析以比较相同剂型的人胰岛素和动物胰岛素的安全性和有效性。
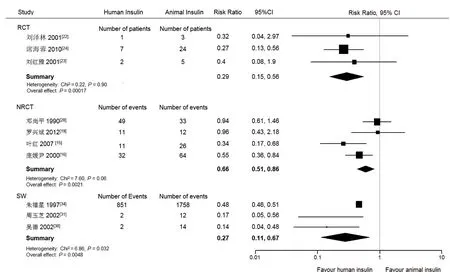
图3 中国人糖尿病患者使用人胰岛素或动物胰岛素治疗发生低血糖反应的发生率的比较的Meta分析
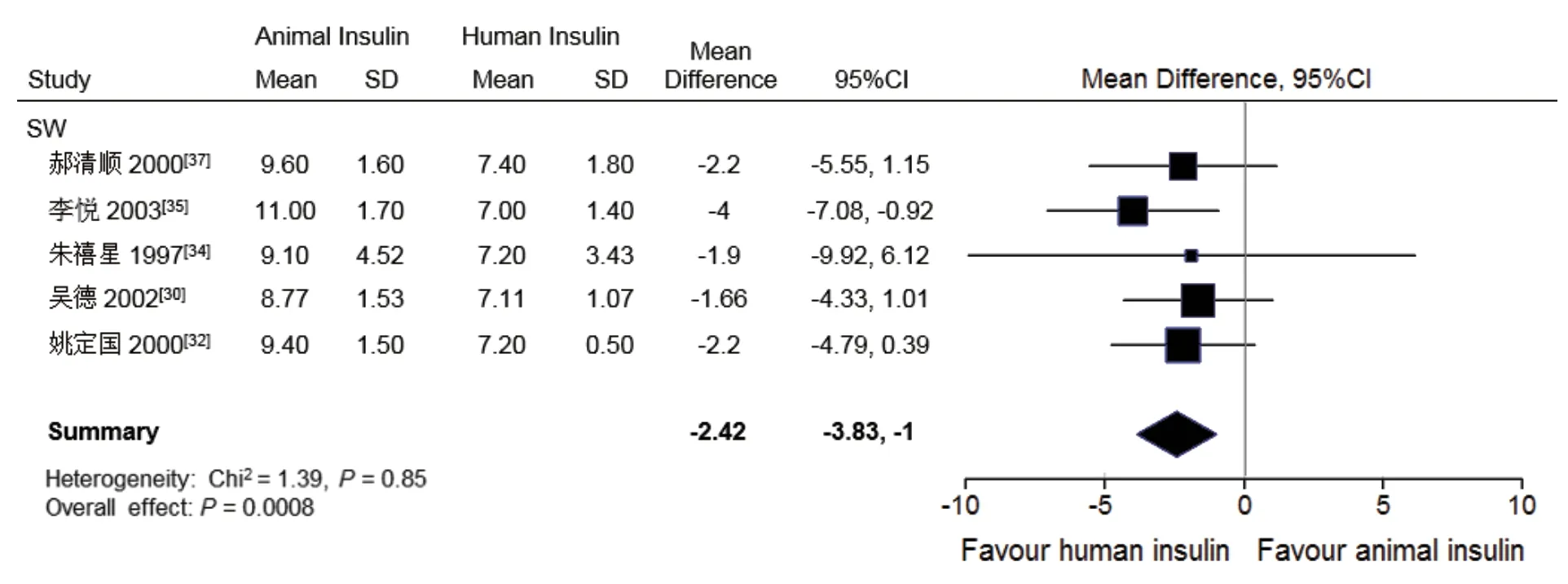
图4 中国糖尿病患者由动物胰岛素转换为人胰岛素治疗前后糖化血红蛋白百分比的比较的Meta分析
⑴空腹血糖浓度(FBG):有4个RCT[21,25-27]研究报告了患者接受短效或中效人胰岛素或动物胰岛素治疗后FBG浓度。Meta分析上述研究数据显示,患者接受人胰岛素与接受动物胰岛素治疗后FBG浓度无明显差异[MD=0.06,95%CI(-0.54,0.66)],但是患者的每日胰岛素用量明显下降。

图5 中国糖尿病患者接受人胰岛素或动物胰岛素治疗局部不良反应发生率比较的Meta分析
⑵餐后2h血糖浓度(2h-PBG):有3个RCT[25-27]研究报告了患者接受短效或中效人胰岛素或动物胰岛素治疗后2h-PBG浓度。M eta分析上述研究显示,患者接受人胰岛素与接受动物胰岛素治疗后2h-PBG浓度无明显差异[MD=-0.36, 95%CI(-1.4, 0.69)],但是患者的每日胰岛素用量明显下降。
由于FBG和2h-PBG对于胰岛素剂型较敏感,对于此两项指标的分析仅限于明确表明了胰岛素剂型的研究的亚组分析。对其他临床结局指标(每日胰岛素用量、低血糖反应发生率和注射部位红肿硬结)进行亚组分析显示其结果与总体分析结果一致(数据未示出)。对于HbA1c这一临床结局指标,由于缺少足够的数据,无法进行亚组分析。
4 讨论
本文首次采用M eta分析的方法对文献中有关人胰岛素和动物胰岛素在中国糖尿病患者中的安全性和有效性进行了比较。我们分析发现在中国糖尿病患者中,人胰岛素比动物胰岛素在多个临床结局指征上显示出较好的安全性和有效性。对于中国糖尿病患者,由动物胰岛素治疗转为人胰岛素治疗具有额外的益处。
本M eta分析表明,人胰岛素在中国糖尿病患者中较动物胰岛素具有更好的安全性和有效性。我们分析发现中国糖尿病患者在接受胰岛素治疗达到血糖满意控制后,接受人胰岛素治疗的患者所需每日胰岛素剂量明显低于接受动物胰岛素治疗的患者。这一结果与先前一项在白种人糖尿病患者中进行的研究的Meta分析的结果不同。Richter等[12]的Meta分析结论表明,在疗程(平均5.8个月,介于1至24个月之间)结束时每日所需人胰岛素的剂量与动物胰岛素剂量无明显差异。Richter等Meta分析报告的每日所需胰岛素的剂量与本M eta分析结论不一致可能是由于患者的种族差异所致。另外,可能的原因包括由于中国药典对胰岛素的质量标准的规定与欧美国家有所不同,从而导致测定胰岛素品质和胰岛素效价所使用的方法上的差异。重组人胰岛素于1993年进入中国市场,本文纳入的研究对于人胰岛素和动物胰岛素的比较绝大部分发表于1996~2010年间,在此期间,由于胰岛素的多组分前提,中国药典对动物胰岛素一直采用生物效价测定法,存在一定的误差,其准确性较低;且对胰岛素原,炽灼残渣,微生物限度及细菌内毒素均无检查要求,而对人胰岛素测定项目与欧美药典类似,采用仪器分析法。同时期,国外欧美药典对动物胰岛素则多采用仪器分析法[40,41]。另外,疗程的长短也可能对胰岛素的疗效和安全性造成影响。本Meta分析所纳入的研究中超过50%的研究没有报告疗程的长短。
我们发现在中国糖尿病患者中,人胰岛素同动物胰岛素相比能更加有效地降低HbA1c,同时患者每日所需人胰岛素的剂量比动物胰岛素的剂量明显降低。Richter等[12]的Meta分析报告了人胰岛素降低HbA1c的效果较动物胰岛素更好,虽然其差别未达到明显的统计学差异,但与本文的结论基本一致。另外,同动物胰岛素治疗相比,人胰岛素治疗对患者的FBG和2h-PBG没有明显的差异,但使患者达到相似的FBG和2h-PBG每日所需的人胰岛素剂量明显低于所需的动物胰岛素剂量。以上结果提示,人胰岛素控制高血糖症的疗效可能较动物胰岛素更好。
我们发现在中国糖尿病患者中,同使用动物胰岛素治疗相比,使用人胰岛素治疗发生低血糖反应的几率较低。Airey等[13]在一项系统评价中报告了在白种人糖尿病患者中,使用人胰岛素治疗与使用动物胰岛素治疗相比,低血糖症发生率无明显差异。同样,Richter等[42]的Meta分析也报告了白种人糖尿病患者中的类似结论。但是,有多项研究显示人胰岛素治疗可伴有无症状低血糖反应以及发生严重低血糖的风险增加[43-45]。以上研究主要是在白种人糖尿病患者中进行,本研究结论与上述文献不一致可能是由于遗传背景差异所致(中国人与白种人),因为有证据显示遗传背景的差异对亚裔糖尿病患者和白种人糖尿病患者在接受人胰岛素治疗时发生严重低血糖反应的几率有影响[46]。
本次M eta分析显示在中国糖尿病患者中,与动物胰岛素治疗相比,人胰岛素治疗发生局部不良反应的几率较低。有文献报告显示,较高的胰岛素抗体浓度与较高的局部不良反应发生率相关[12]。与动物胰岛素相比,重组人胰岛素因其氨基酸序列与内源性胰岛素完全一致,其免疫原性较低。有研究发现当由动物胰岛素转换为人胰岛素后,胰岛素抗体的浓度降低[12]。另外,同猪胰岛素相比,牛胰岛素治疗伴有较高的胰岛素抗体浓度[12],这可能是由于同猪胰岛素相比,牛胰岛素与人胰岛素的化学结构差异较大。由于人胰岛素具有较低的免疫原性,以此可以解释人胰岛素的局部反应发生率较低。但是本Meta分析中的研究没有报告胰岛素抗体的浓度的变化。
本研究的优点在于纳入研究的病例来自于日常临床实践,研究结果反映日常临床工作的实际情况。本研究同时采用了多个临床结局指标用于比较人胰岛素和动物胰岛素的安全性和有效性,因此结论具有较好的临床实际意义。本研究的局限性在于,国内多数研究的样本较小,多数试验没有报告随机分配方法和盲法。重要的临床指标,如疗程的长短没有被详细地描述。另外须指出,各纳入研究间对患者达到血糖满意控制的标准不完全相同,但由于动物胰岛素和人胰岛素的疗效和安全性是按照相同的标准进行比较的,因而不会对研究的结论造成明显影响。
本文首次对在中国糖尿病患者中对比人胰岛素与动物胰岛素安全性和有效性的研究进行了M eta分析。本Meta分析结果显示,人胰岛素和动物胰岛素能够有效地控制高血糖症。而且,达到理想血糖控制后,所需人胰岛素的平均每日剂量明显低于动物胰岛素。同时,人胰岛素比动物胰岛素能更有效地降低HbA1c。人胰岛素治疗的低血糖反应和局部不良反应都比动物胰岛素低。
综上所述,在中国糖尿病患者中,与使用动物胰岛素相比,使用人胰岛素可能具有较好控制血糖、每日用量较低和不良反应较少的优点。但是须指出的是,上述结论还需要更多具有良好试验设计的前瞻性研究来加强对这一结论的支持。
[1] Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010, 362(12): 1090-1101.
[2] Yang ZJ, Liu J, Ge JP, et al. Prevalence of cardiovascular disease risk factor in the Chinese population: the 2007-2008 China National Diabetes and Metabolic Disorders Study[J]. Eur Heart J, 2012, 33(2): 213-220.
[3] He J, Gu D, Wu X, et al. Major causes of death among men and women in China[J]. N Engl J Med, 2005, 353(11): 1124-1134.
[4] Xu Y, Wang L, He J, et al. Prevalence and control of diabetes in Chinese adults[J]. JAMA, 2013, 310(9): 948-959.
[5] National diabeties research group. Diabetes mellitus survey of 300,000 in fourteen provinces and cities of China[J]. Chinese Journal of Internal Medicine(中华内科学杂志), 1981, 20: 678-681.
[6] Melmed S, Willams R. W illiams textbook of endocrinology(12th Ed.)[M]. Philadelphia: Elsevier/Saunders. 2011: 1371-1435.
[7] UK prospective diabetes study(UKPDS)group. Intensive bloodglucose control w ith su lphony lureas or insu lin com pared w ith conventional treatment and risk of complications in patients w ith type 2 diabetes(UKPDS 33)[J]. Lancet, 1998, 352(9131): 837-853.
[8] Vajo Z, Faw cett J, Duckworth WC. Recombinant DNA technology in the treatment of diabetes: insulin analogs[J]. Endocr Rev, 2001, 22(5): 706-717.
[9] Gregory R, Tattersall RB. Bovine and human NPH insulins as T cell immunogens[J]. Diabetes Res Clin Pract, 1993, 20(2): 139-146.
[10] A ltman JJ, Feldman S, Bonnemaire M, et al. No increase of hypoglycaem ia upon transfer of aged longstanding type 1 diabetic patients to human insulin: a prospective random ized study. The Investigators of the Transfert Study[J]. Diabetes M etab, 1998, 24(5): 419-423.
[11] Schernthaner G. Immunogenicity and allergenic potential of animal and human insulins[J]. Diabetes Care, 1993, 16(Suppl 3): 155-165.
[12] Richter B, Neises G. 'Human' insulin versus animal insulin in people w ith diabetes mellitus[J]. Cochrane Database Syst Rev, 2005(1): CD003816.
[13] Airey CM, Williams DR, Martin PG, et al. Hypoglycaem ia induced by exogenous insulin-'human' and animal insulin compared[J]. Diabet Med, 2000, 17(6): 416-432.
[14] 胰岛素市场研究报告(2010版)[EB]. http://w enku.baidu.com/view/d53ddde9aeaad1f346933ff0.htm l.
[15] Ye H, Li HQ. Human and porcine insulin in the treatment of diabetes, a clinical analysis[J]. Modern M ed J China(中国现代医药杂志), 2007 9(10): 114.
[16] Pang YY. Comparison of human insulin and animal insulin in the treatment of diabetes[J]. J GuangXi M ed Uni( 广西医科大学学报), 2000, 17(4): 676-677.
[17] Wang ZY. Efficacy of Novolin 30R in diabetes, an observation in 30 cases[J]. J Guiyang Med College(贵阳医学院学报), 2005, 30(4): 358-359.
[18] Wang JY, Zhang LH, Jin JM, et al. Clinical analysis of human insulin and animal insulin in the treatment of diabetes[J]. Liaoning J Pract Diabetol(辽宁实用糖尿病杂志), 2000, 8(1): 47.
[19] Luo XB, RAN QM. App lication of protam ine zinc insulin 30R in primary hospital[J]. Chin J Mod Drug App(中国现代药物应用), 2012, 6(6): 82-83.
[20] Deng SP, Duo ZZ, Wu W, et al. Ef f i cacy of semisynthetic human insulin in diabetes[J]. Chin J Endocrinol Metab(中华内分泌代谢杂志), 1990, 6(2): 75-76.
[21] Nong WZ. Ef f i cacy of recombinant human insulin and animal insulin in diabetes[J]. J GuangXi Med Uni(广西医科大学学报), 2004, 21(4): 591-592.
[22] Liu ZL, Zou WH, Lai XY, et al. Clinical analysis of treatment of diabetes w ith human and porcine insulins[J]. Pract Clini Med(实用临床医学), 2001, 2(3): 46-47.
[23] Liu HY. Efficacy of recombinant human insulin in the treatment and care of diabetes[J]. J Huanan Uni-Med Edition(南华大学学报•医学版), 2001, 29(3): 324-325.
[24] Xi HR. Novolin30R in the treatment and care of type 2 diabetes[J]. Chin Med Herald(中国医药导报), 2010. 7(9): 58-59.
[25] Zeng XY. Com paring the efficacies of two types of insulin in the treatment of diabetes[J]. Clin Focus(临床荟萃), 2001, 16(15): epub.
[26] Wang JY, Zhang LH, Jin JM, et al. Efficacy of synthetic insulin and animal insulin, a comparison[J]. New Med(新医学), 2000, 31(5): 285.
[27] Wei JL. Comparing ef f i cacy of Isophane insulin 30R and Novolin 30R in diabetes[J]. Heilongjiang Med J(黑龙江医药), 2008, 21(6): 78.
[28] Bao AM, Yang MG, Liu SQ. Clinial observation of prem ixed insulin in the treatment of patients w ith diabetes[J] J Clin Healthcare(临床中老年保健医学), 1999, 2(1): 16-17.
[29] Bao AM, Wang YH, Liu SQ, et al. Ef f i cay of premixed human insulin in 56 cases of diabetes[J]. Anhui Med J(安徽医学), 2000, 21(2): 11-12.
[30] Wu D, Zhang W, Wu SL, et al. efficacy of Novolin 30R and regular animal insulin, a comparison[J]. Liaoning J Pract Diabetol (辽宁实用糖尿病杂志), 2002, 9(2): 62.
[31] Zhou YZ. Sw itching from porcine insulin to human insulin treatment, a clinical observation[J]. Liaoning J Pract Diabetol (辽宁实用糖尿病杂志), 2002, 9(2): 46.
[32] Yao DG, Pan RJ. Recombinant human insulin in insulin antibody positive patients, a clinical observation(重组人胰岛素治疗胰岛素抗体阳性的糖尿病患者临床观察)[J]. Zhejiang Med J(浙江医学), 2000, 22(3): 83.
[33] Ning L. Recombinant human insulin treatment in 48 cases of diabetes[J]. J Jiangxi Med College(江西医学院学报), 1996, 36(4): 64.
[34] Zhu XX. Clinical observation of human insulin(Novolin), ef f i cay and safety[J]. Shangdong Med J(山东医药), 1997, 37(12): 13.
[35] LI Y. Ef f i cacy of human insulin in elderly diabetic patients, an observation of 30 cases[J]. Chengdu Med J(成都医药), 2003. 29(4): 204.
[36] Yuan QY. Recombinant human insulin, efficay in 63 patients w ith diabetes - an observational study[J]. Central Plains Med J(中原医刊), 2005, 32(5): 41.
[37] Hao QS, Yang CM, Zhou J. Human insulin in the treatment of type 1 diabetes, a report from 38 cases[J]. Shangdong Med J(山东医药), 2000, 40(6): 63.
[38] Giuglianon D, Maiorino M I, Bellastella G, et al. Efficacy of insulin analogs in achieving the hemoglobin A 1c target of<7% in type 2 diabetes: meta-analysis of random ized controlled trials[J]. Diabetes Care, 2011, 34(2): 510-517.
[39] Jadad AR, Moore RA, Carroll D, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary?[J]. Control Clin Trials, 1996, 17(1): 1-12.
[40] Wang YM. Quality standards and preparations of insulin in China[J]. Chinese Pharm A ffairs(中国药事), 2012,. 26(9): 5.
[41] Wang WX, Liu W, Zhou Y, et al. Insulins in pharmacopoeia of China, US and UK, a comparison[J]. Jiangsu Pharm and Clini Res(江苏药学与临床研究), 2005, 13(5): 2.
[42] Richter B, Neises G . 'Human' insulin versus animal insulin in people w ith diabetes mellitus[J]. Cochrane Database Syst Rev, 2002,(3): CD003816.
[43] M aran A, Lomas J, A rchibald H, et al. Double blind clinical and laboratory study of hypoglycaemia w ith human and porcine insulin in diabetic patients reporting hypoglycaemia unawareness after transferring to human insulin[J]. Bri Med J, 1993, 306(6871): 167-171.
[44] Cryer PE. Hypoglycem ia unawareness in IDDM[J]. Diabetes Care, 1993, 16 Suppl 3: 40-47.
[45] Egger M, Sm ith GD, Teuscher A. Human insulin and unawareness of hypoglycaem ia: need for a large random ised trial[J]. Bri Med J, 1992. 305(6849): 351-3555.
[46] Davidson JA, Lacaya LB, Jiang H, et al. Impact of race/ethnicity on the ef f i cacy and safety of commonly used insulin regimens: a post hoc analysis of clinical trials in type 2 diabetes mellitus[J]. Endocr Pract, 2010, 16(5): 818-828.