杭州地区乙型肝炎病毒基因分型与临床指标关系研究
2015-08-07陈燕敏袁武锋庞珍珍
陈燕敏 袁武锋 庞珍珍


[摘要] 目的 分析杭州地区乙肝病毒基因分型分布情况及与乙肝病毒DNA定量、乙肝两对半定性/半定量、AFP定量各项指标间的联系。 方法 对临床146例乙肝病毒DNA阳性患者,用PCR 法进行乙肝病毒基因分型及乙肝病毒DNA定量检测;用ELISA法进行乙型肝炎两对半定量检测;用夹心法进行AFP定量检测,以分析彼此间的相关性。 结果 经统计,B型75例,占51.4%;C型62例,占42.5%;非B非C型共9例,占6.2%;男女性患者基因分型的构成比差异无统计学意义。C型乙肝病毒DNA水平明显高于B型,C型乙肝表面抗原及E抗原定量测定值高于B型。C型患者AFP定量测定均值较B型高,但二者差异无统计学意义(P>0.05)。 结论 杭州地区乙肝病毒基因型以B型为主,C型次之;C型乙肝病毒DNA含量较B型高,肝脏损害较B型严重。
[关键词] 乙型肝炎;基因分型;乙肝临床指标
[中图分类号] R512.62 [文献标识码] B [文章编号] 1673-9701(2015)21-0097-04
[Abstract] Objective To study the distribution of HBV genotypes and the relationship between HBV genotypes and the clinical characteristics in Hangzhou area. Methods The genotype, content of HBV-DNA, serological indicators and AFP were detected by RT-PCR, time resolved immunofluorescence method respectively in 146 cases of HBV-DNA positive patients. The relationship between HBV genotype and the clinical characteristics were analyzed by the statistical analysis. Results In the HBV genotyping, there were 75 cases of type B (51.4%),62 cases of type C (42.5%),9 cases of no B or no C type (6.2%);In type C, the HBV-DNA, HbsAg and HbeAg content were significantly higher than the type B. The content of AFP in type C was higher than type B, but with no statistical difference(P>0.05). Conclusion In Hangzhou area, the priority genotype of HBV is type B. Genotype has a certain relationship with the clinical characteristics and the severity of the disease.
[Key words] Hepatitis B virus; Genotype; Clinical characteristics
乙型肝炎(hepatitis B virus,HBV)是我国发病率较高的疾病,现约有1.2亿乙肝病毒携带者,现症慢性乙型肝炎患者达2000多万人,我国每年用于肝炎对症治疗的直接医疗费用超过500亿人民币。
HBV病毒是嗜肝DNA病毒,是引起急、慢性肝炎的主要病原体之一,可导致不同程度肝硬化及肝癌等。而乙肝病毒在宿主体内复制的过程中,会发生核苷酸的错误配对,致使同一病毒核苷酸序列不同的差异,并表现为不同的病毒基因型。目前,根据乙肝病毒S区基因序列差异≥4%或全基因核苷酸序列的异质性≥8%的特点,将乙肝病毒区分为A、B、C、D、E、F、G和H八种基因型[1,2]。大量研究表明乙肝病毒的基因型具有一定的地域分布特点,并且乙肝病毒的传播方式、临床疾病谱、预后判断、疫苗预防及抗病毒治疗效果与其关系密切。本研究采用实时荧光定量PCR荧光探针法对146例乙肝患者的标本进行基因分型测定及乙肝病毒DNA定量、乙肝两对半定量、AFP定量的测定,分析杭州地区乙型肝炎病毒基因型的分布与各项检测指标之间的联系。现报道如下。
1 资料与方法
1.1 标本来源
选择2013年1~10月就诊于浙江省人民医院的146例HBV感染者,均为门诊就诊或住院的杭州地区居民。诊断符合2000年全国病毒性肝炎会议制定的标准,入选病例均排除合并甲、丙、丁、戊型等其他肝炎病毒感染,且乙肝病毒DNA定量均为阳性。其中男108例,女38例,年龄11~78岁,平均(35.9±1.4)岁。
1.2 试剂与仪器
乙肝病毒基因分型及DNA定量检测试剂来源于上海复星医药集团公司;乙肝两对半定量检测试剂来源于英科新创(厦门)科技有限公司;AFP定量试剂来源于罗氏诊断产品(上海)有限公司。所使用的仪器包括ABI7500全自动荧光实时定量PCR仪及罗氏E170。
1.3 观察指标
观察乙肝病毒感染者的基因分型,B型、C型和非B非C型乙肝病毒DNA定量及AFP定量、乙肝表面抗原及乙肝E抗原与乙肝病毒基因分型的相关性。
1.4 检测方法
1.4.1 乙肝病毒基因分型和HBV-DNA定量检测 采用实时荧光定量PCR法对乙肝病毒进行基因分型,并对患者的HBV-DNA进行定量检测。
1.4.2 乙肝两对半定量检测 采用时间分辨荧光分析法进行乙型肝炎两对半定量检测,包括HBsAg、抗-HBs、HBeAg、抗-HBe和抗-HBc五种指标。
1.4.3 AFP定量检测 采用时间分辨荧光分析法对患者血清中AFP水平进行定量检测。
1.5 统计学分析
采用SPSS19.0统计学软件进行分析,计量资料以(x±s)表示,符合正态分布的计量资料采用成组设计t检验,不符合正态分布则用秩和检验;计数资料采用χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 基因分型测定结果
146例杭州地区的乙肝病毒感染者的基因分布为:B型75例,占51.4%,C型62例,占42.5%,非B非C型共9例,占6.2%,见表1。男女性患者基因分型的构成比差异无统计学意义(χ2=0.328,P>0.05)。
2.2 基因分型与乙肝病毒DNA定量测定
乙肝病毒DNA定量与乙肝病毒基因分型存在一定的相关性。对B型及C型的乙肝病毒DNA定量测定数据进行统计分析,得出杭州地区C型乙肝患者与B型比较,乙肝病毒DNA定量测定值差异具有统计学意义(P<0.05),C型的乙肝病毒DNA定量测定均值较B型高,见表2。
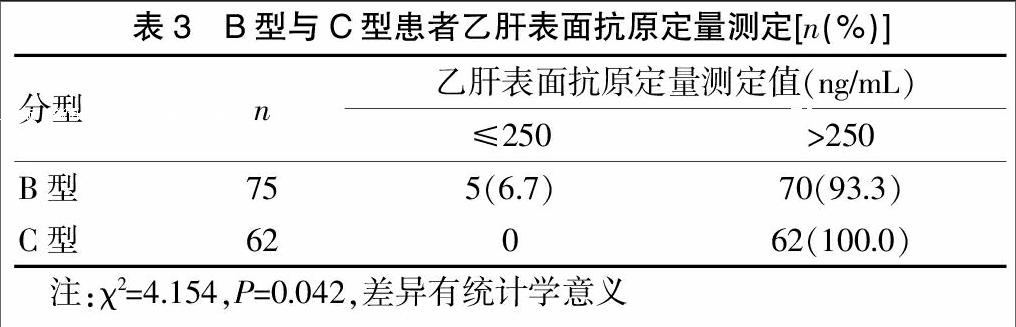
2.3 基因分型与乙肝表面抗原定量测定
乙型两对半定量检测项目中,乙肝表面抗原、乙肝E抗原与乙肝病毒基因分型相关性较大。将B型与C型的乙肝表面抗原定量测定值分为>250 ng/mL和≤250 ng/mL两组,进行计量统计分析。数据表明C型乙肝表面抗原定量测定值较B型高,差异具有统计学意义(P<0.05),见表3。
2.4 基因分型与乙肝E抗原定量测定
对146例患者的乙肝E抗原定量测定值进行统计分析,得出杭州地区C型乙肝患者与B型比较,C型乙肝E抗原定量较B型高,差异具有统计学意义(P<0.05),见表4。选取乙肝E抗原的阳性率作统计分析,C型的乙肝E抗原阳性率较B型高,差异具有统计学意义(P<0.05)。见表5。
2.5基因分型与AFP定量测定
对已做过AFP检测的146例乙肝病毒DNA阳性患者的受检样本进行秩和检验统计,其中B型47例,C型36例。结果显示C型乙肝患者的AFP定量测定均值较B型高,但二者差异无统计学意义(P>0.05)。见表6。
3 讨论
在世界各地中,乙型肝炎病毒感染有着不同程度的流行。其中,不同地区的乙型肝炎病毒基因型差异非常明显,不同国家和国内地区间流行程度的差异,除生活习惯、人体免疫遗传特征等因素明显相关外,其与乙型肝炎病毒本身的生物学基因型、血清亚型和基因变异等也呈一定程度的相关性。在不同的地理区域中,乙型肝炎病毒基因的分型呈不同的分布,在不同人种中的流行及传播方式也存在很大差异。在我国,乙型肝炎病毒主要流行A、B、C、D四种HBV基因型,所占比例分别为1.2%、39.3%、50.2%及8.1%,且不同省份不同地区的基因型也存在较大的差异,北方地区以C型为主,约占81.6%;南方地区则以B型为主,C型则占很小一部分[3]。本研究统计146例乙肝病毒DNA定量阳性的受检样本的基因分型情况,结果显示杭州地区乙肝基因型以B型为主,共75例,占51.4%;C型次之,共62例,占42.5%;非B非C型有9例,占6.2%。之前研究结果显示江西萍乡地区B型为优势基因型,占68.1%,C型占12.4%[4];但广东地区基因型以B型为主,C型次之[5]。本次统计结果与普遍报道的南方以感染B型乙肝病毒为主相符。
不同基因型的乙型肝炎病毒具有不同的致病性及流行特征,故了解患者乙肝病毒基因分型具有重要的临床意义。本研究统计结果显示杭州地区C型乙肝病毒DNA定量测定值较B型高,差异具有统计学意义(P<0.05),提示C型乙肝病毒DNA复制较活跃。目前认为,乙型肝炎发病机制中乙肝病毒的复制状态与其基因型之间有无关系尚存在争议,但乙肝病毒诱导的免疫反应及血清中高滴度的乙肝病毒是其发病危险因素之一[6]。有学者发现C型较B型高HBV-DNA血症,认为可能是因为乙肝病毒DNA高复制水平的长期存在导致C型患者更为严重的肝脏炎症活动和肝硬化发生率。但樊笑霞等[7]研究报道B、C型感染患者血清乙肝病毒DNA之间差异无统计学意义,尽管乙肝病毒的复制状态与其基因型之间有无关系尚存在争议,从以上研究我们认为C型乙肝病毒感染者在进入免疫清除期时乙肝病毒反复活动,持续造成肝脏组织损伤,转归与预后较B型差。
文献[8]报道B型乙肝病毒较C型乙肝病毒更容易通过前C区变异诱导e 抗原的转化,转归及预后较C型好。通过对146例患者乙肝两对半的检测显示,C型乙肝表面抗原定量测定值较B型高,差异具有统计学意义(P<0.05);C型乙肝E抗原定量较B型高,差异具有统计学意义(P<0.05),且乙肝E抗原阳性率C型较B型高,差异具有统计学意义(P<0.05),提示C型乙肝病毒复制较活跃,易形成持续的病毒血症,但不易发生e系统的血清转换。
据研究显示[9],AFP约在83%的肝癌患者血清中升高,而在肝硬化等患者中亦可出现不同程度的升高。而有研究[10]发现C型乙肝感染者较B型更易发展至肝硬化等重症肝病,炎症程度更为严重,且与肝细胞肝癌的发生更为密切。故对146例乙肝病毒DNA阳性的患者中检测过AFP定量的样本进行统计,其中B型47例,C型36例。结果显示C型乙肝患者AFP定量测定均值较B型高,但二者差异无统计学意义(P>0.05)。该统计结果可能受标本量的影响,乙肝病毒基因分型结果与AFP定量值是否存在联系,还需进一步统计研究。
大量研究表明,抗乙肝病毒的药物治疗,尤其是干扰素治疗的临床疗效与HBV-DNA的定量水平有直接关联,HBV-DNA 载量低则干扰素治疗疗效好,HBV-DNA 载量高则干扰素治疗疗效差[11-14]。本研究分析2013年杭州地区乙型肝炎病毒基因型的分布情况及与乙肝病毒DNA定量、乙肝两对半定量和AFP定量各项指标的关系,结果对于了解本地区乙型肝炎病毒各基因型的特点做了初步的研究。由于不同乙肝病毒基因型之间的地理分布、分子生物学特征以及临床转归不同[15-22],深入研究乙肝病毒的基因型对于进一步明确乙肝病毒的分子流行病学特点、确定传播关系、鉴别传染源、阐明发病机制和临床治疗的疗效等都具有重要意义。
[参考文献]
[1] Weber B. Genetic variability of the S gene of hepatitis B virus:Clinical and diagnostic impact[J]. J Clin Virol,2005, 32(2):102-112.
[2] Arauzruiz P,Na rder H,Robertson H,et al. Genotype H:A new Amerindian genotype of the hepatitis B virus revealed in central America[J]. J Genvirol,2002,83(Pt 8):2059-2073.
[3] Wang Z,Liu Z,Zeng G,et al. A new intertype recombinant between genotypes C and D of hepatitis B virus identified in China[J]. J Gen Virol,2005,86(Pt 4):985-990.
[4] 陈燕萍,罗娜,王长奇,等. 萍乡地区乙肝病毒基因多态芯片酶联分析基因分型检测报告[J]. 中国医师杂志,2007, 9(7):971-972.
[5] 关玉娟,杨湛,唐小平,等. 广东地区乙型肝炎病毒基因型研究[J]. 广东医学,2006,27(1):63-65.
[6] 冯体玉,曾东梅. 梅州地区乙型肝炎病毒基因分型与临床指标的关系[J]. 国际检验医学杂志,2013,34(15):31-33.
[7] 樊笑霞,陈军,徐丽萍,等. 上海地区不同类型乙肝患者HBV基因分型与DNA水平[J]. 山东医药,2009,49(21):14-18.
[8] 张勇,石铭,綦盛麟,等. 乙肝病毒携带者病毒基因分型与C基因启动子及前C区变异的相关性分析[J]. 中国实验诊断学,2010,14(6):929-930.
[9] 范公忍,邬光惠,胡大荣,等. 肿瘤特异性生长因子测定在肝癌诊断中的应用及与AFP比较[J]. 癌症,2001,20(2):203-208.
[10] 戴晨阳,梁树人,李顺天,等. 乙型肝炎病毒基因B型和C型与临床关系的研究[J]. 中国医学检验杂志,2004, 5(5):391-393.
[11] Firdaus R,Saha K,Biswas A,et al. Current molecular methods for the detection of hepatitis C virus in high risk group population:A systematic review[J]. World J Virol, 2015,4(1):25-32.
[12] Webster DP,Klenerman P,Dusheiko GM,et al. Hepatitis C[J]. Lancet,2015,385(9973):1124-1135.
[13] Seeger C,Mason WS. Molecular biology of hepatitis B virus infection[J]. Virology,2015,6822(15):77-82.
[14] Rossi LM,Escobar-Gutierrez A,Rahal P,et al. Advanced molecular surveillance of hepatitis C virus[J]. Viruses,2015,7(3):1153-1188.
[15] Papastergiou V,Karatapanis S. Current status and emerging challenges in the treatment of hepatitis C virus genotypes 4 to 6[J]. World J Clin Cases,2015,3(3):210-220.
[16] Mukherjee R,Burns A,Rodden D,et al. Diagnosis and management of hepatitis C virus infection[J]. J Lab Autom,2015,2(3):29-49.
[17] Enomoto M,Tamori A,Nishiguchi S,et al. Hepatitis B virus genotypes and response to antiviral therapy[J].Clin Lab,2006,3(2):43-47.
[18] Sumi H,Yokosuka O,Seki N,et al. Influence of hepatitis B virus genotypes on the progression of chronic type B liver diseas[J]. Hepatology,2003,37(1):19-26.
[19] Yajun S,Erhei D,Jin W,et al. Genotyping of hepatitis B virus(HBV)by oligonucleotides microarray[J]. Molecular and Cellular Probes,2006,20(2):121-127.
[20] Wright TL. Introduction to chronic hepatitis B infection[J].Am J Gastroenterol,2006,101(Suppl 1):S1-S6.
[21] Kao JH,Chen PJ,Lai MY,et al. Clinical and virological aspects of blood donors infected with hepatitis B virus genotypes B and C[J]. J Clin Microbiol,2002,40(1):22- 25.
[22] Watanabe K,Takahashi T,Takahashi S,et al. Comparative study of genotype B and C hepatitis B virus induced chronic hepatitis in relation to the basic core promoter and precore mutations[J]. J Gastroenterol Hepatol,2005, 20(3):441-449.
(收稿日期:2015-03-05)
