食用菌中多糖与锌离子配合工艺优化
2015-08-05孙胜敏
陈 平,杜 佳,孙胜敏
(哈尔滨商业大学食品工程学院,哈尔滨150076)
食用菌多糖具有广泛的应用价值,如香菇中含有人体所需的多糖,多糖具有极其重要的生物功能[1].多糖与免疫功能的调节、细胞与细胞的识别、细胞间物质的转运、癌症的诊断与治疗等都有着密切的关系[2].锌是人体中不可缺少的微量元素,元素锌作为体内重要的必需微量元素,有明显的抗氧化作用.锌通过金属硫蛋白(MT)发挥抗氧化作用,MT能够抵御重金属的毒性作用[3],在保证金属元素的稳态以及清除自由基等方面发挥重要的作用.缺锌的结果可能是血清胸腺素的活性显著下降,而且补锌可使其得到纠正[4].复合多糖配合盐具有抵抗干扰,很容易被动物体消化吸收,在补充锌的同时又补充了动物体所需的多糖.本实验采用原料为食用菌香菇,经微波辅助热水浸提法提取得复合多糖[5],将复合多糖与醋酸锌在适当条件下进行配合反应制备复合多糖-锌(Ⅱ)的配合物,并对其最适反应条件进行初步研究.本实验方法也适用于菌类加工中回收的多糖与锌的配合[6].
1 材料与方法
1.1 材料与试剂
复合多糖,自制;醋酸锌、盐酸、氢氧化钠(分析纯)、乙酸锌、硫代硫酸钠、冰醋酸、乙酸钠、二硫腙、四氯化碳,天津市嘉兴化工有限公司;sephadex-G200,北京天恩泽有限公司.葡聚糖标准品MW=1.26 ×104g/moL,MW=6.06 ×104g/moL,中国计量科学研究院.Dextran标准品 MW=3.35×104g/moL,MW=9.11 ×104g/moL,美国聚合物标准品公司.
1.2 仪器与设备
FA2004N型电子天平,上海精密科学仪器有限公司;85-2型控温磁力搅拌器,江苏金坛医疗仪器厂;TU1901型双光束紫外-可见分光光度计,北京普析通用仪器有限公责任公司;722E型分光光度计,上海光谱仪器有限公司;RE52-98型旋转蒸发器,上海亚荣生化仪器厂;GZX-DH-30×35型电热恒温箱,上海跃进医疗器械厂;Spectrum one型红外分光光度计,美国Perkin-Elmer公司;精密净化交流稳压电源,上海三科电器有限公司;美国waters高效液相色谱仪.
1.3 试验方法
复合多糖的制备与纯化:准确称取经过研磨的食用菌(香菇、元菇)干粉5 g于烧杯中,加入100 mL蒸馏水,用5 mol/L盐酸水解,料液比1∶20水浴加热 6 h,浸提后进行微波辅助提取[7-8],在微波功率为80%条件下微波处理4 min,提取混合多糖.后经过离心取出上清液,加入活性炭,在60℃水浴振荡30 min脱色完全.加入sevag(三氯甲烷∶正丁醇=4∶1)试剂,去除粗多糖中的蛋白质.并用葡聚糖凝胶对提取液中复合多糖进行纯化[9],然后将纯化液经过3 000 r/min离心,冷冻干燥,制得混合多糖[10-13],其中复合多糖得率为 3.75%,元菇多糖得率得率为2.15%.香菇中多糖得率高于元菇多糖得率,所以本实验中复合多糖为香菇多糖.
1.4 复合多糖Zn(Ⅱ)配合物的合成
取一定质量比的复合多糖和醋酸锌混合溶于200 mL水中,控制溶液的反应温度,调节pH值,反应一定时间后,经4 000 r/min离心10 min,取上清液做减压蒸馏.醇沉、把减压蒸馏后剩余少量液体预冻,进行冷冻干燥,干燥后称量配合物质量,而后水解分离,得到多糖锌的配合物.
1.4.1 复合多糖Zn(Ⅱ)配合物的结合率含量的测定
吸取水样10.0 mL于25mL比色管中,如水样锌含量超过5 mg,可取适量水样 ,用纯水稀释至10.0 mL.另取比色管8支,依次加入1 mg/mL锌标准使用溶液 0、0.50、1.00、2.00、3.00、4.00 和5.00 mL,各加纯水至 10 mL.向比色管中各加5.0 ml乙酸-乙酸纳缓冲溶液,混匀,再各加1.0 mL硫代硫酸钠溶液,混匀,然后加入2.5 mL双硫腙-T ween 80溶液,摇匀,静置 20 min.于525 nm波长,用20 mm比色皿,以纯水为参比,测量样品和标准系列吸光值.
1.4.2 合成复合多糖Zn(Ⅱ)配合物的温度的选择
分别称量6份一定质量比的复合多糖和醋酸锌混合溶于200 mL水中,调节溶液pH9.0,控制反应时间为65 min,并控制反应温度分别为30、40、50、60、70、80 ℃.醇沉、把减压蒸馏后剩余少量液体预冻,进行冷冻干燥,干燥后称量配合物质量,而后水解分离,得到多糖锌的配合物.而后按1.4.1方法测定每份溶液中复合多糖Zn(Ⅱ)配合物中Zn(Ⅱ)的浓度,从而选择合成配合物的最佳温度.
1.4.3 合成复合多糖Zn(Ⅱ)配合物的时间的选择
分别称量6份一定质量比的复合多糖和醋酸锌混合溶于200 mL水中,调节溶液pH9.0,控制反应温度为60℃,并控制反应时间分别为30、40、50、60、70、80 min.醇沉、把减压蒸馏后剩余少量液体预冻,进行冷冻干燥,干燥后称量配合物质量,而后水解分离,得到多糖锌的配合物.按1.4.1方法测定每份溶液中复合多糖Zn(Ⅱ)配合物中Zn(Ⅱ)的浓度,从而选择合成配合物的最佳时间.
1.4.4 合成复合多糖Zn(Ⅱ)配合物的pH值的选择
分别称量6份一定质量比的复合多糖和醋酸锌混合溶于200 mL水中,控制反应温度为60℃,并控制反应时间为60 min.并在每份溶液中分别加入缓冲溶液调节溶液 pH 值分别为 3、5、7、9、11、13,醇沉、把减压蒸馏后剩余少量液体预冻,进行冷冻干燥,干燥后称量配合物质量,而后水解分离,得到多糖锌的配合物.按1.4.1方法测定每份溶液中复合多糖Zn(Ⅱ)配合物中Zn(Ⅱ)的浓度,从而选择合成配合物的最佳pH值.
1.5 配合物最佳合成工艺确定
取不同质量比的复合多糖和醋酸锌按照合成工艺进行配合反应.采用分光光度法分析,浓度越大,即配合程度越大,则可根据吸光度的变化趋势,确定出最佳反应条件.并用正交试验确定最佳的配合条件[14-16].
1.6 香菇中复合多糖的分子质量的确定方法
精确称取不同分子质量的葡聚糖标准品0.05 g,用流动相溶解并定容至5 mL.最终质量浓度为10 mg/mL.分别进样10 μL,以不同分子质量标准葡聚糖的分离保留时间与相应分子的质量建立分子质量对数值绘制标准坐标曲线.待测样品经分离后得到不同分子质量峰的保留时间值,通过分子质量标准工作曲线即可计算其多糖分子质量[17].
1.7 配合物最大吸收波长的确定
按以上配合工艺制得配合物后,取0.25 g溶于80 mL蒸馏水中,配制成配合物溶液,在可见-紫外光区(190~500 nm)扫描测定出最大吸收波长.
1.8 配合物配合比的确定
采用等摩尔连续变化法,配制一系列浓度的金属锌离子溶液和复合多糖溶液,使锌离子和复合多糖的浓度总和为一定值,而连续改变金属离子和复合多糖的浓度比值,测定各测试溶液的吸光度,以吸光度A-f(复合多糖的物质的量与锌离子的物质的量比值)作图,由图可确定配合物的配合比[18-19]
1.9 配合产物的表征
对配合产物进行红外分析,确定其为目标产物.
2 结果与分析
2.1 配合物的最佳合成工艺的确定
2.1.1 温度对配合反应的影响
调节溶液pH值至9.0,控制反应时间65 min,变化配合的温度,结果见图1.

图1 温度对配合反应的影响
如图1所示,当反应温度小于等于60℃时,配合程度随温度的升高而加大,大于60℃时,配合程度随温度的升高而减小.可能是温度小于60℃时,适合化学反应正向进行,反应速率逐渐上升:当温度大于60℃时,此温度条件下不适合反应的进行,速率有所下降.
2.1.2 反应时间对配合反应的影响
调节溶液 pH值至9.0,控制反应温度为60℃,变化配合反应的时间,结果见图2.
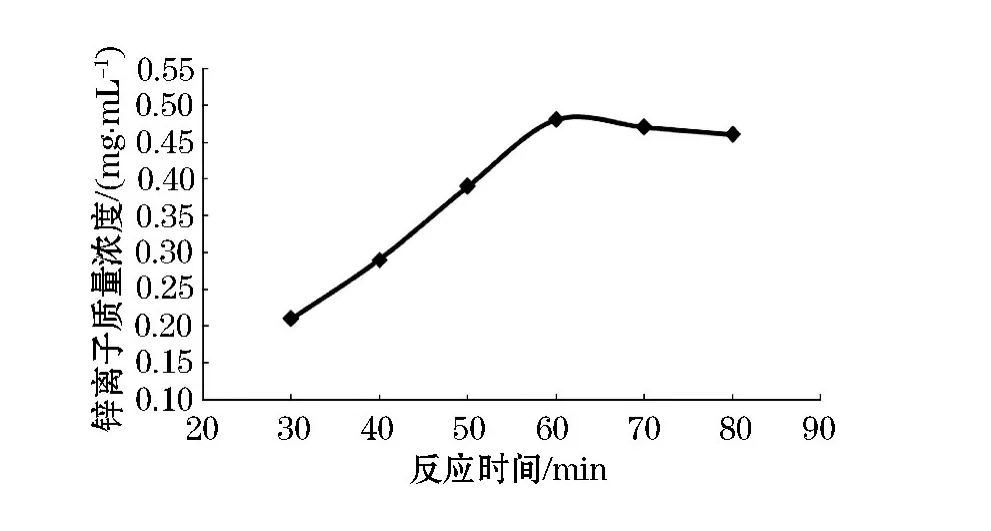
图2 反应时间对配合反应的影响
由图2可知,配合物产率在60 min时达到最高.在60 min之前产率增长幅度较快,而后随反应时间延长,产率逐渐趋于平稳,可能是发生了平衡移动.
2.1.3 pH值对配合反应的影响
调节不同pH值系列溶液,控制反应温度60℃,反应60 min,结果见图3.

图3 pH值对配合反应的影响
由图3可知,随着pH值的增大,复合多糖-锌(Ⅱ)配合物的产率也随之逐渐增大,并在pH值为9时达到最高.但当pH值再增大时产物颜色变成浅棕色,当pH值达到13时,颜色更加深,有副反应发生.其主要原因可能是在强碱环境下金属锌离子与氢氧根发生沉淀反应,影响了锌离子与复合多糖的配合.
2.1.4 配合物的最佳合成工艺正交试验
在单因素试验的基础上,以配合物吸光度为指标,以反应pH值、反应时间、反应温度为考察因素.采用L9(34)表进行正交试验,优化合成最佳条件.对试验结果进行方差分析.见表1~3.

表1 配合物的最佳合成工艺正交试验因素与水平

表2 配合物的最佳合成工艺正交试验设计及结果
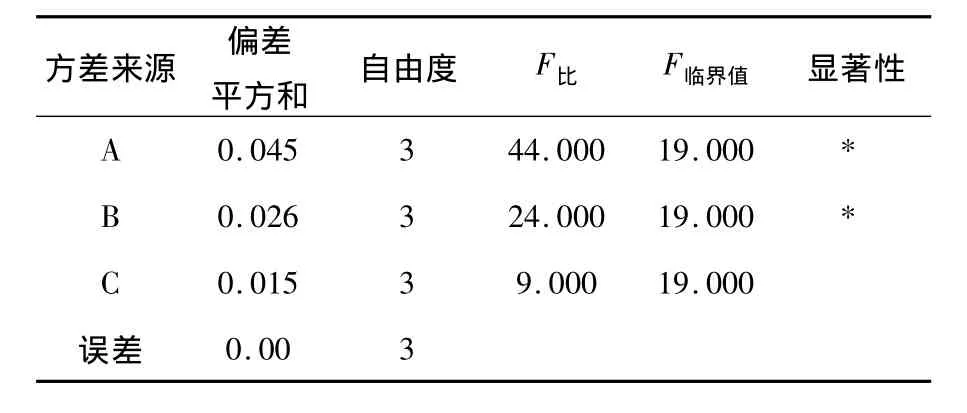
表3 正交试验方差分析表
在单因素试验的基础上,确定以配合反应pH值、反应温度、反应时间3个因素,选用L9(34)正交表进行正交试验,结果如表2所示.由表2可知,复合多糖-锌(Ⅱ)的最佳合成工艺为配合反应pH=9.0、配合反应时间60 min、配合反应温度60℃.各种因素对配合反应效果影响的主次顺序依次为反应pH值>反应温度>反应时间.通过方差分析(表3)可知,反应pH值、反应温度这两种因素对复合多糖-锌(Ⅱ)的合成影响均达显著水平(P<0.05),反应时间不显著.
2.2 香菇中复合多糖的分子质量标准曲线的确定
由分离得到的各色谱峰的保留时间,经校准后建立分子质量对数值与保留时间的标准曲线,结果如图4所示.

图4 分子质量对数与保留时间的曲线
由图4可知,分子质量在 1.26×104~9.11×104g/moL范围内有较好的线性关系,合复合多糖的高压液相色谱图,结复合多糖的重均分子质量为3.35 ×104g/moL.
2.3 配合物最大吸收波长的确定
分别将醋酸锌溶液和配合反应产物溶液在可见-外光区(190~500 nm)扫描测定,结果见图5~7.

图5 复合多糖紫外分析图谱

图6 醋酸锌紫外分析图谱

图7 复合多糖与锌配合产物的紫外分析图谱
由图可知,可在224 nm下进行测定.
2.4 配合物配合比的测定
由图8可以看出,当物质的量比为1∶1时,体系吸光度最大,由于吸光值大小与反应体系配合比成正相关,因此1∶1为配合反应最佳反应物质的量比.

图8 复合多糖-锌(Ⅱ)配合比的确定
2.5 配合产物的表征
用KBr压片法测定复合多糖、复合多糖-锌(Ⅱ)在4 000 ~450 cm-1的红外光谱见图9、10.

图9 复合多糖的红外光谱图

图10 复合多糖-锌(Ⅱ)红外光谱图
复合多糖与锌离子形成配合物后,它的一些主要吸收峰发生了明显位移,证实二价锌离子与复合多糖发生了配位作用.在复合多糖的红外光谱图中3 434.91cm-1的宽缔合峰是羟基的强的伸缩振动峰吸收峰.复合多糖2 925.44cm-1特征峰是醛基中的碳氢反对称伸缩振动吸收产生的峰,在配合物的红外光谱图中完全消失,说明醛基中的羰基参与锌的配合反应.复合多糖图谱中1 633.16cm-1由羰基(—C=O)的伸缩振动引起的特征吸收峰.当复合多糖与锌配合后,螯合物的红外光谱显示,增加了1151.31cm-1和1 105cm-1两个吸收峰,此为吡喃糖苷的吸收峰.同时,羰基的特征吸收移至1 630.27cm-1处.这是由于复合多糖的羟基和羟基氧参与配位形成螯合物的结果.由配合比结合红外图谱可得配合物可能的结构图,见图11.

图11 复合多糖-锌(Ⅱ)可能的结构式
3 结语
本实验研究复合多糖与锌离子配合的最佳反应条件,并通过红外光谱对合成产物进行了初步的表征.得到最佳反应条件为pH=9.0、反应温度60℃、反应时间60 min,通过等摩尔连续变化法测得产物配合比为1∶1.
[1]李红卫,周国燕,郭慧青,等.从香菇中浸提香菇多糖的方法对比研究[J].食品科学,2008,29(11):173-174.
[2]陆 娟,彭 浩,陈俊峰,等.香菇多糖微波辅助提取及体外免疫学活性研究[J].生物学杂志,2011,3(28):50-52.
[3]吕国英,范雷法,张作法,等.香菇多糖研究进展[J].浙江农业学报,2009,2(21):183-187.
[4]李小宇,王振宇,王 璐.食用菌多糖的分离、结构及其生物活性的研究进展[J].中国农业学报,2012,28(12):236-240
[5]王丽威,郭旭颖,陈梁成,等.水浴法和微波法提取金针菇下脚料多糖的优化及比较研究[J].食品工业科技,2012,33(8):323-325.
[6]金 茜,朱 琳,罗宿星,等.食用菌多糖生物活性研究进展[J].遵义师范学院学报,2010,4(12):75-76.
[7]王国佳,曹 红.香菇多糖的研究进展[J].解放军药学学报,2010,27(5):451-454.
[8]徐翠莲,杜林洳,樊素芳,等.多糖的提取分离纯化及分析鉴定方法研究[J].河南科学,2009,27(12):1524-1525.
[9]杨 勇,钱运华,贾建波.活性炭/凹土吸附剂香菇多糖提取液脱色研究[J].安徽农业科学,2011,39(35):21959-21601.
[10]石倩茹,陈盼盼,田国政,等.SephadexG-200分离纯化薇菜可溶性多糖的工艺优化[J].现代园艺,2011(15):8.
[11]张 玲,郝艳梅,张世益.微量元素硒锌与人体健康的研究进展[J].中国保健营养,2013,03(上):1557.
[12]PRASAD A S.Zinc in human health:effect of zinc on immune Cells[J].MolMed,2008,14(5 -6):353 -357.
[13]何瑞雪,文宏思明.水溶性大豆多糖-铁配合物的制备及理化性质的研究[J].食品工业科技,2012,2(33):326-327.
[14]BONG C S,KYUNGMOON P,SEUNG H S,et al.Selective Biosorption of Mixed Heavy Metal Ions using polysaccharides[J].KereanJ.Chem.Eng,2004,21(6):1168 -1172.
[15]WAN NGAH W S,TEONGA L C,HANAFIAH M.Adsorption of dyes and heavy metalions by chitosan composites:A review[J].Carbohydrate Polymers,2011(83):1446 -1456.
[16]WU B D,WANG Q D,LIU Q.Capillary electrophoresis direct enantioseparation of aromatic amino acids based on mixed chelateinclusion complexation ofaminoethylamino cyclodextrin[J].Electrophoresis,2005,26(4/5):1013 -1017.
[17]甘宾宾.食品中糖类的高效液相色谱法测定[J].分析仪器,2000(3):38-42.
[18]徐新荣,于海涛,杭 丽,等.柚皮素铜、锌配合物的制备及其对大鼠实验性脉络膜新生血管的抑制作用[J].南京中医药大学学报,2013,29(6):545-546.
[19]石帮辉.双硫腙分光光度法测定水中微量锌[J].华南预防医学,2004,130(5):56-57.
