吸烟对雄性小鼠睾丸间质细胞、睾酮及精子数量的影响
2015-08-04李亮亮于德新谢栋栋涛陈张志强丁德茂慈安徽医科大学第二附属医院泌尿外科合肥230601
李亮亮 于德新谢栋栋 王 毅 张 涛陈 磊 张志强 丁德茂 闵 捷 邹 慈安徽医科大学第二附属医院泌尿外科(合肥 230601)
吸烟对雄性小鼠睾丸间质细胞、睾酮及精子数量的影响
李亮亮 于德新*谢栋栋 王 毅 张 涛陈 磊 张志强 丁德茂 闵 捷 邹 慈
安徽医科大学第二附属医院泌尿外科(合肥 230601)
摘要目的 探讨吸烟对雄性小鼠的睾丸间质细胞、血清睾酮含量及附睾精子数量的影响。方法 雄性小鼠50只,随机分为5组,即经吸烟处理后6周、12周(吸烟组),未经特殊处理的6周、12周小鼠(对照组),及吸烟6周后戒烟6周(戒烟组)小鼠。对5组小鼠睾丸组织进行HE染色,光镜下观察支持细胞、间质细胞形态及结构;免疫组化方法分别计数5组小鼠睾丸支持细胞及间质细胞数量;利用酶联免疫法(ELISA)测定小鼠体内睾酮含量;用石墨炉原子吸收光谱法测定血清镉含量;同时计数附睾精子数。结果 HE染色可见吸烟6周小鼠睾丸间质细胞数量减少;吸烟12周小鼠睾丸间质细胞数量稀少甚至消失;而睾丸支持细胞数量及形态与对照组相比未见明显改变。免疫组化发现吸烟组小鼠睾丸支持细胞数量与对照组相比无显著差异(P>0.05)。间质细胞数量随吸烟时间延长而显著减少(P<0.01);小鼠血清中睾酮水平吸烟组明显低于对照组(P<0.01),且随吸烟时间的延长而下降(P<0.01);吸烟组小鼠附睾精子计数较对照组显著下降(P<0.01),并且与吸烟时间呈正相关(P<0.01)。而戒烟组中,睾丸间质细胞、血清睾酮含量、附睾精子数量3组数据都较吸烟组增高。结论 吸烟可导致睾丸间质细胞的破坏,影响体内睾酮的生成,进而导致生精障碍,而戒烟可逆转此现象。
关键词吸烟; 莱迪希细胞; 精子; 睾酮
吸烟及其对健康的危害性已经成为一个严重的社会问题。烟草成分复杂,其烟雾中有多达3 000余种已被确定为有毒物质,包括多环芳香族化合物、芳香胺等,烟雾中含有的一氧化碳、尼古丁、焦油等通过呼吸道进入体内可造成人体多系统的损害。另外镉、氰、铅、锂等相关的有毒元素,对人体的健康均产生不可逆的影响。目前相关研究已经证明吸烟是引发癌症、高血压、冠心病、脑中风、肺气肿等疾病的重要因素。除此之外,吸烟对男性生殖功能的影响及危害也被广泛研究,但吸烟对男性生殖影响的机制还不十分清楚。本研究以经吸烟处理的雄性小鼠为实验对象,就吸烟对小鼠睾丸间质细胞、睾酮水平及精子数量的影响进行探讨。
材料与方法
一、实验动物
雄性BALB/c小鼠50只(购自南京医科大学动物实验中心),体质量18~22g,鼠龄6~8周,随机分组:(1)为吸烟6周组、(2)吸烟12周组,这两组为吸烟组,是在在28升的塑料盒中,通过文丘里阀连接一支点燃的香烟,将吸入的烟雾与旋片式真空隔膜泵抽入的空气混合,进行烟雾暴露(盒内的总悬浮颗粒物浓度为80mg/m3),每天暴露6h,分别持续6周和12周;(3)为对照6周组、(4)对照12周组,这两组为对照组,未经特殊处理,与吸烟组饲养条件相同,分别暴露于过滤后的空气中6周和12周;(5)为吸烟组:经吸烟6周处理后,继续予普通喂养6周。
二、主要仪器及试剂
光学显微镜NIKON(日本);血细胞计数器;酶联免疫试剂盒(购自北京北方生物技术研究所);β-HSD多克隆抗体(购自北京博奥森生物工程有限公司);SOX9多克隆抗体(购自Abcam公司)。
三、动物处理
用颈椎脱臼法处死小鼠,直视下进行心脏采血mL,4℃下2 150×g,离心15min,分离血清置于1.0mlEP管中-20℃保存。同时剪开腹腔,分离并摘取睾丸和附睾,用微量电子天平分别称量睾丸并记录,一侧睾丸置于中性福尔马林液中固定,石蜡包埋,制成6μm连续切片;另一侧睾丸保存于-80℃冰箱中备用。
四、睾丸组织病理学检查
石蜡切片经二甲苯、梯度酒精脱蜡后,苏木精染色5min,再经盐酸酒精分化,自来水浸泡后,伊红染色2min,再脱水,透明及中性树脂封片,观察睾丸形态结构的变化。
五、免疫组化染色
石蜡切片经二甲苯及梯度酒精脱蜡,蒸馏水洗3 次, 置PBS中10min,放入柠檬酸修复液中96℃10min,冷却至室温后用TBS、TBST各洗5min,3%双氧水处理10min,TBS中洗3次,滴加BDT(3%BSA和10%驴血清溶于TBS)40μL,封口膜封闭30min,甩去多余液体不洗,加稀释的一抗(1:100)4℃过夜,TBS 洗3次,每次10min,滴加过氧化物酶偶联的的二抗20μL(兔,鼠双标)室温15min,TBS 洗3 次, 每次10min,滴加DAB显色,PBS中泡洗2min两次,苏木精复染,梯度酒精脱水,二甲苯泡洗20min后,中性树脂封片。
六、血清睾酮(T)测定
采用酶联免疫法检测小鼠血清中睾酮含量,将小鼠处死后心脏所采血静置30min,待血浆凝固后离心15min分离血清保存,按照酶联免疫试剂盒内说明书进行操作,测得血清睾酮含量。
七、血清镉(CdCd)含量测定
小鼠眼血于室温下放置 2.5h,以 2 150×g的转速离心 15min,取上层血清置于1.5mL离心管中,于-80℃冰箱保存。测量前用 1%硝酸稀释,同时以1%硝酸作为试剂空白。利用石墨炉原子吸收分光光度计,采用两步干燥、斜坡升温方式测定小鼠血清镉含量。
八、附睾精子计数
将摘取的双侧附睾立即放入盛有PBS的培养皿中,用眼科剪将附睾剪成一块(1mm),转移至含有1mL平衡液的离心管中,37℃孵育30min后,静置制得精子悬液,利用血细胞计数器计数。
结 果
一、HEHE染色结果
光镜下观察HE染色切片,对照组睾丸间质细胞在生精小管间集落聚集,呈菱形或三角形,细胞较大且胞浆丰富;细胞核呈圆形或卵圆形,核内染色质呈均匀分布。吸烟6周的小鼠睾丸组织中,睾丸间质仍呈簇分布,细胞数目较对照组减少,细胞多呈圆形或卵圆形且较正常组缩小,胞浆减少。吸烟12周小鼠睾丸组织中,睾丸间质细胞数目明显减少甚至消失,胞质浓缩,细胞核皱缩。而附着于生精小管基膜上的睾丸支持细胞的数量及形态在对照组与实验组未见明显差异,见图1。
二、免疫组化结果
光镜下观察免疫组化切片,可以发现吸烟组中被SOX9标记的睾丸支持细胞数量与对照组及戒烟组相比无明显差异。而吸烟组被3β-HSD抗体标记的睾丸间质细胞数量较对照组减少,吸烟12周组减少显著;戒烟组的睾丸间质细胞数量较吸烟组增加。400倍光镜下,每张切片随机选择5个不同视野,采用双盲法计数睾丸支持细胞及间质细胞,结果见图2和图3。
如表1所示,吸烟6周、12周小鼠睾丸支持细胞数量与对照组小鼠相比P>0.05,吸烟12周小鼠睾丸支持细胞数量与吸烟6周小鼠相比P>0.05; 吸烟6周、12周小鼠睾丸间质细胞数量与对照组小鼠相比P<0.01;吸烟12周小鼠睾丸间质细胞数量与吸烟6周小鼠相比P<0.01。戒烟6周小鼠睾丸支持细胞数量与吸烟6周及12周小鼠相比P>0.05;戒烟6周小鼠睾丸间质细胞数量与吸烟6周及12周小鼠相比P<0.01。
三、吸烟对小鼠体内睾酮水平的影响
如表2所示,吸烟6周、12周小鼠与对照组小鼠相比P<0.01;吸烟12周小鼠与吸烟6周小鼠相比P<0.01;戒烟6周小鼠与吸烟6周小鼠相比P>0.05;戒烟6周小鼠与吸烟12周小鼠相比P<0.01。
四、吸烟对小鼠体内镉含量的影响
如表3所示,吸烟6周、12周小鼠与对照组小鼠相比P<0.01;吸烟12周小鼠与吸烟6周小鼠相比P<0.01。

图1 吸烟对小鼠睾丸组织学的影响

图2 吸烟对小鼠睾丸支持细胞的影响

图3 吸烟对小鼠睾丸间质细胞的影响

表1 吸烟对小鼠睾丸支持细胞及间质细胞的影响(x±sxs)

表2 吸烟对小鼠体内睾酮水平的影响(x±sxs)

表3 吸烟对小鼠体内镉含量的影响(x±sxs)
五、吸烟对小鼠精子数量的影响
如表4所示,吸烟6周、12周小鼠与对照组小鼠相比P<0.01;吸烟12周小鼠与吸烟6周小鼠相比P<0.01;戒烟6周小鼠与吸烟6周小鼠相比P>0.05,与吸烟12周小鼠相比P<0.01。
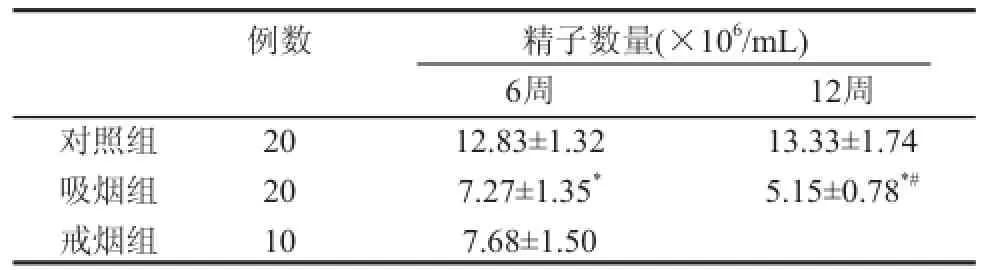
表4 吸烟对小鼠附睾内精子数量的影响(xx±ss)
讨 论
近年来,全球不育的发病率明显升高。世界卫生组织认为,不孕不育症将成为21世纪仅次于肿瘤和心血管疾病的第三大疾病。据调查研究报告,全世界约有12%~20%的已婚夫妇面临不孕不育的困扰,其中男性因素约占50%。我国男性不育患者高达5000万人。引起男性不育的病因主要有性功能障碍、精索静脉曲张、生殖道感染、免疫性因素、先天性发育异常及后天性疾病等,但是仍有高达60%~75%的患者找不到具体原因,称为特发性男性不育。其中,吸烟作为引起男性不育的一个重要因素,近年来越来越被国内外所重视。
睾丸是男性生殖器官中产生精子的唯一场所,成年雄性动物体内的生精过程是睾丸中间质细胞、支持细胞与生精细胞共同作用的结果,因此3种细胞中任一种细胞的过度破坏都将导致生精障碍。
睾丸间质细胞是成年雄性动物体内产生睾酮的主要场所[1]。间质细胞对机体的影响主要通过其分泌的睾酮来实现, 因此血清中睾酮水平的高低也可以间接反映间质细胞的功能。成年雄性哺乳动物体内睾酮可维持生精作用,促进精子的发生和成熟。吸烟对睾酮的影响已有研究[2, 3]。本实验中吸烟组小鼠的体内睾酮水平较对照组小鼠明显下降,而血清中镉的水平却较对照组明显升高,这说明烟雾中镉在体内的蓄积可能与睾酮水平的下降有直接关系。已有报道称镉在血液中的累积,会导致睾丸间质细胞形态及结构的改变,进而影响睾酮的生成[4];另外,血清睾酮主要在间质细胞内质网和线粒体上合成,内质网上的4种主要参与睾酮合成的酶是胆固醇侧链裂解酶(P450 SCC),3β-羟基类固醇脱氢酶(3β-HSD),细胞色素P450α17羟化酶/C17-20-裂合酶和17β-羟基类固醇脱氢酶(17β-HSD)。有研究表明,镉在机体内的蓄积会破坏上述酶的结构与功能,导致睾酮合成的减少[5]。
机体内睾酮水平除了与单个睾丸间质细胞合成、分泌睾酮的能力相关外, 还取决于睾丸内间质细胞的数量。3β-HSD作为睾酮合成过程中的关键酶,被广泛应用在间质细胞纯度分析及定性定量上[6, 7]。本实验中,通过对吸烟组及对照组小鼠睾丸组织的HE染色观察,发现随着吸烟时间的延长,间质细胞数量明显减少甚至消失,同时发生变性改变。采用双人盲法计数睾丸间质细胞[8]也发现,随着小鼠被动吸烟时间的延长,睾丸间质细胞的数量也明显减少。但是对于戒烟6周后的小鼠睾丸组织观察却发现,睾丸间质细胞的数量较吸烟组出现可逆性变化。
目前吸烟影响精子质量的确切机制仍不清楚,但睾酮分泌的减少对生精的影响有诸多报道。Kerr 等[9]通过人工撤退睾酮的方法发现,睾酮的持续缺乏会导致睾丸中生精小管生精过程的障碍。Lee等发现成年大鼠睾丸中曲细精管内液的分泌不受FSH影响,而直接受睾酮的调控,而内液在维持生精小管微环境以及输送营养物质到各级生精细胞上均发挥着重要作用,因此睾酮分泌的减少会导致内液分泌障碍,进而引起生精障碍。本研究通过对吸烟组与对照组小鼠附睾中精子计数也发现,吸烟组中成年小鼠精子较对照组明显减少,并且随着吸烟时间的延迟,精子数量也呈明显的下降趋势,这可能与前述的吸烟引起的血清睾酮的降低,进而导致小鼠的生精障碍有关。
睾丸支持细胞的主要作用是为精子的发生提供物理支撑和稳定的微环境,并促进其运送,还为它的营养和发育提供所需的细胞因子,不但在向生精上皮传递促性腺激素的过程中发挥着中枢作用,而且具有支持、营养、吞噬、释放、分泌等多种功能[10]。本实验中通过对小鼠睾丸HE染色及免疫组化研究发现,吸烟组小鼠睾丸支持细胞在数量及形态上与对照组相比无明显差异。这可能与相邻支持细胞的的紧密连接结构及支持细胞具有的免疫豁免作用有关。
目前,吸烟对雄性生殖系统的影响国内外的研究已经比较广泛,但结论却不尽相同[11, 12]。吸烟是成瘾性过程,长时间吸烟导致的毒素在机体内累积是其致病性的关键。但本实验中对戒烟6周后的小鼠睾丸间质细胞数量、血清睾酮水平及附睾精子计数的研究发现,戒烟6周组小鼠较吸烟12周组都显著升高,说明吸烟对睾丸的生殖毒性具有可逆性。
由于人体与小鼠组织代谢的相似性,本研究中通过建立长达12周的小鼠被动吸烟模型,达到更加接近于成人的实际抽烟时间,因此实验结果更具可信性,这也是与Ahmadnia等[13]研究结果有所差别的原因之一。另外本研究通过对睾丸间质细胞及支持细胞的免疫组化半定量分析,发现了吸烟可能作用的靶细胞为间质细胞,这为下一步研究吸烟对睾丸细胞中相关酶及蛋白表达的影响指明了方向,同时为研究吸烟引起的男性不育的针对性干扰治疗奠定了基础。此外戒烟对雄性小鼠生殖功能的恢复也在本实验中得到了证实,因此男性吸烟的戒断在治疗男性不育方面的作用也具有十分重要的意义。
参 考 文 献
1 Chen H, Ge RS, Zirkin BR. Leydig cells: From sterm cells to aging. Mol Cell Endocrinol 2009; 306(1-2): 9-16
2 王淑玲, 宗全和. 吸烟对雄性小鼠生殖内分泌系统的影响.郑州大学学报•医学版 2002; 37(2): 164-167
3 魏莎莉, 周生健, 王瑶, 等. 吸烟对男性精液参数、精子功能及睾酮影响的研究. 中国男科学杂志 2000; 14(4): 237-239
4 de souza predes F, Monteiro JC, Matta SL, et al. Testicular histomorphometry and ultrastructure of rats treated with cadmium and ginkgo biloba. Biol Trace Elem Res 2011; 140(3): 330-341
5 Ji YL, Wang H, Liu P, et al. Pubertal cadmium exposure impairs testicular development and spermatogenesis via disrupting testicular testosterone synthesis in adult mice. Reprod Toxicol 2010; 29(2): 176-183
6 刘建中, 郭海彬, 邓春华, 等. 大鼠睾丸leydig细胞的培养和鉴定. 中华男科学杂志 2006; 12(1): 14-17
7 van den Driesche S, Walker M, McKinnell C, et al. Proposed role for COUP-TFII in regulating fetal leydig cell steroidogenesis, perturbation of which leads to masculinization disorders in rodents. Plos One 2012; 7(5): e37064
8 Mahood IK, Scott HM, Brown R, et al. In utero exposure to di(n-butyl) phthalate and testicular dysgenesis: comparison of fetal and adult end points and their dose sensitivity. Environ Health Perspect 2007; 115 Suppl 1: 55-61
9 Kerr JB, Millar M, Maddocks S, et al. Stage-Dependent changes in spermatogenesis and sertoli cells in relation to the onset of spermatogenic failure following withdrawal of testosterone. Int J Androl 1993; 235(4): 547-559
10 Lee NP, Cheng CY. Adaptors, Junction dynamics, and spermatogenesis. Biol Reprod 2004; 71(2): 392-404
11 Güven MC, Can B, Ergün A, et al. Ultrastructural effects of cigarette smoke on rat testis. Eur Urol 1999; 36(6): 645-649
12 Trummer H, Habermann H, Haas J, et al. The impact of cigarette smoking on human semen parameters and hormones. Hum Reprod 2002;17(6):1554-1559
13 Ahmadnia H, Ghanbari M, Moradi MR, et al. Effect of cigarette smoke on spermatogenesis in rats. Urol J 2007; 4(3): 159-163
(2014-11-30收稿)
doi:10.3969/j.issn.1008-0848.2015.03.005
中图分类号R 698.2
*通讯作者, E-mail: yudx_urology@yahoo.com.cn
Effects of smoking on leydig cells, testosterone levels and sperm counts of male mice
Li Liangliang,Yu Dexin*,Xie Dongdong,Wang Yi, Zhang Tao,
Chen Lei, Zhang Zhiqiang, Ding Demao, Min Jie, Zou Ci
Department of Urology,Second Affi liated Hospital of Anhui Medical University,Hefei 230601,China Corresponding author:Yu Dexin, E-mail: yudx_urology@yahoo.com.cn
AbstractObjective To investigate effects of smoking on leydig cells,testosterone levels and sperm counts of male mice. Methodsthods Fifty male mice were divided randomly into fi ve groups including Group1 and Group2 ( mice were treated with cigarette smoking concentration for 6 weeks, 12 weeks), Group3 and Group4( mice with no special treatment), and Group5 (mice treated with cigarette smoking concentration for 6 weeks and then with no smoking concention for 6 weeks). Testis tissues of mice in five groups were stained with HE staining. The morphologic and structural changes in leydig cells and sertoli cells were observed under lightmicroscopy. The numbers of leydig cells and sertoli cells were counted by immunohistochemistry analysis. The content of testosterone in mice was measured by enzyme-linked immunosorbent assay. The level of serum cadmium was detected by graphite furnace atomic absorption spectrometry, and the number of epididymal sperms was counted. Resultssults Histochemistry analysis showed that the number of leydig cells decreased obviously in mice testis with 6 weeks smoking, and even disappeared in mice testis scarce with 12 weeks smoking 12. Whereas the number and form of the sertoli cells had no obvious changes as compared with that of the control groups.Immunohistochemistry analysis showed that the number of sertoli cells in the smoking groups compared with that of the control groups had no obvious difference(P>0.05). Along with the extension of smoking time, the number of the leydig cells progressivelly decreased(P<0.01).The level of serum testosterone in the smoking groups was sinifi cantly lower than that in the control groups(P<0.01). In addition, it was postively correlated with the smoking time. But three sets of date in the smoking-quited group were higher than that in the smoking groups. Conclusionusion Smoking may lead to the destruction of the leydig cells, and infl uence the product of testosterone, and further resulting in spermatogenic obstacles. While quited smoking may reverse the phenomenon.
Key wordsords smoking; leydig cells; spermatozoa; testosterone
