高效液相色谱-紫外检测法同时测定食品接触材料中7种苯多酸及其衍生物的特定总迁移量
2015-08-03王建玲肖晓峰刘艇飞邓弘毅杨娟娟
王建玲, 肖晓峰, 陈 彤, 刘艇飞, 何 军, 邓弘毅, 杨娟娟
(台州出入境检验检疫局,浙江 台州318000)
苯多酸中的对苯二甲酸属于低毒类化合物,与邻苯二甲酸、间苯二甲酸和偏苯三甲酸等苯多酸类似,对眼睛、皮肤、黏膜和上呼吸道有刺激作用。苯多酸可作为单体或功能助剂,广泛应用于聚酯树脂、不饱和聚酯树脂等塑料的生产中[1,2]。一些食品接触材料制品中残留或降解出来的苯多酸[3,4]在使用过程中会迁移到食物中,直接危害人体健康。欧盟在2011年发布的(EU)No 10/2011 法规[5]将 7 种苯多酸及其衍生物的特定总迁移量(total specific migration limit,SML(T))限定为 5 ~7.5 mg/kg(见表1)。

表1 苯多酸及其衍生物的名称、缩写、CAS号、相对分子质量和特定总迁移量限值Table 1 Chemical names,abbreviations,CAS Nos.,relative molecular masses and total specific migration limits(SML(T))for benzene polycarbonic acids and their derivatives
目前,国内外有关苯多酸的检测主要集中在塑料[3]、化学试剂[6]、空气[7]、雪[8]、尿液[9]以及食品模拟物[10-12]等样品中。主要使用的检测方法有气相色谱-质谱法(GC-MS)[3]、气相色谱法(GC)[8]和高效液相色谱法(HPLC)[6,7,10-13]。已有的检测标准和文献[10-12]仅能检测食品模拟物中对苯二甲酸的迁移量,无法对欧盟(EU)No 10/2011法规中苯多酸的特定总迁移量进行检测。
本研究旨在建立采用高效液相色谱-紫外检测(HPLC-UV)同时测定食品模拟物(10% (v/v)乙醇、20% (v/v)乙醇、50% (v/v)乙醇、3% (w/v)乙酸和橄榄油)中偏苯三甲酸、偏苯三甲酸酐、间苯二甲酰氯、间苯二甲酸、对苯二甲酰氯、邻苯二甲酸、对苯二甲酸的特定总迁移量(SML(T))的方法。考虑到偏苯三甲酸酐、间苯二甲酰氯、对苯二甲酰氯的化学性质活泼,极易与水反应生成对应的苯多酸,参考国内外类似标准[14,15],这3种物质相关的特定总迁移量只需检测其对应的苯多酸。该方法色谱分离和线性关系较好,回收率和准确度高,完全满足欧盟(EU)No 10/2011法规附表2中7种苯多酸及其衍生物的SML(T)的限量要求。并已成功应用于食品接触材料相关制品中苯多酸及其衍生物的特定迁移量的检测。
1 实验部分
1.1 仪器、材料与试剂
Agilent 1290高效液相色谱仪及二极管阵列检测器(安捷伦公司);Synergi Polar-RP色谱柱(250 mm×4.6 mm,4 μm,美国菲罗门公司);MMV-1000W分液漏斗振荡器(日本EYELA公司);Milli-Q Gradient纯水仪(Millipore公司);亲水性聚四氟乙烯、尼龙、聚醚砜针头过滤器均购于杭州格陵科学仪器有限公司;邻苯二甲酸、间苯二甲酸、对苯二甲酸和偏苯三甲酸标准品(纯度>99%,见表1)购于百灵威公司;甲醇、异丙醇为色谱纯(Merck公司);其他试剂均为分析纯。
混合标准中间储备液的配制:分别准确称取25.0 mg邻苯二甲酸、间苯二甲酸、对苯二甲酸和偏苯三甲酸标准品于150 mL烧杯中,加入50 mL异丙醇,水浴加热至60℃使其充分溶解,待溶液冷却后转移至100 mL容量瓶中,用异丙醇定容,配成250 mg/L的4种苯多酸混合标准储备液。分别精密吸取上述混合标准储备液 0.2、0.4、0.8、1.6、3.2、4.8 mL至6个10 mL容量瓶中,用异丙醇定容得质量浓度分别为5.00、10.0、20.0、40.0、80.0、120 mg/L的混合标准中间储备液。
水基食品模拟物标准溶液的配制:分别移取1 mL混合标准中间储备液至6个10 mL容量瓶中,用食品模拟物(10% (v/v)乙醇、20% (v/v)乙醇、50% (v/v)乙醇或3% (w/v)乙酸水溶液)定容至刻度,混匀。橄榄油食品模拟物标准工作溶液的制备:分别称取橄榄油模拟物10 g(精确至0.1 g),置于6个50 mL具塞塑料离心试管中,分别加入10 mL正庚烷和1 mL混合标准中间储备液,混匀后再加入4.00 mL 0.1% (w/v)乙酸铵水溶液,旋紧塞子,300 r/min下振荡20 min,再静置15 min,用2 mL注射器吸取下层水溶液约2 mL,过0.45 μm聚四氟乙烯针头过滤器至预先装有5 μL磷酸的2 mL样瓶中,盖紧盖子,涡旋混匀。
1.2 迁移试验
根据待测样品的预期用途及使用条件,参照欧洲标准[16]和(EU)No 10/2011 法规选择合适的迁移试验条件。分别用 10% (v/v)的乙醇(A)、3%(w/v)乙酸(B)、20% (v/v)乙醇(C)、50% (v/v)乙醇(D1)和橄榄油(D2)浸泡样品。对可能较长时间与食品高温接触的尼龙铲样品,在100℃浸泡2 h;其他室温下与食品长时间接触的聚乙烯塑料袋、聚乙烯保鲜膜、聚丙烯盒、聚对苯二甲酸乙二醇瓶、聚对苯二甲酸乙二醇盒等样品,在40℃浸泡10天。
1.3 样品前处理
用食品模拟物浸泡待测样品,冷却至室温并混匀。水基食品模拟物:用注射器取水基食品模拟物1~2 mL,经亲水性聚四氟乙酸针头过滤器过滤至进样瓶中,待测。橄榄油食品模拟物:称取橄榄油模拟物10 g(精确至0.1 g)于50 mL具塞塑料离心试管中,分别加入10.0 mL正庚烷和1.00 mL异丙醇,混匀后再加入4.00 mL 0.1%(w/v)乙酸铵水溶液,旋紧塞子,置于分液漏斗振荡器上300 r/min下振荡20 min,再静置15 min,用2 mL注射器吸取下层水溶液约2 mL,过0.45 μm 聚四氟乙烯针头过滤器至预先装有5 μL磷酸的样品瓶中,盖紧盖子,混匀后上样。
1.4 色谱条件
色谱柱:Phenomenex Synergi Polar-RP柱(250 mm ×4.6 mm,4 μm)。流动相 A 为 20 mmol/L磷酸二氢钾水溶液,用磷酸调pH至3.4,过0.22 μm滤膜待用;流动相B为体积比1∶1的异丙醇-甲醇溶液。梯度洗脱程序:0~0.5 min,2%B;0.5~28 min,2%B~32%B;28~29 min,32%B;29.0~29.5 min,32%B ~2%B;柱后运行 4 min。柱温箱温度 40℃;进样量 10 μL;流速 1 mL/min;检测波长232 nm。
2 结果与讨论
2.1 偏苯三甲酸酐、间苯二甲酰氯、对苯二甲酰氯的处理
(EU)No 10/2011 法规[5]附表2 对7 种苯多酸及其衍生物的特定总迁移量进行了限定,除BTCA、TPA、PA、IPA 4种苯多酸外,还包括一种水解活性很强的酸酐(偏苯三甲酸酐)和两种比酸酐类水解活性更强的酰氯类物质(间苯二甲酰氯、对苯二甲酰氯)。由于水基食品模拟物中主要成分是水,迁移到水基食品模拟物中的偏苯三甲酸酐、间苯二甲酰氯、对苯二甲酰氯会立即水解成对应的偏苯三甲酸、间苯二甲酸和对苯二甲酸;迁移到油性食品模拟物中的偏苯三甲酸酐、间苯二甲酰氯、对苯二甲酰氯也可以添加水溶液,使它们也水解成对应的偏苯三甲酸、间苯二甲酸和对苯二甲酸,并提取出来。故7种苯多酸及其衍生物特定总迁移量的检测只需要检测对应的4种苯多酸。已有的标准[14,15]也使用了相同的处理方法,比如食品模拟物中顺丁烯二酸和顺丁烯二酸酐的检测,只需检测顺丁烯二酸[14]。
2.2 色谱分离条件的优化
2.2.1 色谱柱的选择
考察了 C8、C18和 Polar-RP柱对 BTCA、PA、TPA和IPA的色谱分离情况。3种色谱柱以20 mmol/L磷酸二氢钾-磷酸水溶液(pH 3.4)和甲醇为流动相,在甲醇比例为40%的条件下等度洗脱苯多酸的色谱图见图1。C8柱分离这4种苯多酸时,PA、TPA和IPA都存在一定的拖尾,其中TPA拖尾较为严重;C18柱分离这4种苯多酸时,4种苯多酸都存在较严重的拖尾;而使用Polar-RP柱能够实现这4种苯多酸的基线分离,且峰形对称,故后续试验采用Polar-RP柱进行试验。
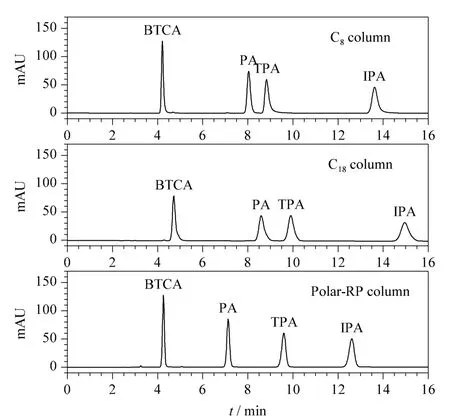
图1 C8柱、C18柱和Polar-RP柱对4种苯多酸混合标准溶液(60 mg/L)的分离色谱图Fig.1 Chromatograms of mixed standard solution of the fourbenzenepolycarbonicacids(60 mg/L)on C8,C18and Polar-RP column
2.2.2 流动相缓冲盐浓度的优化
考察了 5、10、20、50 mmol/L 的磷酸二氢钾-磷酸水溶液(pH 3.4)-甲醇(60∶40,v/v)流动相对BTCA、PA、TPA和IPA色谱分离的影响,Polar-RP柱上分离BTCA、PA、TPA和IPA的色谱图见图2。结果表明,磷酸二氢钾为5或10 mmol/L时,TPA和IPA都存在伸舌现象,磷酸二氢钾浓度升至20或50 mmol/L时,4种苯多酸峰的峰形都变成了标准的高斯峰。另考察了0.05%(w/v)甲酸、0.05%(w/v)乙酸、0.1% (w/v)甲酸、0.1% (w/v)乙酸水溶液对4种苯多酸的分离情况,使用这4种挥发性酸流动相代替20 mmol/L磷酸二氢钾-磷酸水溶液,会导致BTCA峰较严重的拖尾。考虑到过高的缓冲盐浓度可能会对色谱柱不利,故后续试验选用20 mmol/L磷酸二氢钾-磷酸水溶液作流动相对BTCA、PA、TPA和IPA进行色谱分离。
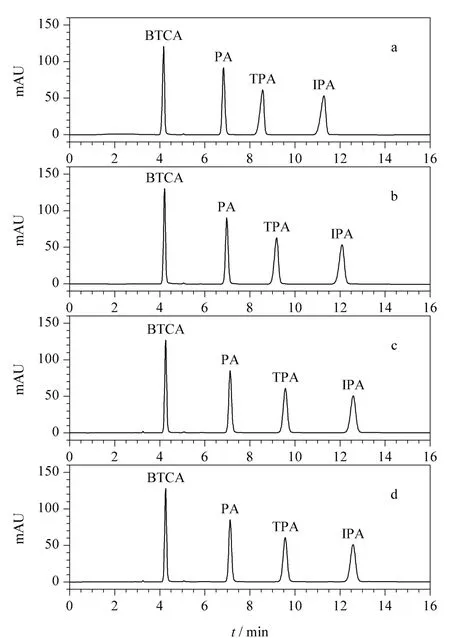
图2 不同流动相添加剂浓度对4种苯多酸混合标准溶液(60 mg/L)色谱分离的影响Fig.2 Effect of the concentration of mobile phase additives on the chromatographic separation of mixed standard solution of the four benzene polycarbonic acids (60 mg/L)
2.2.3 流动相缓冲盐pH的优化
考察了 pH 值分别为 5.0、4.5、4.0、3.5、3.0、2.5的20 mmol/L磷酸二氢钾-磷酸水溶液流动相对BTCA、PA、TPA和IPA色谱分离的影响。Polar-RP柱在甲醇比例为40%时等度洗脱BTCA、PA、TPA和IPA的色谱图见图3。磷酸二氢钾-磷酸水溶液的pH为5.0时,BTCA、PA和TPA的峰未完全分开;pH降至4.5时,TPA峰发生了严重变形;pH降至4.0时,PA和和IPA的色谱峰伸舌严重;pH降至3.5、3.0或2.5时,4种苯多酸达到了基线分离,且峰形都变成了标准的高斯峰。由于过低的pH(pH<2)将接近或超出色谱柱的pH使用范围,故磷酸二氢钾-磷酸水溶液流动相较合适的pH范围为2.5~3.5。

图3 流动相pH对4种苯多酸混合标准溶液(60 mg/L)色谱分离的影响Fig.3 Effect of the mobile phase pH on the chromatographic separation of mixed standard solution of the four benzene polycarbonic acids(60 mg/L)
2.2.4 等度洗脱和梯度洗脱的选择
在优化完色谱柱、流动相缓冲盐的类型、浓度及pH值之后,对于水基食品模拟物,在等度洗脱条件下就能获得满意的色谱分离效果。但在进行橄榄油食品模拟物提取液的色谱分离时,发现等度洗脱时PA与后面的3个干扰峰部分重叠在一起,TPA与前面的干扰峰也难以分开(见图4),特别是在PA和TPA浓度较低时,将会严重影响TPA和PA的准确定量。为了消除橄榄油中的干扰杂质峰对PA和TPA定量的影响,优化了梯度洗脱程序,能够将空白橄榄油提取液中的干扰杂质同4种苯多酸完全分离。在优化好的HPLC-UV仪器条件下,8 mg/kg的4种苯多酸在5种食品模拟物中的分离色谱图如图5所示,BTCA、PA、TPA和IPA 4种苯多酸均达到了基线分离,并消除了橄榄油食品模拟物中等度洗脱时的干扰峰。

图4 (a)空白橄榄油提取液和(b)4种苯多酸橄榄油提取液(0.2 mg/kg)的色谱图Fig.4 Chromatograms of(a)olive oil blank sample and(b)olive oil sample with the four benzene polycarbonic acids (0.2 mg/kg)
2.3 样品前处理
2.3.1 滤膜的选择
水基食品模拟物用过针式过滤器过滤后直接进样分析,操作简便,避免了未经任何处理直接进样容易导致的仪器系统堵塞故障。考察了3类常用的水系针头过滤器(尼龙针头、聚醚砜针头、聚四氟乙烯针头)对4种苯多酸回收率的影响。在水基食品模拟物中,分别添加4种苯多酸混合标准溶液至2.5 μg/kg,混匀后取每种食品模拟物分别过3种过滤器后直接进样分析。结果表明,在过滤这一步,尼龙针头、聚醚砜针头、聚四氟乙烯针头过滤器对3%(w/v)乙酸食品模拟物中4种苯多酸的回收率分别为62.5% ~90.8%、99.1% ~99.9%、99.3% ~99.9%,6次试验的相对标准偏差分别为0.2%~0.8%、0.04%~0.6%、0.04%~0.45%。聚四氟乙烯针头过滤器的损失率最小,重复性也最好,其他水基食品模拟物的试验结果相近(数据未列出),故后续试验均采用亲水性聚四氟乙烯针头过滤器过滤。

图5 5种食品模拟物中4种苯多酸(8 mg/kg)的色谱图Fig.5 Chromatograms of the four benzene polycarbonic acids (8 mg/kg)in five food simulants
2.3.2 橄榄油食品模拟物提取试剂的选择
比较了水、0.1% (w/v)碳酸氢钠、0.1% (w/v)甲酸铵、0.1% (w/v)磷酸二氢钾、0.1% (w/v)乙酸铵对橄榄油中4种苯甲酸的提取情况(见图6)。结果发现,对4种苯多酸的整体提取效果依次为0.1%乙酸铵>0.1%甲酸铵>0.1%碳酸氢钠>0.1% 磷酸二氢钾 > 水。标准方法[10,11]所采用的0.1%碳酸氢钠对橄榄油中的对苯二甲酸的提取效果比较理想,但对BTCA的提取效果很差。整体上,0.1%乙酸铵提取效果最好,故采用0.1%的乙酸铵进行橄榄油中4种苯甲酸的提取。

图6 提取溶剂种类对橄榄油食品模拟物中4种苯多酸(0.4 mg/kg)提取效果的影响Fig.6 Effect of extraction solution type on the extraction of the four benzene polycarbonic acids (0.4 mg/kg)in olive oil food simulants
2.3.3 橄榄油食品模拟物提取时间的选择
用0.1%(w/v)乙酸铵水溶液提取橄榄油中相同浓度的4种苯多酸,考察了提取时间为5、10、20、30、40、50、60 min时4种苯多酸的色谱峰面积变化情况(见图7)。发现提取时间从5 min增加至10 min,以及从10 min增加至20 min时,4种苯多酸的色谱峰面积增加较明显,但继续延长提取时间,4种苯多酸的色谱峰面积变化不大。故适合橄榄油食品模拟物的提取时间为20 min。
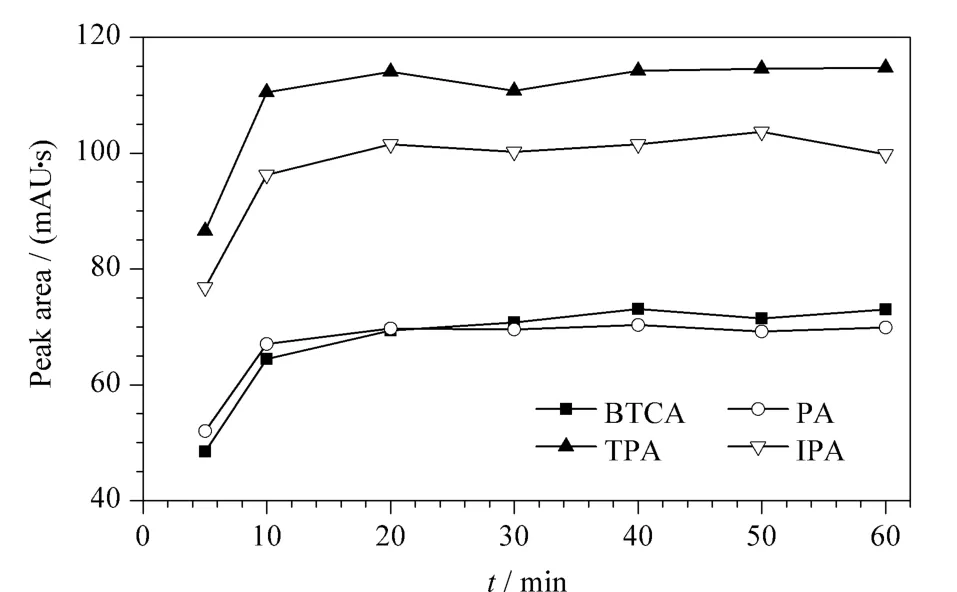
图7 提取时间对橄榄油食品模拟物中4种苯多酸(1.0 mg/kg)提取效果的影响Fig.7 Effect of extraction time on extraction of the four benzene polycarbonic acids (1.0 mg/kg)in olive oil food simulants
2.4 方法的线性关系及定量限
参照1.1节中水基食品模拟物标准溶液的配制方法,将每种水基食品模拟物配成4种苯多酸质量浓度分别为0.5、1.0、2.0、4.0、8.0、12.0 mg/L 的混合标准溶液;参照1.1节中橄榄油食品模拟物标准工作溶液的制备方法,得到橄榄油食品模拟物中4种苯多酸含量分别为 0.5、1.0、2.0、4.0、8.0、12.0 mg/kg的混合工作溶液;从低浓度到高浓度依次进行测定,以质量浓度或含量(mg/L或 mg/kg)为横坐标(X),峰面积为纵坐标(Y)做校正曲线,计算回归方程、线性范围及相关系数,结果见表2。在0.5~12 mg/L或mg/kg范围内,4种苯多酸在5种食品模拟物中的响应线性关系良好(r2≥0.999 91),符合定量检测的要求;以对应的食品模拟物稀释标准溶液至信噪比(S/N)=10确定定量限(LOQ),4种苯多酸在5种食品模拟物中的定量限为0.1~0.2 mg/kg,满足欧盟(EU)No 10/2011 法规[5]的限量要求(5 ~7.5 mg/kg)。
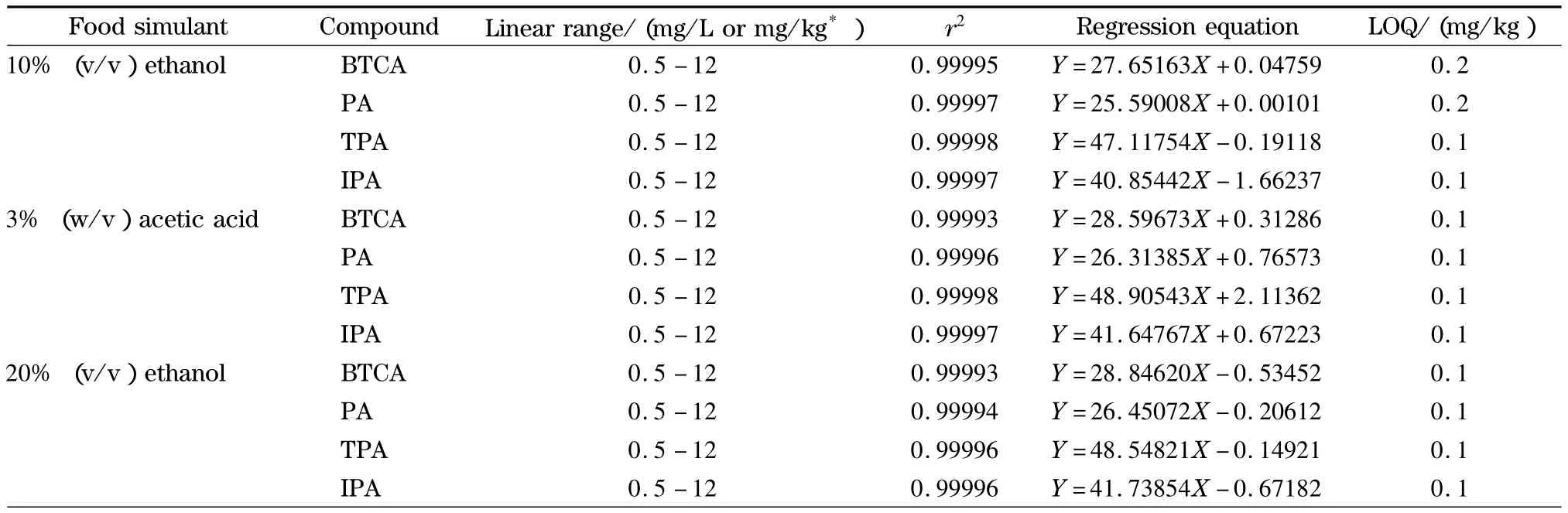
表2 4种苯多酸的线性范围、相关系数、线性方程和在食品模拟物中的定量限Table 2 Linear ranges,correlation coefficients (r2),regression equations,limits of quantification of the four benzene polycarbonic acids in food simulants

表2 (续)Table 2 (Continued)
2.5 回收率和精密度
按照严苛的迁移试验原则[16]进行迁移试验,取样品浸泡液加标的方式进行回收率试验。每种食品模拟物浸泡液分别添加4种苯多酸混合标准溶液至1.25、2.5、6.25 mg/kg,按照 1.3 节步骤处理分析,加标回收率如表3所示,4种苯多酸的加标回收率范围为94.3%~105%,相对标准偏差范围为0.1%~2.3%。影响加标回收率的主要因素为HPLC-MS/MS仪器的稳定性,以及过针头过滤器时的损失。

表3 4种苯多酸在5种食品模拟物中的加标回收率和精密度(n=6)Table 3 Spiked recoveries and precisions of the four benzene polycarbonic acids in five food simulants(n=6)
2.6 实际样品的检测
用本方法分别检测了聚乙烯塑料袋、聚丙烯盒、聚对苯二甲酸乙二醇瓶、聚对苯二甲酸乙二醇盒、尼龙铲等具代表性的食品接触材料样品中苯多酸及其衍生物的迁移量。在聚对苯二甲酸乙二醇瓶的3%(w/v)乙酸食品模拟物中检出对苯二甲酸和间苯二甲酸,迁移量分别为0.13和0.10 mg/kg,均低于限量要求。
3 结论
本文建立了高效液相色谱-紫外检测测定食品接触材料中偏苯三甲酸、偏苯三甲酸酐、间苯二甲酰氯、间苯二甲酸、对苯二甲酰氯、邻苯二甲酸、对苯二甲酸的特定总迁移量的方法。该方法具有样品处理简单快速、色谱分离效果和线性相关性好、回收率和准确度较高等优点,方法的定量限低,能完全满足欧盟(EU)No 10/2011法规的限量要求。该方法已应用于食品接触材料相关制品中苯多酸及其衍生物的特定总迁移量的检测,并在部分聚对苯二甲酸乙二醇(PET)材质的容器中检出有对苯二甲酸和间苯二甲酸的迁移。本方法可广泛应用于食品接触材料相关制品中7种苯多酸及其衍生物特定总迁移量的进出口监管及产品质量控制。
[1] Li S M.Acetaldehyde Acetic Acid Chemical Industry(李双明.乙醛醋酸化工),2014(4):20
[2] Wang H B.Synthetic Fiber in China(王海滨.合成纤维),2010(3):1
[3] Li X D,Ding H,Zhou J F.Advanced Measurement and Laboratory Management(李锡东,丁华,周建峰.现代测量与实验室管理),2012(5):8
[4] Ou Y X,Zhao Y,Han T J.Chemical Industry and Engineering Progress(欧育湘,赵毅,韩廷解.化工进展),2010,29(6):1086
[5] Commission Regulation (EU)No 10/2011
[6] Yuan N,Qiao J Q,Lian H Z.J Chromatogr Sci,2012,50(5):410
[7] Huang Z N,Liang J L,Ruan X L,et al.China Occupational Medicine(黄振侬,梁疆莉,阮小林,等.中国职业医学),2006,33(4):295
[8] Zuo Y,Zhang K,Wu J,et al.Chemosphere,2011,83(7):1014
[9] Berthet A,Berode M,Bouchard M.Anal Bioanal Chem,2011,400(2):493
[10] BS EN 13130-2-2004
[11] GB /T 23296.10-2009
[12] SN/T 2184-2008
[13] Zaitseva N V,Ulanova T S,Karnazhitskaia T D,et al.Gig Sanit,2011(4):77
[14] GB /T 23296.21-2009
[15] CEN/TS 13130-24:2005
[16] BS EN 13130-1-2004
