55例大型脑膜瘤术前栓塞的应用评价
2015-08-01李立龙李飞平
李立龙 唐 田 李飞平 文 露 毕 峰
55例大型脑膜瘤术前栓塞的应用评价
李立龙 唐 田 李飞平 文 露 毕 峰
目的 研究大型脑膜瘤的术前栓塞的的应用价值。方法 选择55例大型脑膜瘤患者(最大径>5cm),分成栓塞组(n=28)和对照组(n=27),栓塞组术前先予以DSA(digital subtraction angiography)造影了解肿瘤血供情况,并予以PAV颗粒或栓塞微球颗粒(200~300um)栓塞,对照组未予以栓塞,对比2组肿瘤切除出血量、手术时间,观察手术并发症情况;术后1~2周复查增强MR观察肿块切除程度。结果 研究组术中出血量(456±145)mL,明显小于对照组(913±134)mL,差异有统计学意义(P<0.05)。手术时间,研究组与对照组分别为(4.45±2.13)h和(5.23±1.45)h,差异有统计学意义(P<0.05)。栓塞组提高了肿瘤的切除率,4例出现栓塞后颅内高压,头痛加重,1例出现颅神经一过性麻痹,3例出现局部头皮坏死,经支持治疗后均缓解。结论 大型脑膜瘤术前血管造影可以了解肿瘤血管情况,指导外科手术切除,栓塞术后可以明显减少术中出血,缩短手术时间,提高肿瘤切除程度。
脑膜瘤;栓塞;大型;脑血管造影;手术
脑膜瘤为颅内常见良性肿瘤,发生率仅次于胶质瘤,占颅内肿瘤15%~24%[1],一般将最大径大于5cm的脑膜瘤称为大型脑膜瘤,外科切除是治疗脑膜瘤的首选方法,术者在保护脑神经功能、减少并发症的安全前提下尽可能完整切除肿瘤,Simpson[2]脑膜瘤切除程度分级标准分为I~V级;然而对于大型或巨大型脑膜瘤,由于肿瘤血供丰富,术中大量出血导致手术视野模糊,导致肿块切除不完全。目前多数学者认为对于此类肿瘤,术前应先行DSA造影了解肿瘤血供情况,并予以栓塞术。为以进一步研究大型脑膜瘤术前栓塞的的临床应用,本研究选择55例大型脑膜瘤(最大径>5cm)患者,随机分成栓塞组及对照组进行研究,现报道如下。
1 资料与方法
1.1 一般资料 选择湖南省肿瘤医院暨中南大学湘雅医学院附属肿瘤医院55例大型脑膜瘤患者,年龄34~68岁,平均(56.4±5.3)岁。55例患者术前MR均诊断脑膜瘤。见图1、图2,增强扫描显示肿瘤明显强化,血供丰富,并经外科术后病理证实均为脑膜瘤,依据WHO将脑膜瘤分为3级[3]:其中WHOⅠ级31例(31/55,56.4%)、WHOⅡ级15例(15/55,27.2%)、WHOⅢ9例(9/55,16.3%)。肿瘤直径5~9cm,平均6.1cm;55例患者临床症状为头痛、头晕、呕吐、肢体乏力等,栓塞组予以DSA造影,而对照组仅行DSA造影,未予以栓塞,2组资料性别、肿瘤大小、肿瘤位置、血管分型均无明显统计学差异。
1.2 方法 采用数字血管减影机(DSA)为GE INNOVA 4100 IQ数字平板血管造影系统,MR为1.5T Signa HDxt成像系统;栓塞导管为5F单弯导管或西蒙导管;泰尔茂2.7F SP外周超选择微导管;栓塞剂为COOK聚乙烯醇(PVA)颗粒,直接200μm~300μm。,栓塞组行DSA造影+栓塞术,对照组仅行DSA造影未予以栓塞。
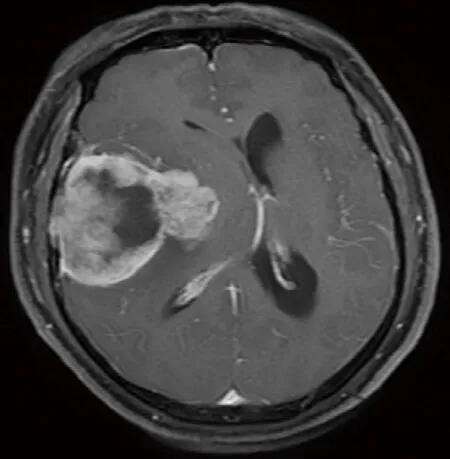
图1 男性51岁,右侧额叶脑膜瘤,直径7.5cm,术前MR示肿瘤不均匀强化
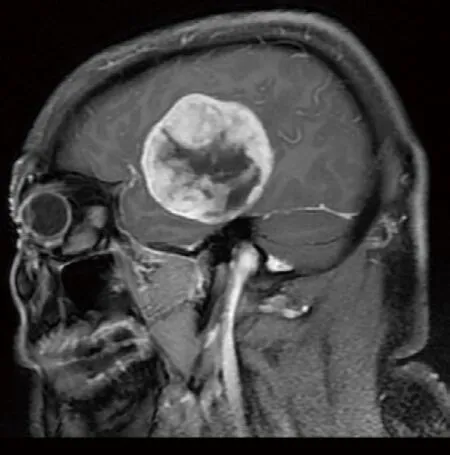
图2 矢状位图,肿瘤呈球形,血供丰富,内部可见坏死,WHOⅡ级
采用Seldinger 技术穿刺股动脉后,5F椎动脉造影导管或西蒙导管行全脑血管造影术,了解肿瘤供血情况。见图3。观察颅内外“有无危险吻合”;使用2.7F微导管超选择至肿瘤供血动脉内,根据供血动脉的直径、肿瘤染色情况,选用200~300μm的聚乙烯醇(PVA)微粒或栓塞微球予以栓塞。见图4。栓塞过程在DSA动态监视下完成,如出现返流迹象,立即中断栓塞;栓塞结束后行DSA造影确认肿瘤血管闭塞,肿瘤染色消失,部分肿瘤合并多支颈外动脉供血,依次超选择供血动脉予以栓塞,对于颈内动脉分支供血,因栓塞可能导致脑梗塞等严重并发症,未予以栓塞。患者术后1~2周复查头部MR,评价肿瘤的切除程度Simpson分级。
1.3 统计学方法 采用SPSS22.0进行统计学分析,计量资料采用t检验分析,计数资料采用以χ2检验,以P<0.05为差异具有统计学意义。
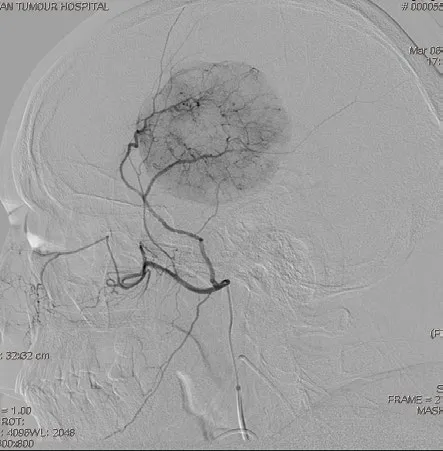
图3 术前脑血管造影显示肿瘤呈抱球征,由脑膜中动脉分支参与供血
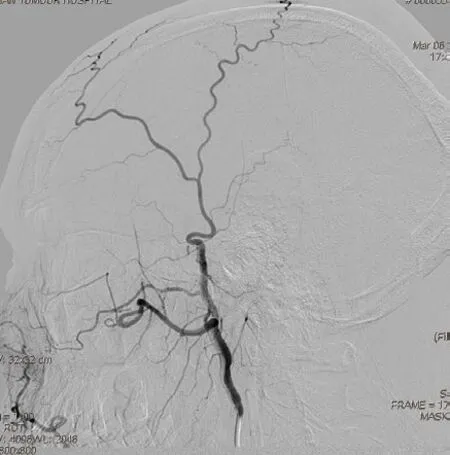
图4 使用PAV300um颗粒栓塞后,造影显示肿瘤染色完全消失,术中出血量305ml
2 结果
2.1 肿瘤的供血动脉情况 55例患者共计78根肿瘤血管,其中颈外动脉参与供血占76.9%,脑膜中动脉46根(46/78,58.9%)、脑膜副动脉2根(2/78,2.7%)、颞浅动脉6根(6/78,6.5%)、枕动脉6根(6/78,6.5%);颈内动脉及椎动脉供血占23.1%,大脑前动脉分支7根(7/78,9.0%)、大脑中动脉分支5根(5/78,6.4%)、眼动脉分支1根(1/78,1.3%)、脉络丛动脉分支4根(4/78,5.1%)、椎动脉分支3根(3/78,3.8%)。
2.2 2组术中出血量、手术时间、手术切除程度比较 术前栓塞组,术中视野清晰,术中出血量少,肿瘤组织软化,疏松,与周围组织容易分离,提高了肿瘤的整体切除率,缩短了手术时间,2组术中出血量、肿瘤切除时间差异具有统计学意义(P<0.05);同时栓塞组肿瘤切除Simpson分级比例优于对照,差异有统计学意义(P<0.05)。
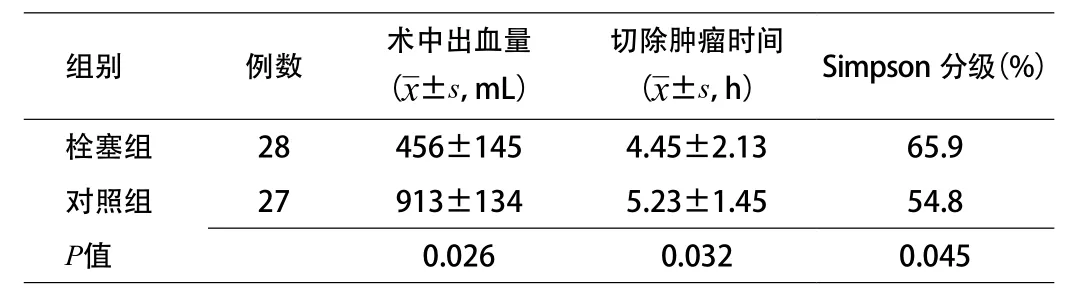
表2 术中出血量、手术时间、切除程度比较
2.3 术前栓塞并发症 28例栓塞组患者未出现脑梗死、脑出血、脑神经神经功能障碍等严重并发症,4例(4/28,14.2%)出现栓塞后头痛加重,考虑栓塞后脑水肿加重,予以甘露醇脱水及激素对症治疗后缓解,3例(3/28,10.8%)栓塞后出现,头皮发胀,红肿,皮肤区域性坏死,考虑为颞浅动脉参与肿瘤供血,部分正常分支被栓塞,出现缺血性坏死,1例(1/28,3.8%)出现颅神经一过性麻痹。
3 讨论
大型脑膜瘤多为富血供,约70%由颈外动脉参与供血[4],随着瘤体不断生长、挤压、侵犯蛛网膜界面时,少量颈内动脉如大脑前、中动脉或椎动脉分支亦参与肿瘤供血,由于大型脑膜瘤推压脑组织,包绕周围的血管、神经,若术前不能准确了解肿瘤与血管的关系,极容易造成误伤而导致严重并发症[5]。显微外科手术视野深且狭小,肿瘤出血会使术野不清,手术大部分时间用于清创止血,延长手术时间。
Manalfe[6]等把脑膜瘤血供分为4型:Ⅰ型为单纯颈外动脉供血;Ⅱ型为颈外颈内供血,但以颈外动脉为主;Ⅲ型亦为颈外颈内供血,但以颈内动脉为主;Ⅳ型为单纯颈内动脉供血。从安全角度看,Ⅰ、Ⅱ型患者适合栓塞术, Ⅲ、Ⅳ型则不适合栓塞术。术前DSA能够准确评估肿瘤的血供,可以显示瘤体与脑内动静脉的毗邻关系,观察瘤体对动脉有无推压、包埋,为指导外科术中暴露及分离血管,具有指导意义。脑血管造影多呈现为供血动脉扩张、迂曲,瘤体呈抱球状,辐射状染色,可见瘤体宽基底与脑膜相连,并可见引流静脉。
早期栓塞脑膜瘤使用的明胶海绵及真丝线段,由于脑膜瘤的供血动脉较为纤细,真丝线段常发生堵管,尤其在微导管中很难推动,导致直接闭塞供血动脉主干,栓塞剂没有进入瘤床,肿瘤可以通过侧支循环产生供血,而明胶海绵属于中长期栓塞剂,富血供脑膜瘤肿瘤供血动脉高血运反复冲刷,容易再通[7]。所以理想的栓塞剂是应该达到肿瘤毛细血管层面的栓塞,栓塞剂沉积在肿瘤的血管床,但栓塞颗粒直径如果过小,可能通过颅内外交通支栓塞颅内血管导致脑梗死、脑出血等并发症,大多数学者推荐使用PVA颗粒做为脑膜瘤首选栓塞剂,根据肿瘤血管直径,血流速度选择直径150~500μm进行栓塞[8]。本组28例患者采用直径为200~300μm的PAV颗粒;栓塞终点是重复造影肿瘤供血动脉闭塞,肿瘤染色完全消失,28例患者栓塞效果满意,没有发生异位栓塞及误栓的病例,栓塞组由于术中出血少,视野清晰,患者平均手术时间仅为(4.45±2.13)h,明显小于未栓塞组(5.23±1.45)h而在手术切除程度方面,栓塞组Simpson分级,为65.9%,亦明显高于对照组54.8%(P<0.05),关于栓塞后手术时间的选择,国内外学者推荐栓塞术后的7~9d[9],这期间栓塞术后内能使肿瘤获得最大程度的软化,肿瘤切除出血量明显减少,术中视野清晰,肿瘤与周围组织易于分离,栓塞与手术间隔时间过短,肿瘤未能去血管化,时间相隔过长,侧枝循环代偿或新生供血动脉支及闭塞血管再通,从而导致栓塞失败[10]。28例患者平均手术时间3.5天,术中见肿瘤坏死明显且术中出血量少,手术难度降低,术后恢复良好。
脑膜瘤栓塞术后常见的并发症有:头痛加重、脑组织水肿、脑梗死、脑出血、头皮坏死、颅神经麻痹等[11]。各文献报告差异较大,Borg A[12]等报告10年117例术前脑膜瘤栓塞严重并发症发生率约3.7%,短暂及轻度并发症为11.7%,严格遵循栓塞流程,术中操作规范,可以降低并发症发生的概率:(1)脑梗死:栓塞前脑血管造影排除颅内外“危险吻合”动脉存在,超选择尽可能至瘤体血管末端,栓塞在DSA动态监视下注射栓塞剂,栓塞分多次稀释后缓慢注射,用肝素钠盐水反复冲刷导管,使PAV颗粒沉积在肿瘤瘤床;(2)脑水肿:栓塞后脑膜瘤缺血坏死,组织水肿,导致头痛加重,栓塞后予以地塞米松减轻组织水肿及甘露醇降低颅内压治疗均可缓解;(3)头皮缺血坏死:脑膜瘤合并颞浅动脉分支供血,或栓塞剂返流至颞浅动脉,造成颞浅动脉分支缺血坏死,超选择至肿瘤供血动脉予以栓塞,注射栓塞剂时低压、缓慢,避免栓塞剂返流导致颞浅动脉异位栓塞;(4)脑缺血及颅神经麻痹:可先行利多卡因激发试验[13];由于颅内外“危险吻合”存在,增加误栓的发生概率,本组1例(1/28,5.3%)出现栓塞术后一侧眼脸上提困难,考虑动眼神经麻痹颅神经一过性麻痹,经脱水治疗后缓解。栓塞过程中需要多次微导管造影,若发现异常侧枝循环,应立即停止栓塞。
总之,对于大型富血供脑膜瘤,术前全脑血管造影不仅能准确评估肿瘤的血供,指导外科手术,栓塞后可以明显减少术中出血、缩短手术时间,提高肿瘤的切除程度,而远期疗效及具体影响预后因素需要大样本对照实验进一步研究。
[1] 张新良.脑膜瘤的诊治现状与进展.临床肿瘤学杂志,2011,16(7):658-661.
[2] SIMPSON D.The recurrence of intracranial meningiomas after surgical treatment[J].J Neurol Neurosurg Psychiatry,1957,20(1):22-39.
[3] Louis DN,Ohgaki H,Wiestler OD.The 2007 WHO classification of tumours of the central nervous system[J].ActaNeuro pathol,2007,114(2):97-109.
[4] Shah AH,Patel N,Raper DM,et al.The role of preoperative embolization for intracranial meningiomas[J].J Neurosurg,2013,119(2):364-372.
[5] 姚江伟,李芸,吴文甫,等.脑膜瘤术前栓塞治疗的临床评价[J].中国临床神经外科杂志,2011(9):12-14.
[6] Manelfe C,Guiraud B,David J,et al.Embolization by catheterization of intracranial meningiomas[J].Rev Neurol (Paris),1973,128(5):339-351. [7] Raper DM,Starke RM,Henderson F Jr,et al.Preoperative embolization of intracranial meningiomas:efficacy,technical considerations,and complications.AJNR Am J Neuroradiol,2014,35(9):1798-1804.
[8] Gelabert-Gonzalez M,Serramito-Garcia R,Aran-Echabe E.Preoperative embolisation with absorbable gelatine sponge in intracranial meningiomas[J].Rev Neurol,2010,50(1):63-64.
[9] 周政,刘俊,杨辉,等.术前超选择性栓塞高血运脑膜瘤的临床意义[J].介入放射学杂志,2004(5):34-36.
[10] Yoon YS,Ahn JY,Chang JH,et al.Pre-operative embolisation of internal carotid artery branches and pial vessels in hypervascular brain tumours[J].Acta Neurochir (Wien),2008,150(5):447-452.
[11] Carli DF,Sluzewski M,Beute GN,et al.Complications of particle embolization of meningiomas:frequency,risk factors,and outcome[J].AJNR Am J Neuroradiol,2010,31(1):152-154.
[12] Borg A,Ekanayake J,Mair R,et al.Preoperative particle and glue embolization of meningiomas:indications,results,and lessons learned from 117 consecutive patients[J].Neurosurgery,2013,73(2):244-251.
[13] 周政,刘俊,杨辉,等.术前超选择性栓塞高血运脑膜瘤的临床意义[J].介入放射学杂志,2004,3(5):13-17.
Objective To study Preoperative embolization of Large-scale meningiomas value. Methods Choose 55 cases of large meningiomas (maximum diameter> 5cm) patients were divided into 28 cases of embolization group and a control group of 27 patients, preoperative embolization group to be pre-DSA angiography of tumor blood supply, and be with PAV particles (200-300um) embolism, the control group did not give embolism, compared two groups of tumor blood loss, operative time, surgical complications; after 1-2 weeks after lumpectomy extent observed enhanced MR. Results Study group blood loss (456 ± 145) mL was significantly less than the control group (913 ± 134) mL (P<0.05) has a statistically significant difference in operative time, the study group and the control group were (4.45 ± 2.13)h and (5.23 ± 1.45)h, there are significant differences between the two, embolization group increased the rate of tumor resection, 4 cases after embolization of intracranial hypertension, headache aggravated, 1 patient had a transient cranial nerve palsy, three cases partial scalp necrosis, were relieved after supportive treatment. Conclusion Preoperative angiography before a large meningioma tumor vessels can learn to guide surgical resection, embolization can significantly reduce blood loss, shorter operative time, increase the degree of tumor resection.
Meningioma; Embolism; Large; Angiography; Surgery
10.3969/j.issn.1009-4393.2015.19.023
湖南 410013 湖南省肿瘤医院暨中南大学湘雅医学院附属肿瘤医院(李立龙 唐田 李飞平 文露 毕峰)
唐田 E-mail:164122966@qq.com
