青霉素对金银花光合生理特性的影响
2015-07-31崔志伟王康才王乾等
崔志伟 王康才 王乾等
摘要:以金银花品种巨花一号为材料,研究喷施青霉素对金银花光合生理特性的影响。结果表明,随着青霉素浓度升高,叶片中抗氧化酶活性逐渐升高,高浓度(800 mg/L)处理会抑制POD活性;低浓度(400 mg/L)处理可显著提高实际光化学效率(ФPSⅡ)、电子传递速率(ETR)、光化学猝灭系数(qP),增幅分别为196.6%、29.1%、975% 。当青霉素浓度为600 mg/L时,叶绿素a 、叶绿素b含量分别比对照高8.6%、58.8%;净光合速率(Pn)、胞间二氧化碳浓度(Ci)、蒸腾速率(Tr)分别升高52.9%、32.1%、27.9%。青霉素浓度为800 mg/L时,气孔导读(Gs)提高162.9%,但对ФPSⅡ、ETR产生一定的抑制作用,并降低叶绿素的含量。说明适宜浓度的青霉素可显著改善金银花的光合生理特性,对金银花生产实践起参考作用。
关键词:青霉素;金银花;光合特性;叶绿素;气体交换参数;荧光参数
中图分类号: S567.7+90.1 文献标志码: A
文章编号:1002-1302(2015)03-0224-03
青霉素是一类临床上广泛应用的广谱抗菌素,常用于临床医学和作为动物饲料添加剂等,植物上常用于病害防治和调控生长等,对高等植物(如水稻、小麦等)种子萌发时α-淀粉酶的形成、叶绿素形成与降解、内源物质代谢等具有显著影响[1]。汤菊香等报道,适宜浓度的KH2PO4和青霉素能明显提高小麦老化种子发芽率、发芽指数、活力指数、幼苗根系活力、叶片叶绿素含量及幼苗长度[2]。青霉素应用在药用植物上也有相关报道,如容绍英等研究发现,800 mg/L青霉素水溶液能提高菘蓝种子发芽率、幼苗株高和叶绿素含量[3];谢德明对川芎进行外源喷施青霉素水溶液后发现,植株的叶绿素含量提高18.28%,并降低了植物组织水势[4]。因此,青霉素被认为是一种新的、作用强的激素类植物生长调节剂。
金银花为忍冬科(Caprifoliaceae)忍冬属(Lonicera)多年生半常绿藤本植物,具有较高的药用价值,有“中药青霉素”的美称。金银花为喜光类植物,当阳光充足、光合作用旺盛时,植株可将更多的光合产物分配于营养器官,使枝条粗壮、叶大、产量高。喷施青霉素可影响叶绿素含量,但对光合生理影响的相关研究报道则较少,因此,笔者通过外源喷施青霉素,初步研究其对金银花的光合生理的影响,以期为后续相关研究和生产应用提供参考。
1 材料与方法
1.1 材料
试验材料为金银花品种巨花一号,经南京农业大学中药材研究所王康才教授鉴定为忍冬科忍冬属忍冬(Lonicera japonica Thunb)。青霉素(纯度≥98%)为北京索莱宝科技有限公司生产。
1.2 试验设计
试验在南京农业大学中药材研究所日光温室内进行,开始前20 d停止对处理植株施用任何营养元素,试验期间(2013年4月13日至5月1日)定期对植株浇水。青霉素分别用蒸馏水配制成浓度为200、400、600、800 mg/L的溶液,每个处理分4株,共处理3次。对照(CK)为喷施清水处理。喷施时间为16:00—17:00,以叶片正反两面全部湿润且无液体滴下为宜。
1.3 测定指标及方法
1.3.1 抗氧化酶体系活性
超氧化物歧化酶(SOD)活性的测定采用核黄素-NBT光还原法,以抑制氯化硝基氮蓝四唑(NBT) 光化还原50%为1个酶活单位。过氧化物酶(POD)活性的测定采用愈创木酚法,以 1 min D470 nm变化0.01为1个酶活单位。丙二醛(MDA)含量的测定采用硫代巴比妥酸(TBA)显色法。
1.3.2 叶绿素含量
用岛津UV-1601分光光度计按 Lichtenthaler 等的方法[5]测定并计算叶片单位鲜质量的叶绿素a/叶绿素b含量。
1.3.3 光合作用参数
选取生长势较好、发育完全的叶片,用便携式光合作用分析系统(Li-6400XT,美国Li-Cor公司)于晴天09:00—11:00测定植株光合作用。测定时使用开放气路,叶室温度控制在(25±1) ℃,PPFD控制在 800 μmol/(m2·s),参比室CO2浓度为(380±10) μmol/L,相对湿度为60%~70%。测定的气体交换参数有净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)。
1.3.4 叶绿素荧光参数
Imaging-PAM M-series调制叶绿素荧光成像系统(德国Walz公司)测定叶绿素荧光参数。选取各处理生长点下第3张完全展开功能叶,20 min充分暗适应后,取下叶片,在每个叶圆片上选定一个直径为1 cm的测试目标区域(AOI),测定时先用测量光[0.5 μmol/(m2·s)]测定初始荧光F0,饱和光脉冲2 700 μmol/(m2·s)(脉冲时间0.8 s)诱导FM,光化光强度为145 μmol/(m2·s)。在软件的Kinetics窗口检测各叶绿素荧光参数的动力学变化曲线,相应数据可直接从Report窗口导出。
1.4 数据分析
应用Excel进行数据图表处理,采用SPSS 20.0统计分析软件进行相关性分析。
2 结果与分析
2.1 青霉素对金银花抗氧化酶体系的影响
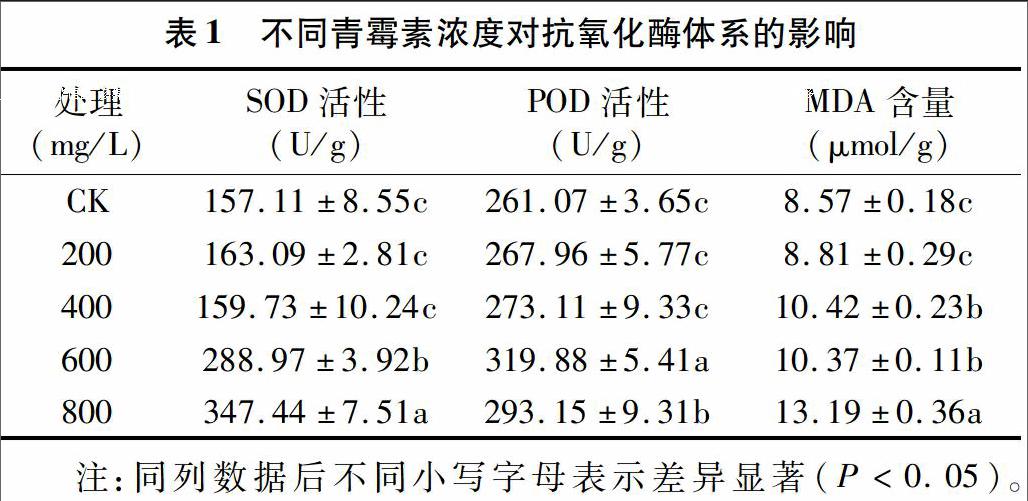
SOD与POD是植物体内的一种抗氧化保护酶,与膜脂过氧化有关,还可以清除植物细胞内产生的少量超氧阴离子自由基( O-2[KG-*2]· )。从表1可看出,SOD活性在青霉素浓度为 800 mg/L 时最强;POD活性在青霉素浓度为600 mg/L时最强,浓度继续升高时,活性则减弱。MDA作为H2O2的解毒剂,主要存在于植物的微体中,其含量可以反映出对细胞膜受伤害的程度以及抗氧化酶体系对细胞膜的保护程度,由表1可知,总体而言,MDA含量随着青霉素浓度升高而逐渐上升,表明高浓度的青霉素处理不利于金银花的生长。endprint
2.2 青霉素对金银花叶绿素含量的影响
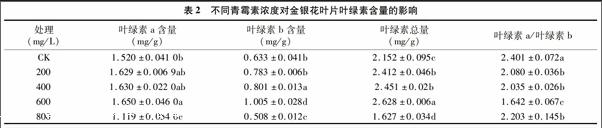
叶绿素是植物进行光合作用的主要色素,其含量反映了植物同化物质的能力。如表2所示,与对照相比,外源喷施青霉素对叶绿素含量产生一定的影响。随着青霉素浓度升高,叶绿素a含量、叶绿素b含量及叶绿素总量均有所增加,以浓度为600 mg/L时效果显著,分别比对照增加了86%、588%、22.1%;当浓度为800 mg/L时,叶绿素含量则显著降低,以叶绿素总量下降幅度最大,比对照降低323%。与对照相比,200、400 mg/L青霉素可降低叶绿素 a/叶绿素 b的值,高浓度(600、800 mg/L)青霉素可提高叶绿素 a/叶绿素 b的值,最大增幅达15.4%。
3 结论与讨论
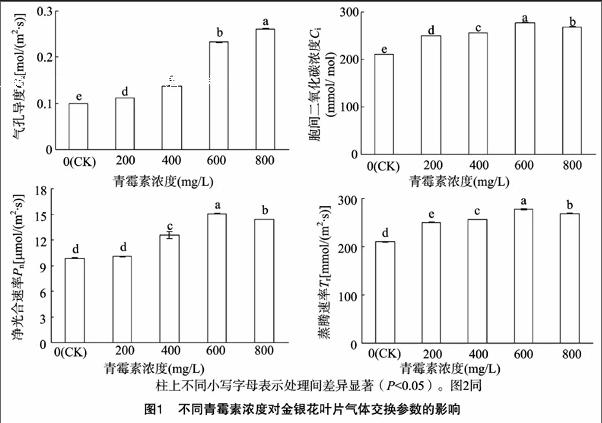
光合作用是植物体内重要的代谢过程,其过程受各种内外环境因素的影响,如光照、水分、CO2浓度等。由试验结果可知,喷施青霉素后胞间CO2浓度(Ci)与净光合速率(Pn)的变化趋势一致,均随着浓度升高而上升,说明增大CO2浓度可以大大提高金银花的光合生产力。不同处理下的蒸腾速率(Tr)虽表现出与胞间CO2浓度(Ci)及净光合速率(Pn)同样的趋势,但其过高或过低意味着植物对水分的利用不充分,植物的光合作用。
光合色素在植物光合作用的原初光反应过程中起着关键作用[9],其含量高有利于增加光合产物的积累及叶片对花蕾营养物质的供应能力,从而促进花蕾的发育。青霉素可促进叶片中核酸和蛋白质的合成,并且降低叶片中叶绿素酶的活性来延缓叶绿素的降解,从而提高叶片中叶绿体色素的含量[1]。由试验结果可知,在环境相同的条件下,外源喷施适宜浓度的青霉素可以增加叶绿素 a和叶绿素 b的含量,600~800 mg/L青霉素水溶液还可提高叶绿素a/叶绿素b值,叶绿素 b含量的提高可以增加用于吸收光能的集光色素蛋白的相对含量,从而保证叶片吸收更多的光能用于光合作用 [10],而叶绿素a/叶绿素b值的提高有助于植物适应周围环境光强,又可提高对逆境的适应性[11]。
同时,本试验通过不同浓度处理下金银花的叶绿素荧光特性的测定发现,适宜浓度的青霉素喷施后叶片均比对照有更高的Fv/Fm、ФPSⅡ、qP、ETR值。Fv/Fm值增加说明其PSⅡ的实际光能捕获效率较高,能够把所捕获的光能更多地用于光化学反应[12]。处理后的ETR、qP值也有所升高,说明其 PSⅡ 反应中心原初电子受体QA库较大,使PSⅡ反应中心开放的比列增大,它能够通过光合电子传递途径将较多的光能用于二氧化碳的同化,阻止了过量的激发能在PSⅡ反应中心积累,这有助于为光合碳同化提供更多的能量(ATP)和还原力(NADPH),形成更多的光合产物[13],从而分配于植株各器官,促进植株的生长。
目前,关于青霉素对植物作用机理的相关文献未见报道,笔者只是初步探讨对金银花的影响,但在不同物种及不同环境条件下的作用是否类似,仍需进一步的探讨。同时,由于青霉素可以抑制内生菌的繁殖,外源喷施青霉素是否会影响金银花相关成分指标以及青霉素在金银花中的残留是否影响药效,仍需进一步研究。
参考文献:
[1]李海航,潘瑞炽. 青霉素在高等植物中的作用[J]. 植物生理学通讯,1987,23(5):1-6.
[2]汤菊香,冯艳芳. KH2PO4和青霉素对小麦老化种子发芽及幼苗生长的影响[J]. 种子,2001(4):19-20,25.
[3]容绍英,刘冬莲,石洪凌,等. 青霉素和氨苄青霉素对菘蓝种子的生物学效应[J]. 中药材,2006,29(12):1270-1272.
[4]谢德明. 川芎喷施青霉素研究初报[J]. 中国中药杂志,1994,19
[5]Lichtenthaler H K,Wellburn A R. Determination of total carotenoids and chlorophyll a and b of leaf extracts in different solvents[J]. Biochem Soc Trans,1983,603:591.
[6]杨晓青,张岁岐,梁宗锁,等. 水分胁迫对不同抗旱类型冬小麦幼苗叶绿素荧光参数的影响[J]. 西北植物学报,2004,24(5):812-816.
[7]许大全,张玉忠,张荣铣. 植物光合作用的光抑制[J]. 植物生理学通讯,1992,28(4):237-243.
[8]Enty B E,Briantais J M,Baker N R.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J]. Biochim Biophys Acta,1989,990:87-92.
[9]李雪芹,徐礼根,金松恒,等. 4种草坪草叶绿素荧光特性的比较[J]. 园艺学报,2006,33(1):164-167.
[10]迟 伟,王荣富,张成林. 遮荫条件下草莓的光合特性变化[J]. 应用生态学报,2001,12(4):566-568.
[11]Ma C C,Gao Y B,Guo H Y,et al. Morphological adaptation of four dominant Caragana species in the desert area of the lnner Mongolia plateau[J]Acta Ecol Sin,2006,26(7):2308-23121.
[12]张 杰,邹学忠,杨传平,等. 不同蒙古栎种源的叶绿素荧光特性[J]. 东北林业大学学报,2005,33(3):20-21.
[13]Mao L Z,Lu H F,Wang Q,et al. Comparative photosynthesis characteristics of Calycanthus chinensis and Chimonanthus praecox[J]. Photosynthetica,2007,45(4):601-605.endprint
