蝴蝶兰组培瓶苗的微生物污染防治研究
2015-07-26薄维超李谢郑霞连云港师范高等专科学校江苏连云港222000
薄维超,李谢,郑霞,罗 丽(连云港师范高等专科学校,江苏 连云港 222000)
蝴蝶兰组培瓶苗的微生物污染防治研究
薄维超,李谢,郑霞,罗 丽
(连云港师范高等专科学校,江苏 连云港 222000)
摘要:对工厂化快速繁殖蝴蝶兰过程中出现的组培瓶苗污染问题开展研究工作。分离纯化得到6种污染微生物,采用滤纸片法筛选出100mg/L链霉素+100mg/L硫酸庆大霉素+100mg/L苯甲酸为最佳使用抑菌剂组合,并且对蝴蝶兰苗的增殖影响不大。
关键词:蝴蝶兰;组培瓶苗;污染;防治
蝴蝶兰(Phalaenopsis hybrids)是名贵花卉之一,以花大、色艳、花期长而著称,具有很高的观赏价值。蝴蝶兰属单茎气生兰,极少发育侧枝,难以进行常规的无性繁殖。通过组织培养技术可以在短期内快速繁殖获得大量幼小植株,适应市场的大量需求,也是工厂化育苗的重要途径。工厂化育苗为保证母株的优良特点,如花型、花色等商品要求,需要采用花梗上的营养芽作为原代培养的起始材料,将花梗截取成每段带单芽的4-5cm小梗,接种至原代培养基中诱导单芽萌发;当单芽萌发生长具有长度达到1cm的1叶时,切割除去花梗,取生长的芽转接到初代培养基中增高和壮芽培养1个月;切去培养壮实的芽苗叶片和顶芽以去除顶端优势,然后将不高的茎段沿着节间分割,将带有腋芽的每节段,培养到增殖培养基中诱导多芽的产生,通常单次增殖率小于等于3,继代培养次数不超过8次,以免畸形芽的产生;通过不断的增殖实现快速繁殖;再通过壮苗、生根、炼苗等培养方可出瓶进入温室培养阶段。在蝴蝶兰的整个快速繁殖培养过程中都可能出现污染[1]。本文主要是对蝴蝶兰瓶苗增殖培养过程中的污染进行研究。
1 试验器材
1.1 实验材料和试剂
蝴蝶兰污染瓶苗(由连云港振兴兰业股份有限公司组培中心提供)。
革兰氏染色试剂盒、链霉素、青霉素、硫酸庆大霉素、苯甲酸(均购自上海国药集团)。
1.2 实验方法
1.2.1 培养基
(1)蝴蝶兰增殖培养基:花宝1号+6-BA3mg/L+NAA0.5mg+蔗糖3%+活性炭4g/L+马铃薯10%+琼脂0.8%,pH5.8。(2)牛肉膏蛋白胨固体培养基。(3)PDA固体培养基。
1.2.2 菌种分离与纯化
(1)平板划线分离:在污染的瓶苗培养基中挑取出污染菌,分别在牛肉膏蛋白胨固体培养基平板和PDA固体培养基平板上划线分离。蜡膜封口,倒扣于温箱中培养。前者培养温度为37℃,3-5d;后者为28℃,7-10d。
(2)平板划线纯化:刮取平板上的单菌落上的少量细胞,划线纯化培养2次,以得到纯化菌种,将纯化的菌种接种于蝴蝶兰增殖培养基中复感染培养,观察菌落的形态是否与取样时瓶苗内的污染一致。25℃培养室培养,光照1500lux,光周期16h/d,培养10-15d。对复感染一致的菌种进行编号,4℃保存。
1.2.3 纯化菌种的初步鉴定
(1)菌落形态观察:将活化的菌种平板划线培养2-10d,观察单菌落的生长形态并记录。
(2)对污染细菌进行鉴定:对获得的纯化菌进行革兰氏染色镜检,确定基本形态大小和革兰氏属性。
1)确定形态大小:观察形态,使用显微测微尺对革兰氏染色涂片上的菌体细胞进行大小测量。
2)确定革兰氏属性:对制作的涂片进行革兰氏染色,镜检结果,蓝紫色为G+,紫红色为G—。
(3)对污染真菌进行鉴定:制作水浸片染色镜检观察菌丝及繁殖器特征,查阅《真菌鉴定手册》确定属。
1.2.4 平板抑菌实验
采用滤纸片法以链霉素、青霉素、硫酸庆大霉素、苯甲酸等及混合抑菌剂对分离到的菌种进行抑菌实验,采用的平板培养基为蝴蝶兰增殖培养基[2]。
(1)菌种活化:将保存在冰箱4℃的分离纯化菌种转接到蝴蝶兰增殖培养基平板上,细菌类37℃培养48h,真菌类培养28℃培养4-7d。
(2)制备菌悬液.
(3)纸片法抑菌实验.
1.2.5 抑菌剂对组培苗生长的影响
观察优化抑菌剂组合对蝴蝶兰组培苗生长发育的影响。通过统计新生叶数、新生根数、芽增殖倍数等评价混合抑菌剂对蝴蝶兰组培苗生长的影响[3]。
2 实验结果及分析
2.1 微生物的形态特征及鉴定
分离的污染微生物菌种特征如下表。
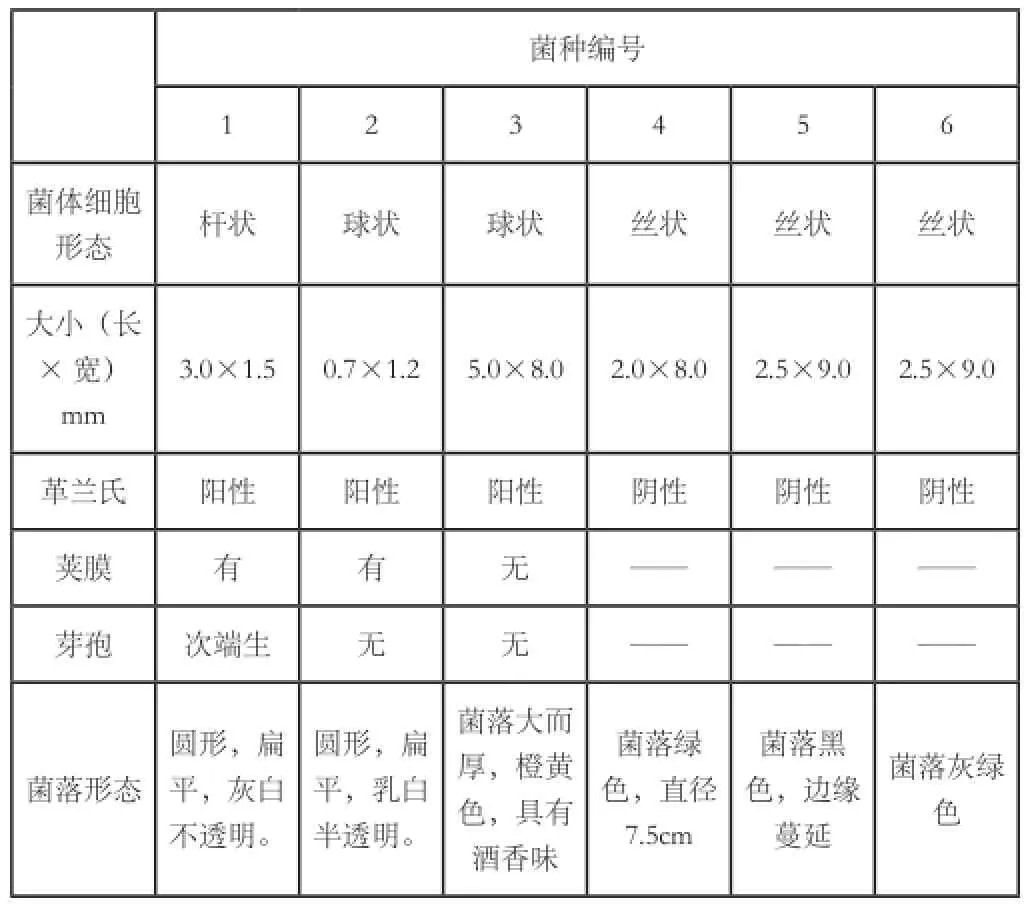
表1 分离污染菌的形态特征
从表中可以判断出,1号和2号菌为细菌,3号为酵母菌,4,、5 和6号为霉菌。其中1号为杆菌,G-,2号为球菌,G+。对霉菌的产孢子梗进一步观察可以鉴别出菌属,见表2。
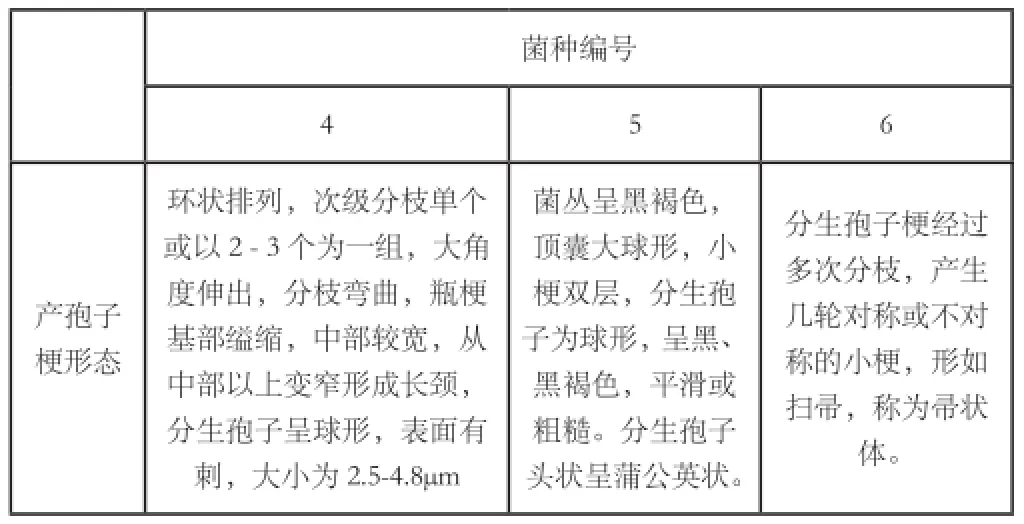
表2 三类污染霉菌的产孢子梗形态
从表2列出的三类霉菌分生孢子梗特征,综合菌落特征,菌丝特点。查阅《真菌鉴定手册》可以判断出4号为绿色木霉,5号为黑曲霉,6号为青霉。
2.2 滤纸片法抑菌实验结果分析
经过表1和表2的结果,可知有2种细菌、1种酵母菌和3种霉菌。选用了链霉素、青霉素、硫酸庆大霉素、苯甲酸三种药品进行抑菌实验。链霉素主要作用于细菌核糖体,影响蛋白质的合成功能。故4、5和6号没有用该药品处理。青霉素主要作用于革兰氏阳性细菌细胞壁的肽聚糖,由于3、4、5、6号为真菌,细胞壁中没有肽聚糖成分,故没有用该药品处理。硫酸庆大霉素主要作用于细菌蛋白质合成有关的核糖体亚基,对真菌无效,故3、4、5、6号未用该药品处理。
结果见下表3。
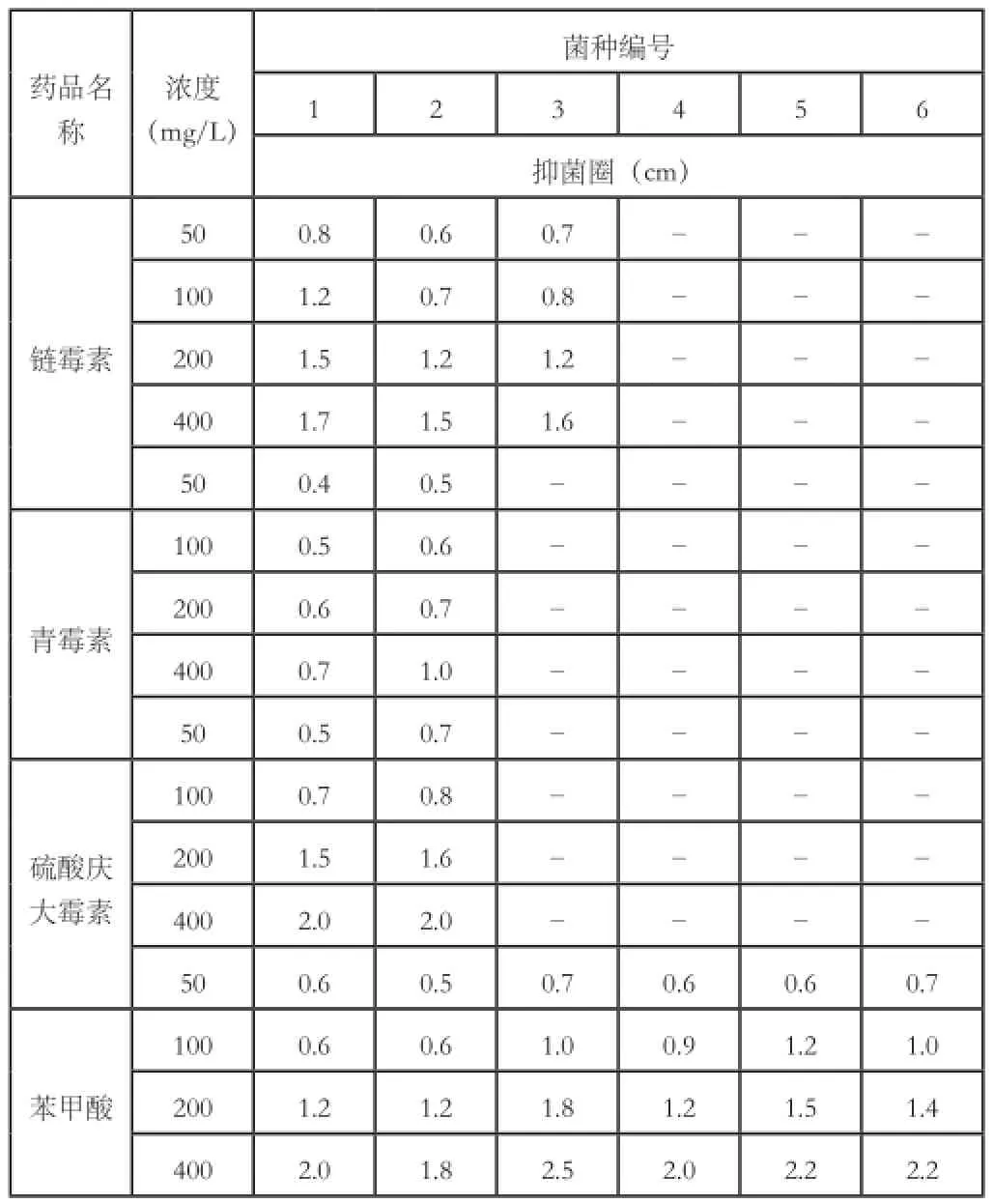
表3 滤纸片法抑菌实验
从上表可以看出,四种药品中青霉素的效果最差,因为它主要作用于革兰氏阳性细菌细胞壁上的肽聚糖,革兰氏阴性细菌细胞壁中肽聚糖含量较少,故对2号的抑制效果由于对1号菌。其它三种药品又以苯甲酸的抑菌效果最全面,对6种菌均有抑制作用,而且效果较好。当这三种药品达到200mg/L时均有较好的抑菌效果。但是考虑到单独使用一种药品,高浓度长时间抑菌会使微生物产生抗药性。因此,将三种药品加以组合用于兰苗培养过程中的抑菌。实验结果见下表。
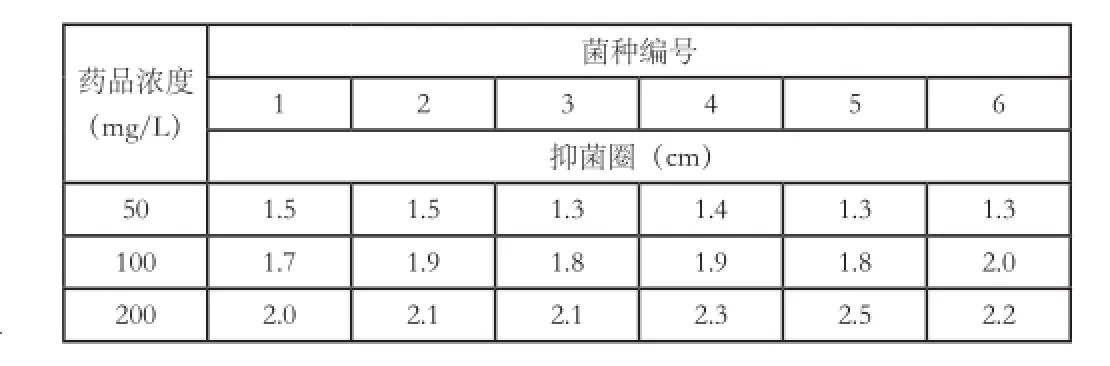
表4 组合药品抑菌圈测试
从上表可以看到,链霉素、庆大霉素、苯甲酸都是相同浓度组合效果优于表3中在相同浓度条件下单独使用一种药品的抑菌效果好。随着浓度的增加,抑菌圈越大,但是考虑到过高药品浓度会对蝴蝶兰苗的生长造成影响,以及使微生物产生抗药性,因此选择中间浓度的药品组合用于抑菌[5-7]。
2.3 抑菌剂对蝴蝶兰瓶苗生长的影响
采用100mg/L和200mg/L的药品添加到蝴蝶兰增殖培养基中观察对蝴蝶兰苗生长的影响。发现200mg/L对蝴蝶兰苗的生长影响较大,叶片生长缓慢,易黄化。而采用100mg/L的组合则没有受到影响,结果见下表5。

表5 组合抗菌剂对接种90d蝴蝶兰瓶苗生长的影响
3 结语
本实验对蝴蝶兰污染瓶苗中的污染微生物进行分离纯化剂初步鉴定,得到常见污染物有6种,其中1号为球菌、2号为杆菌、3号为酵母菌、4号为木霉、5号为黑曲霉,6号为青霉菌。采用100mg/ L链霉素+100mg/L庆大霉素+100mg/L苯甲酸处理,可以得到非常好的抑菌效果,同时对蝴蝶兰苗的增殖生长影响很小。
参考文献:
[1]李娟.蝴蝶兰再生体系的建立及组织培养中的污染防治研究[D].
[2]于福科, 张广军.玫瑰组织培养污染控制技术措施. 陕西农业科学, 2002(11):47-48.
[3]周俊辉, 周厚高, 刘花全.植物组织培养中的内生细菌污染问题[J].广西植物, 2003,23(01):41-47.
[4]时群.红掌组织培养污染率控制研究(简报)[J].亚热带植物科学,2010(03):80-81.
[5]潭文澄.观赏植物组织培养技术[M].北京:中国林业出版社,1991.
[6]谢凤琦,张金莲,董新玉.植物组织培养中常见病原菌种类及污染控制措施[J].林业科技,2014(02):182-183.
[7] 訾梅廷,徐连峰,李振海等.林木组织培养及工厂化育苗中污染的控制技术[J].防护林科技,2005(03):45-46.
项目支撑:2013年江苏省大学生创新训练计划项目(编号:201311585004Y)
指导教师1:罗丽(1977-),女,副教授。
指导教师2:郑霞(1977-),女,高级实验师。
作者简介:薄维超(1994-),男,汉族。连云港师范高等专科学校海洋港口学院12级学生。
